Стійкість метеликів молочаю до токсинів рослин пов’язана з секвестрацією, не справляючись з токсичною дієтою
Пов’язані дані
Неопрацьовані дані, про які повідомляється в цій роботі, були розміщені в Дріаді: http://dx.doi.org/10.5061/dryad.3jm4q.
Анотація
1. Вступ
Багаторічна модель коеволюції стверджує, що взаємна адаптація у взаємодії видів може призвести до гонки озброєнь ескалаційних фенотипів [1,2]. Відповідно, пристосування рослиноїдних комах до вмісту рослинних токсинів, як правило, трактується як еволюційна реакція на захист рослин, що має вирішальне значення для використання певних видів рослин як дієтичного ресурсу [3–8]. Навпаки, еволюція специфічних адаптацій для полегшення секвестрації рослинних токсинів (тобто поглинання токсинів через кишечник та їх утримання в організмі [9]) передбачає хижаків та паразитоїдів (третій трофічний рівень) або контроль зверху вниз, як рушійна сила в коеволюції рослин і рослиноїдних тварин. Незважаючи на широке розуміння секвестрації як надзвичайного компонента спеціалізації рослин-господарів та адаптації до хижацтва [9,10], механізми інтеграції секвестрації в теорію коеволюції [3,11] навряд чи зрозумілі. Щоб перевірити відносну важливість боротьби з токсичною дієтою проти секвестрації токсинів у формуванні адаптацій комах, тут ми оцінюємо функціональні наслідки еволюційно ескалаторної ознаки стійкості у молочаїв метеликів [12,13].
Карденоліди (серцеві глікозиди) - це сильнодіючі рослинні токсини, які специфічно інгібують Na +/K + -ATP-азу, важливий транспортний катіон тварин [14,15]. Примітно, що молекулярна адаптація до карденолідів через змінені Na +/K + -ATPases (нечутливість до цільової ділянки) еволюціонувала конвергентно щонайменше у п’яти порядках рослиноїдних комах [16–18]. Стійкість до комах Na +/K + -ATPase заснована на специфічних заміщеннях амінокислот, що змінюють властивості зв'язування карденолідів Na +/K + -ATPase, і вперше описана у метелика-монарха (Danaus plexippus) [19,20].
Метелик-монарх також являє собою класичний випадок набутого захисту, коли гусениці не тільки переносять, але й секвеструють карденоліди від своїх рослин-господарів молочаю (Asclepias spp., Apocynaceae) і передають ці токсини на стадію метеликів для власної захисту від хижаків та паразитів. [21–23]. Практично всі 160 метеликів молочаю з племені Данаїні (Nymphalidae) спеціалізуються на рослинах-хазяїнах Apocynaceae, які часто продукують карденоліди [15], що свідчить про довгу та спільну еволюційну історію. Однак у межах Данайні стійкість Na +/K + -ATPase розвивалася поетапно, в результаті чого утворилися три форми Na +/K + -ATPase зі збільшенням стійкості до карденолідів. Серед 16 видів Данаїні, гени Na +/K + -ATPase яких були секвенировані, а Na +/K + -ATPase фізіологічно досліджені, стійкість до карденолідів визначали за допомогою трьох дискретних молекулярних форм [12].
Незважаючи на загальне визнання тритрофних взаємодій як важливого фактору взаємодії рослин і комах [25,26], невідомо, як третій трофічний рівень може впливати на взаємну адаптацію між рослинами та комахами [3]. Добре встановлено, що карденоліди захищають метеликів-монархів від нападів птахів [21], а метелики-монархи та королеви є моделями мімікриї для віце-короля (Limenitis archippus) [27,28], що підкреслює ефективність секвестрації карденоліду як захист. Крім того, було показано, що у видів метеликів молочаїв (D. plexippus, звичайний тигр, D. chrysippus та E. core) рвотна здатність, що діє на хижаків, пов’язана із кількістю збережених карденолідів [29]. Таким чином, наше дослідження пропонує механізм того, як третій трофічний рівень може брати участь у коеволюції рослин і комах, сприяючи зміні толерантності та використанню токсинів рослиноїдними. Дійсно, метелики-молочаї є моделлю для просування наших знань про те, як складні взаємодії спільнот сформували еволюцію видів на молекулярному та фізіологічному рівнях.
2. Матеріал і методи
(а) Комахи
Ядро евплої утримували в сітчастій клітці в теплиці для отримання яєць. Яйця Danaus gilippus та D. plexippus були придбані у комерційних селекціонерів. Робота з E. core та D. gilippus була дозволена за дозволом USDA номер P526P-12-05106. Яйця метеликів дезінфікували поверхнею 100 ppm розчину оксину (Bio-Cide, International Inc., Norman, OK, USA) у воді (0,01% ClO2) протягом 10 хв, щоб запобігти потенційному переносу паразитів [30].
(b) Рослини
Насіння Asclepias (asperula, curassavica, cordifolia, hallii, linaria, incarnata, syriaca та viridis) отримували комерційно або збирали в полі. Насіння обробляли побутовим відбілювачем (5%) протягом 5 хв, стригли та холодно стратифікували протягом 7 днів. Після проростання при 28 ° С саджанці висаджували в горщики об’ємом 500 мл, наповнені ґрунтовою землею (Metro-Mix; Садівництво Сан Гро, Канада CM Ltd, Ванкувер, Канада). Рослини удобрювали (NPK 21: 5: 20, 150 ppm N) через 10 і через 20 днів і поливали за потреби. Рослини (неквітучі) використовували для експериментів після чотирьох-семи тижнів росту в прохідній камері в контрольованому середовищі (14: 10 год цикл день/ніч, 400 мікроейнштейнів м −2 с −1 світла, 27 ° C/24 ° C). Просторове розташування рослин було рандомізовано в камері.
(c) Експеримент зі зростання гусениці
Щоб перевірити вплив карденолідів на ріст гусениць, новонароджених гусениць трьох видів переносили окремо на рослини Asclepias (тобто одна рослина отримувала лише одну гусеницю). Через 3 і 5 днів перебування в екологічній камері за тих самих умов, що використовувались для росту рослин, масу тіла гусениць реєстрували за допомогою мікробалансу (AT21 Comparator, Mettler Toledo, Columbus, OH, USA). Після зважування гусениці були повторно застосовані до вихідних рослин. Також на п’ятий день відбирали зразки листя для аналізу на карденоліди, а гусениці на рослинах ставили в клітку в сітчастий рукав. Гусениці залишались на рослинах, поки не досягли четвертої чи п’ятої стадії. Для оцінки росту гусениць (5 днів) гусениці тримали на одній рослині, і ні в якому разі не було з’їдено більше 50% листя. Пізніше рослини замінили свіжими рослинами того ж виду, якщо це було необхідно. Загалом було проведено п’ять блоків експерименту зі зростання гусениць. У кожному блоці використовували всі вісім видів Asclepias. Див. Електронний додатковий матеріал, таблицю S1, щодо кількості ваги гусениці, отриманої на блок. Розміри зразків для кожної комбінації видів комах та рослин вказані в електронному додатковому матеріалі, таблиця S2.
(d) Забір гемолімфи
Для оцінки секвестрації карденолідів у порожнину тіла ми дослідили гемолімфу личинок у всіх трьох видів гусениць, отриманих під час вигодовування личинок 4 або 5 (останньої) інстанції шляхом розрізання одного або двох щупалець (перша пара). Певний об'єм гемолімфи (5–80 мкл, з 77% зразків від 20 до 70 мкл) піпетували у 200 мкл метанолу в 1,5 мл пробірках Еппендорфа, зразки змішували (вихрові) і згодом центрифугували при 20 000 г протягом 3 хв. для осадження гемолімфного білка. Супернатанти переносили у флакони із гвинтовою кришкою об’ємом 2 мл і зберігали при -20 ° C до подальшої обробки. Після відбору проб гемолімфи гусениці заморожували, зберігали при -80 ° C і з часом заморожували.
(e) Підготовка зразків гемолімфи для нанесення на Na +/K + -ATPase
Супернатанти (див. Вище) висушували у вакуумному концентраторі і залишки розчиняли в 200 мкл метанолу. Після обробки зразків протягом 10 хв в ультразвуковій ванні та центрифугування (3 хв при 5000g) супернатанти переносили у свіжі пробірки. Еквівалент 10 мкл (D. gilippus і D. plexippus) або 5 мкл (E. core) гемолімфи видаляли і висушували у свіжій пробірці (решту вихідного зразка також висушували для високоефективного рідинного хроматографічного аналізу ). Висушений залишок розчиняли у 20 мкл (D. gilippus і D. plexippus) або 10 мкл (E. core) ДМСО (диметилсульфоксид) шляхом вихрового перемішування та обробки протягом 10 хв в ультразвуковій ванні. Потім зразки змішували з 180 мкл або 90 мкл H2O для досягнення кінцевої концентрації 10% DMSO. Зразки зберігали при -20 ° C до нанесення на Na +/K + -ATPase.
(f) Аналізи Na +/K + -ATPase
Аналізи Na +/K + -ATPase проводили, як описано в [12]. Замість розчинів уабаїну [12] зразки гемолімфи гусениці застосовували на Na +/K + -ATPase E. core та на Na +/K + -ATPase донорського виду (наприклад, гемолімфа D. gilippus на D. gilippus Na +/K + -ATPase) паралельно (на тій же 96-лунковій пластині). Зразки гемолімфи, отримані з гусениць E. core, застосовувались лише на Na +/K + -ATPase E. core. Детально про аналізи Na +/K + -ATPase див. Електронний додатковий матеріал. Кількість зразків гемолімфи, нанесених на Na +/K + -ATPase, наведено в електронному додатковому матеріалі, таблиця S2.
(g) Підготовка зразків гемолімфи для високоефективної рідинної хроматографії
Екстракти гемолімфи в метанолі (див. Вище) висушували у вакуумному концентраторі; Додавали 60 мкл або 80 мкл метанолу, що містить 0,1 мг мл -1 дигітоксину (Sigma, Сент-Луїс, Міссурі, США) як внутрішній стандарт, і зразки інкубували протягом 10 хв в ультразвуковій ванні. Зразки центрифугували для видалення нерозчинених речовин, переносили у скляні вставки з 1,8-міліметровими флаконами для високоефективної рідинної хроматографії (ВЕРХ) і піддавали аналізу ВЕРХ. Див. Електронний додатковий матеріал, таблицю S2, щодо кількості проаналізованих зразків гемолімфи.
(h) Приготування зразків харчового болюсу та тіла гусениці для високоефективної рідинної хроматографії
Тканини тіла плюс шкірні покриви, епітелій середньої кишки (включаючи основну мускулатуру) та харчовий болюс (вміст кишечника) збирали з ліофілізованих гусениць (підгрупи гусениць, які раніше використовували для забору гемолімфи, див. Вище) та розтинали під стереомікроскоп (див. електронний додатковий матеріал, малюнок S1). Зразки гомогенізували, екстрагували метанолом, що містить дигітоксин як внутрішній стандарт, і піддавали ВЕРХ-аналізу. Детальна інформація про розміри зразків та підготовку наведена в електронному додатковому матеріалі.
(i) Підготовка рослинних зразків до аналізу на карденоліди
Зразки листя (як правило, два повністю розширених листка на рослину, кілька голкоподібних листків A. linaria), відібрані на п’ятий день експерименту, сушили в духовці (50 ° C) у конвертах для монет протягом декількох днів і згодом зберігали під умови навколишнього середовища. Після подрібнення зразки екстрагували метанолом (що містить дигітоксин як внутрішній стандарт) та аналізували за допомогою ВЕРХ. Деталі щодо обробки зразків описані в електронному додатковому матеріалі. Загальна кількість повторень становила A. incarnata = 13, A. syriaca = 13, A. hallii = 14, A. cordifolia = 15, A. viridis = 13, A. curassavica = 14, A. linaria = 9 та A. asperula = 12.
(j) Високоефективний рідинно-хроматографічний аналіз зразків
П’ятнадцять мікролітрів екстракту вводили у ВЕРХ Agilent серії 1100 і сполуки поділяли на колонці з оберненою фазою Gemini C18 (3 мкм, 150 × 4,6 мм, Phenomenex, Торранс, Каліфорнія, США). Карденоліди елюювали при постійному потоці 0,7 мл хв -1 з градієнтом ацетонітрил – H2O, як показано: 0–2 хв 16% ацетонітрилу, 25 хв 70% ацетонітрилу, 30 хв 95% ацетонітрилу, 35 хв 95% ацетонітрилу, 10 хв відновлення при 16% ацетонітрилі. Спектри поглинання УФ реєстрували від 200 до 400 нм за допомогою діодного детектора. Піки з симетричним максимумом поглинання між 216 і 222 нм реєстрували як карденоліди та кількісно визначали при 218 нм [31]. Концентрації розраховували на основі площі піку відомої концентрації дигітоксину. Детальна інформація про оцінку зразків болюсів рослин, гемолімфи та їжі наведена в електронному додатковому матеріалі.
(k) Експерименти на листових дисках
(л) Ін’єкційний експеримент
Для перевірки фізіологічних ефектів введення карденолідів у порожнину тіла гусеницям 3-ї або 4-ї стадії E. core та D. plexippus ін'єктували карданолід оуабаїн, розчинений у воді (10 -2 М) або в якості чистої води в якості контролю. Кількість повторень становила: E. сердечник, якому вводили H2O (n = 8) або ouabain (n = 13); D. plexippus, якому вводять H2O (n = 7) або уабаїн (n = 11). Перед ін’єкцією гусениці знеболювали на льоду приблизно 5 хв. Згодом або 2 мкл розчину H2O, або розчину уабаїну вводили в черевну дорсальну посудину під стереомікроскопом, використовуючи голку 34-го калібру, прикріплену до шприца на 25 мкл (Hamilton, Reno, NV, USA). Після ін’єкції гусениці тримали в пластикових стаканчиках із шматочком тканини та забезпечували шматочком листя Асклепія. На наступний день гусениці оглядали на відновлення, вимірюючи активність годівлі.
(м) Статистичний аналіз
Всі дані були проаналізовані з використанням узагальненого підходу найменших квадратів у JMP P ro, v. 10.0 (SAS Institute, Cary, NC, USA). Дані перевіряли на нормальність залишків для дисперсійного аналізу та кореляцій. Дані експерименту з листковими дисками аналізувались за допомогою підходу ANCOVA (JMP), запропонованого Raubenheimer & Simpson [32]; Початкова споживана маса гусениці та рослинна біомаса використовувались як коваріати при обробці карденолідом як незалежна змінна. Ми не виявили взаємодії між лікуванням та коваріатами, а отже, вилучили терміни взаємодії з аналізу. Нелінійне припасування кривої для аналізу активності Na +/K + -ATPase проводили з O rigin -P ro 9.1.0 (Originlab Corporation, Northampton, MA, USA) з використанням чотирипараметричної логістичної функції (верхня асимптота встановлена на 100, нижня асимптота встановлена на 0).
3. Результати та обговорення
(а) На ріст гусениць метеликів-молочаїв карденоліди не впливають
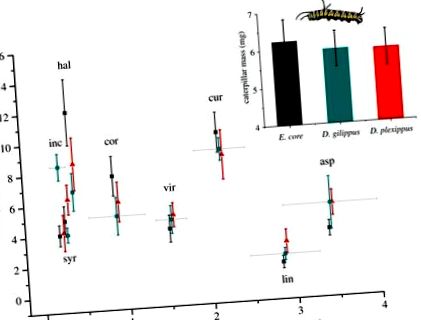
Через 3 дні ваги гусениць на восьми видах молочаю. Гусениці ядра Euploea (сірий, квадрати), Danaus gilippus (синій, кола) та D. plexippus (червоний, трикутники) були вирощені з інкубації на восьми видах асклепій. Середні концентрації карденоліду (± с. Е.) У листках показані на осі х. Коди видів: inc, Asclepias incarnata; syr, A. syriaca; хал, А. халлій; кор, A. cordifolia; vir, A. viridis; cur, A. curassavica; лін, A. linaria; осика, А. асперула. Врізка: середня маса гусениці (± с. Е.) Не відрізнялася серед трьох видів гусениць. (Інтернет-версія у кольорі.)
По-друге, маса гусениць не відрізнялася у трьох видів гусениць (F2,18 = 0,028, p = 0,973; рисунок 1, вставка), що вказує на те, що відмінності в стійкості Na +/K + -ATP-ази не відображалися на зростанні гусениці, навіть на рослинах з найбільшими концентраціями карденолідів (термін взаємодії між вмістом карденолідів у рослинах та видами гусениць: F2,18 = 0,169, p = 0,846). Розглядаючи кожен вид рослин окремо, гусениці мали різну масу лише на A. incarnata, яка була найнижчим видом карденолідів (F2,19 = 7,525, p = 0,004); личинкові маси на всіх інших видах рослин суттєво не відрізнялись. Нарешті, ми не виявили токсичності ізольованих карденолідів при подачі в ядро E. (обробка: F2,34 = 0,952, p = 0,396; початкова маса гусениці: F1,35 = 15,743, p, рисунок 2), демонструючи, що Na +/K + -Заміни ATPase не потрібні для захисту гусениць від токсичної дії харчових карденолідів.
- Як вирощувати та доглядати за рослиною Молочай звичайний
- Чи дієта «Парадокс рослин» змушує нас боятися здорової їжі?
- Зона здоров'я - спеціалісти з охорони здоров'я на основі рослин, Великобританія
- Чи пов’язане веганство з розладами харчування The Washington Post
- Здорові жири Худі на нерафінованих рослинних оліях - сьогоднішній журнал дієтологів