Сибутрамін зменшує годування, жирові відкладення та покращує резистентність до інсуліну у самців щурів Wistar, що страждають ожирінням, незалежно від нейропептиду Y гіпоталамуса.
Майкл Браун
1 1 Медичний факультет Ліверпульського університету, поштова скринька 147, Ліверпуль, L69 3GA
Чень Бінг
1 1 Медичний факультет Ліверпульського університету, поштова скринька 147, Ліверпуль, L69 3GA
Пітер Кінг
1 1 Медичний факультет Ліверпульського університету, поштова скринька 147, Ліверпуль, L69 3GA
Люсі Пікаванс
1 1 Медичний факультет Ліверпульського університету, поштова скринька 147, Ліверпуль, L69 3GA
Девід Хіл
2 2 Knoll Pharmaceuticals Research and Development, Ноттінгем, NG1 1GF
Джон Уайлдінг
1 1 Медичний факультет Ліверпульського університету, поштова скринька 147, Ліверпуль, L69 3GA
Анотація
Ми вивчали ефекти нового інгібітора зворотного захоплення норадреналіну та серотоніну (5-НТ) сибутраміну на годування та масу тіла у моделі щурів при дієтичному ожирінні та чи взаємодіє він з нейронами гіпоталамічного нейропептиду Y (NPY).
Чоловічим щурам Wistar, котрим годували чау та страждали ожирінням (DIO), давали сибутрамін (3 мг кг-1 день -1 п.о.) або деіонізовану воду протягом 21 дня.
Сибутрамін зменшував споживання їжі протягом усього періоду лікування у обох страждаючих ожирінням щурів (Р Ключові слова: Ожиріння, сибутрамін, HOMA, лептин, нейропептид Y
Вступ
Сибутрамін (BTS 54 524; N - N, N-диметиламіну гідрохлорид моногідрат) - це новий препарат проти ожиріння 5-НТ та інгібітор зворотного захоплення норадреналіну (SNRI) (Stock, 1997), який нещодавно отримав ліцензію на лікування ожиріння у кількох країнах. Вважається, що механізми зниження ваги, спричиненого сибутраміном, включають посилення ситості (Halford et al., 1998) та підвищення термогенезу (Connoley et al., 1999; Hansen et al., 1998; McNeely & Goa, 1998). Сибутрамін помітно знижує поведінку годування та ефективно стимулює зниження ваги у худорлявих та генетично ожирілих гризунів (Stricker-Kongrad et al., 1995). Більше того, це покращує толерантність до глюкози і знижує рівень інсуліну в плазмі крові у цих тварин, маючи на увазі, що сибутрамін може покращити чутливість до інсуліну (Day & Bailey, 1998).
Попередня обробка антагоністами 5-НТ або норадреналіну може частково або повністю змінити гіпофагічний ефект сибутраміну, вказуючи на те, що обидва нейромедіатори беруть участь у його фармакологічних діях. Крім того, флуоксетин та нізоксетин, які є селективними інгібіторами зворотного захоплення 5-НТ та норадреналіну, відповідно не впливають на споживання їжі, однак вони суттєво інгібують прийом їжі при комбінованому застосуванні (еквівалентно дії сибутраміну), демонструючи синергетичний ефект взаємодія цих двох моноамінів у контролі надмірної поведінки (Jackson et al., 1997a). Застосування селективних антагоністів моноамінів підтвердило, що гострі індукуючі насичення ефекти сибутраміну включають адренорецептори α1 і β1, а також рецептори 5HTc і, можливо, 5HT2A (Jackson et al., 1997b). Оскільки ні сибутрамін, ні два його метаболіти не виявляють спорідненості до рецепторів α1, β1 або 5НТ, схоже, препарат посилює моноамінергічну функцію, інгібуючи поглинання норадреналіну та 5НТ (Heal et al., 1998).
5-HT діє на гіпоталамус, викликаючи анорексію, втрату ваги (Blundell et al., 1995) та посилений термогенез (Le Feuvre et al., 1991). Велика кількість пептидів та інших нейромедіаторів, знайдених у гіпоталамусі, впливає на енергетичний баланс, включаючи нейропептид Y (NPY), галанін, стимулюючий гормон меланоцитів (через рецептор меланокортину-4), а нещодавно пов'язаний з кокаїном та амфетаміном транскрипт (CART) ( Вільямс та ін., 2000). Існують дані, які свідчать про те, що дії ожиріння на серотонін можуть бути опосередковані інгібуванням гіпоталамусових нейронів, що експресують потужний стимулюючий апетит пептид NPY (Dryden et al., 1996; Rogers et al., 1991), і тому це дослідження було зосереджено про можливу участь NPY у опосередкуванні впливу сибутраміну на енергетичний баланс.
На відміну від моделей щурів, більшість людей із ожирінням є полігенними, і це пов’язано з труднощами в регулюванні прийому їжі в умовах підвищеної доступності смачних страв та зниження фізичної активності (Andersson, 1996). У щурів, що харчуються дуже смачною дієтою, розвивається помірне ожиріння, яке, як і більшість ожиріння у людей, пов’язане (принаймні у молодих тварин), із збільшенням споживання їжі, підвищеним термогенезом та резистентністю до інсуліну (Stock & Rothwell, 1986). Тому ми вибрали цю модель для своїх досліджень, які були розроблені, щоб відповісти на наступні запитання щодо того, чи ефективний сибутрамін у зменшенні маси тіла при ДІО, і, по-друге, чи поліпшив сибутрамін резистентність до інсуліну в цій моделі та, нарешті, чи опосередковані ефекти сибутраміну в частина шляхом модуляції нейронів гіпоталамусу NPY.
Методи
Тварини
Дев'яносто шість самців щурів Wistar (150 - 200 г; A. Tuck and Sons, Кембридж, Великобританія) були випадковим чином розподілені в дві групи, кожна з яких містила 48 щурів, і розміщені окремо в клітках із дротяним дном у кімнаті, що підтримується при 22 ° C., при оберненому фазовому освітленні 12 год темряви: світловий цикл (загоряється о 0300 год). Сорок вісім щурів годували дуже смачною дієтою протягом 12 тижнів, яка складалася з 33% чау (CRM, Biosure, Кембридж, Великобританія), 33% молока Nestlé (Nestlé, Великобританія), 7% сахарози (Tate & Lyle, Великобританія) та 27 % водопровідної води за вагою. Ця дієта забезпечує надійний приріст ваги порівняно з контролем, забезпечуючи 68% енергії як вуглеводи, 16% як білок і 13% як жир (Wilding et al., 1992b). Решта 48 тварин мали вільний доступ до стандартної гранульованої чау-їжі (CRM, Biosure, Cambridge, UK), яка забезпечує 76,8% енергії у вигляді вуглеводів, 19,2% у вигляді білка та 4,3% у вигляді жиру.
Процедури лікування
Після 12 тижнів дієтичних маніпуляцій 16 тваринам у кожній групі отримували або сибутрамін, і годували їх у парі, щоб відповідати споживанню тварин, оброблених сибутраміном, або обробляли лише носієм. Сибутрамін HCl був синтезований у Knoll Pharmaceuticals (Ноттінгем, Великобританія) і розчинений у деіонізованій воді об'ємом дози 1 мл кг -1 і вводився 1200 годин на добу в дозі 3 мг кг -1 день щоденно. пробіркою протягом 21 дня. Раніше було показано, що ця доза є ефективною для зменшення споживання їжі щурами та зменшення споживання їжі на 50% протягом 2 годин (Jackson et al., 1997a). Худотники та особи, що страждають ожирінням, отримували однаковий обсяг деіонізованої води. Вага тіла та споживання їжі вимірювались безпосередньо перед введенням препарату щодня протягом усього періоду лікування.
В кінці дослідження щурів вбивали вдиханням вуглекислого газу і негайно знекровляли серцевою пункцією. Плазму зберігали при -40 ° C для подальшого вимірювання концентрації лептину, інсуліну та глюкози. Біла жирова тканина придатків та надниркової залози разом із м’язом шлунково-кишкового тракту була розсічена та зважена, щоб дозволити розрахувати співвідношення жир/нежирність. Усі процедури на тваринах проводились згідно з правилами Міністерства внутрішніх справ Великобританії під керівництвом відповідної ліцензії на проект.
Мікродісекція гіпоталамуса
Для вимірювання мРНК NPY (n = 8 тварин на групу) блок медіобазальної тканини гіпоталамуса розсікали з лобового зрізу мозку, вирізаного між середньою оптичною хіазмою і тілами ссавців. Блок поширювався латерально до перигіпоталамічного ядра і вище передньої комісури; ARC - єдиний сайт, що містить значні рівні мРНК NPY у цих межах. Тканину негайно заморозили в рідкому азоті і зберігали при -80 ° C до подальшої екстракції РНК.
Для вимірювання регіональних рівнів гіпоталамусу NPY (n = 8 тварин на групу) мозок швидко видаляли, а блок, включаючи гіпоталамус, видаляли вертикальними зрізами на 1 мм спереду від хіазми зорового нерва та безпосередньо ззаду від тіл ссавців. Згодом вісім лобових зрізів розміром 350 - 500 мкм вирізали з тканинного блоку, використовуючи вібруючий мікротом, як описано раніше (Bing et al., 1999). Наступні шість вибраних областей були мікродисековані шляхом пробивання тупою голкою 18-го калібру: PVN, MPO, VMH, DMN, LHA та ARC (включаючи середню висоту). Тканину з кожної ділянки кожної щури об’єднували і кип’ятили протягом 10 хв у 400 мкл 0,1 М соляної кислоти, а зразки обробляли ультразвуком протягом 30 с для розпорошення тканини та вилучення NPY. Екстракти заморожували при -40 ° C до аналізу концентрації NPY та білка.
Аналізи
Регіональні концентрації гіпоталамусової NPY вимірювали за допомогою власного радіоімунологічного аналізу (RIA), який використовував 125 I-мічених свинячих NPY (pNPY; Amersham, Бакінгемшир, Великобританія) та pNPY як стандарт (Bachem Inc, Essex, UK). Антисироватка NPY, вирощена в нашій лабораторії у кролика проти свинячого NPY, використовувалася в остаточному розведенні 1: 90 000. Чутливість аналізу становила 2 фмоль на пробірку, з коефіцієнтом варіації внутрішньо аналізу (CV) М фосфату натрію (pH 7,0) та 7% SDS. Гібридизація була при 42 ° C протягом ночі в розчині перед гібридизацією з 42-мерним олігонуклеотидом (R&D Systems, Oxon, UK), який був мічений кінцем (3 ′ і 5 ′) дигоксигеніном у концентрації 25 нг мл −1 . Промивки після гібридизації проводили, як описано раніше (Trayhurn & Duncan, 1994). Мембрану інкубували з антитілом проти дигоксигеніна (фрагмент Fab; Boehringer), яке кон'югували з лужною фосфатазою, протягом 30 хв при кімнатній температурі. Потім мембрану розпорошували 0,25 мМ хемілюмінесцентним субстратом CDP-зіркою (Tropix, MA, США). Сигнали отримували шляхом впливу мембрани на рентгенівську плівку протягом 30 хв при кімнатній температурі, а смугу 0,9 кб, що відповідає мРНК NPY, кількісно визначали за допомогою денситометрії сканування зображень (AIS System, Imaging Technology, University of Brock, St Catherines, Ontario, Канада).
Щоб перевірити завантаження і передачу РНК під час промокання, помарку позбавили і повторно дослідили на 18S рРНК 31-мерним міченим дигоксигеніном антисмисловим олігонуклеотидом у концентрації 10 пг/мл, як описано раніше (Trayhurn et al., 1995). Кількість мРНК NPY виражали як відношення мРНК NPY/18S рРНК.
Статистичний аналіз
Дані виражаються як середнє значення ± с. Е. Середнє. Аналіти крові та рівні мРНК NPY порівнювали між групами за допомогою одностороннього дисперсійного аналізу (ANOVA). Для прийому їжі, маси тіла та концентрацій NPY в окремих регіонах гіпоталамусу проводили двосторонній ANOVA, поєднаний з пост-hoc модифікованим t-тестом Bonferonni, щоб визначити, чи існують суттєві відмінності між групами. Потім групові відмінності рівнів NPY в окремих ядрах були додатково вивчені за допомогою непарного t-критерію Стьюдента. Значення Р 0,05 або менше на рівні двох хвостів було прийнято як значуще.
Результати
Вплив дуже смачної дієти на масу тіла
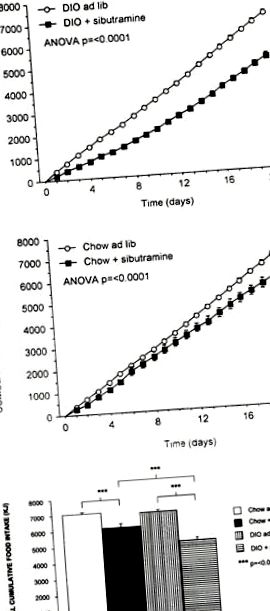
Кумулятивне споживання їжі у щурів DIO (a) та чау-чау (b), яких перорально отримували сибутраміном (3 мг кг −1 день –1 п.о.) або носієм протягом 21 дня. Показати DIO-контроль (n = 16), DIO, оброблений сибутраміном (n = 16), чау-контроль (n = 16) та чау, оброблений сибутраміном (n = 16) (означає ± s.e. середнє). Загальне кумулятивне споживання їжі для обох експериментальних груп показано в (c) (n = 16) (означає ± s.e. середнє).
Кінцева маса тіла DIO та щурів, яких годували чау, перорально отримували сибутрамін (3 мг кг -1 день - 1 р.о.) або носій протягом 21 днів (n = 16 на групу; означає ± s.e. середнє).
Співвідношення жиру/нежирності DIO та щурів, що харчуються/годують перорально, перорально отримуючи сибутрамін (3 мг кг -1 день -1 р.о.) або розчинник протягом 21 дня (n = 16 на групу; означає ± s.e. середнє).
Концентрації лептину в плазмі та аналіз HOMA
Рівні лептину в плазмі крові були в 3 рази вищими (P Рисунок 4). Сибутрамін спричинив зниження рівня лептину на 63% у людей, що страждають ожирінням (Р Малюнок 4).
Рівень лептину в плазмі ДІО та щурів, що годували чау, перорально отримували сибутрамін (3 мг кг-1 день -1 р.о.) або носій протягом 21 днів (n = 12 на групу; означає ± с.е. середнє).
HOMA-індекс ДІО та щурів, яких годували чау, одержували перорально сибутраміном (3 мг кг -1 день -1 р.о.) або носієм протягом 21 дня (n = 12 на групу; означає ± с.е. середнє).
Рівні мРНК NPY та NPY гіпоталамусу
Рівні мРНК гіпоталамусової NPY не змінювались у щурів, що страждали ожирінням, порівняно з щурами, що годувались чау (P = ns) (Таблиця 1). Суттєвих змін у рівнях мРНК NPY не було пов'язано з лікуванням сибутраміном або парним вигодовуванням тварин (Таблиця 1).
Таблиця 1
Зміни загальної кількості мРНК гіпоталамусу NPY та концентрації пептиду NPY в окремих ядрах гіпоталамусу після дієтичних маніпуляцій та лікування сибутраміном
Концентрації NPY у шести регіонах гіпоталамусу у контрольних щурів, що страждають ожирінням та чау-харчуванням, оброблених сибутраміном (n = 8) або деіонізованим (n = 8), або парним (n = 8) протягом 21 дня, наведені в таблиці 1 . Двостороння ANOVA показала, що не було суттєвих ефектів, пов’язаних з групою. Жодне лікування сибутраміном або парне годування не мали суттєвого впливу на концентрацію NPY в окремих ядрах гіпоталамусу (Таблиця 1).
Обговорення
Наші результати показують, що сибутрамін значно послаблює споживання їжі та збільшення маси тіла у щурів, які страждають ожирінням Wistar. Крім того, ця втрата ваги супроводжується виснаженням запасів жиру в організмі. Лікування сибутраміном також покращує резистентність до інсуліну, що спостерігається у цій моделі ожиріння. Однак, на відміну від раніше вивільнених серотонін-агентів (Dryden et al., 1996; Rogers et al., 1991), сибутрамін, здається, не опосередковує ці ефекти, змінюючи гіпоталамічний NPY.
Ми використовували пероральну дозу сибутраміну (3 мг кг -1 день на день -1 день), що спричинило зменшення споживання їжі та збільшення маси тіла у щурів із ожирінням, що страждали на дієту. Ці дані узгоджуються з попереднім дослідженням (Fantino et al., 1995). За погодженням з дослідженнями на людей із ожирінням, зміни в складі тіла, спричинені сибутраміном, відображались виснаженням жирової тканини, а не м’язової маси (Griffiths et al., 1995). Цей ефект був відображений супутнім зниженням рівня лептину в плазмі крові, яке було пропорційним як у групах, що харчуються чау, так і в дієтичних групах ожиріння, до зниженої маси жиру, що узгоджується з кореляцією лептину з масою жиру в організмі гризунів та людей (Considine et al., 1996; Maffei et al., 1995; Solin et al., 1997).
Відповідно до відомого зв’язку між ожирінням, резистентністю до інсуліну та діабетом, втрата ваги у дієтичній групі із ожирінням сибутраміну була пов’язана із падінням індексу HOMA, що свідчить про покращення інсулінорезистентності. Інсулінорезистентність була покращена в більшій мірі при лікуванні сибутраміном порівняно з дієтичною групою із ожирінням, що вказує на пару, що припускає, що сибутрамін може мати незалежний ефект для покращення чутливості до інсуліну, крім тих ефектів, які зумовлені втратою ваги. Це може бути пов'язано із селективною втратою жирової тканини, яка спостерігається при лікуванні сибутраміном, оскільки ожиріння є важливим фактором, що визначає чутливість до інсуліну (Jung, 1997) або прямим ефектом, як нещодавно повідомлялося (Day & Bailey, 1998).
Останні дані свідчать про те, що у схильних до діобіозних ДІО щурів рівень дугоподібної мРНК NPY, ніж стійкі до дієти щури, перед вживанням високоенергетичної дієти, однак підвищений рівень NPY знижується через 12 тижнів споживання великої енергетичної дієти (Левін, 1999). Це може бути результатом результатів цього дослідження, де щури DIO не виявляли змін у гіпоталамічній NPY після 15 тижнів дієти. Це свідчить про те, що сибутрамін діє незалежно від системи NPYergic. Цікаво, що рівень NPY та мРНК не впливав на парне годування. Однак протягом останніх 4 днів дослідження споживання їжі між групами, які отримували сибутрамін, та необробленими групами ad libitum істотно не відрізнялося. Це означає, що групи, що годувались паром, отримували однакову кількість їжі з необробленими групами ad libitum і не перебували в умовах, які могли б викликати регуляцію гіпоталамусу NPY, який зазвичай спостерігається у гризунів з обмеженим харчуванням (Abizaid et al., 1997; Brady et співавт., 1990; Dryden et al., 1996; Lewis et al., 1993).
Гіпоталамусний контроль апетиту є складним, і різні компоненти виконують специфічні функції регулювання ситості, голоду, вибору їжі та витрат енергії, зі значним ступенем надмірності, наприклад, миша-нокаут NPY нормально набирає масу тіла (Williams et al., 2000 ). Тому цілком можливо, що сибутрамін може змінити споживання їжі та/або витрати енергії, впливаючи на одну або більше інших пептидергічних та непептидергічних нейромедіаторних систем гіпоталамусу, які беруть участь у контролі енергетичного балансу, але не були оцінені в дослідженнях, описаних тут. Однак для відповіді на ці питання знадобляться подальші дослідження.
На закінчення ми показали, що сибутрамін індукує гіпофагію та уповільнює збільшення ваги у щурів Wistar, що харчуються чау. Ці зміни супроводжувались переважною втратою запасів жиру в організмі та покращенням чутливості до інсуліну. Крім того, представлені тут дані дозволяють припустити, що сибутрамін діє незалежно від системи NPYergic.
- Мієлопероксидаза Терапевтична мішень для запобігання резистентності до інсуліну та метаболічних наслідків
- Різниця між ожирінням та резистентністю до інсуліну між дітьми пубертатного та передпубертатного періоду ESPE2019 58th
- Індуковане цукром ожиріння та резистентність до інсуліну відокремлені від скороченого виживання при дрозофілі -
- Індукована ожирінням резистентність до інсуліну та гіперглікемія етіологічні фактори та молекулярні механізми -
- Q; Кафедра опору фізичного тіла фізичного університету Іллінойсу в Урбана-Шампейн