Швидкість синтезу білка з печінкою збільшується при пероральному харчуванні у хворих на рак, які втрачають вагу
Кафедра хірургії, Королівський лазарет Единбурга, Единбург EH3 9YW;
Кафедра хірургії, Королівський лазарет Единбурга, Единбург EH3 9YW;
Кафедра хірургії, Королівський лазарет Глазго, Глазго G31 2ER; і
Лабораторія біохімії ізотопів, Науково-реакторний центр шотландських університетів, Іст-Кілбрайд, Великобританія G75 0QF
Кафедра хірургії, Королівський лазарет Единбурга, Единбург EH3 9YW;
Лабораторія біохімії ізотопів, Науково-реакторний центр шотландських університетів, Іст-Кілбрайд, Великобританія G75 0QF
Анотація
Раніше було показано, що у стані голодування загальна швидкість синтезу альбуміну не змінюється у пацієнтів із запущеним раком порівняно з контролем, незважаючи на значно нижчі концентрації альбуміну (19). Навпаки, загальна швидкість синтезу фібриногену суттєво збільшується у стані голодування у хворих на рак, що супроводжується більш високими концентраціями в циркуляції порівняно з контролем (33). Це свідчить про те, що принаймні при голодуванні альбуміну знижена швидкість синтезу не пояснює спостережувану гіпоальбумінемію. На відміну від цього, концентрація фібриногену в плазмі відображає, принаймні частково, підвищену швидкість синтезу.
Вважається, що синтез альбуміну стимулюється годуванням у здорових суб'єктів (13, 24); проте, на відміну від цього, синтез фібриногену залишається незмінним (10, 13). Якби була знижена синтетична реакція альбуміну на годування раком, це могло б сприяти гіпоальбумінемії. Як варіант, якби посилився синтез фібриногену у відповідь на годування раком (і цей процес впливав на інші позитивні білки гострої фази), то це може сприяти метаболічним потребам в азотній економіці таких пацієнтів і, зрештою, може призвести до втрати худорлявої маси тканини, особливо якщо обмеження споживання дієтичного білка.
Намагаючись дослідити ці гіпотези, метою цього дослідження було оцінити, чи мають пацієнти, що втрачають вагу із запущеним раком підшлункової залози, аномальну синтетичну реакцію альбуміну у годуванні та чи змінений синтез позитивного гострофазного білка фібриногену з годуванням у таких хворих.
Предмети.
У дослідженні було обстежено вісім пацієнтів з однозначним діагнозом раку підшлункової залози, які втрачали вагу, не маючи клінічних ознак асциту або периферичних набряків. Шість здорових людей, стабільних у вазі, служили контролем. Жоден з пацієнтів не отримував хіміо- або променевої терапії, і жоден не переніс операції протягом попередніх 4 тижнів. Жоден пацієнт не мав клінічних чи рентгенологічних ознак інфекції, не страждав жовтяницею, не мав тяжкої анемії або не отримував стероїдів. Дослідження було схвалено місцевим етичним комітетом, і всі суб’єкти дали письмову інформовану згоду.
Протокол дослідження.
Рис. 1.Протокол дослідження. РЗЕ, витрата енергії в спокої.
Приготування зразків та аналіз ізотопів.
Спосіб підготовки зразків був раніше описаний (27). Коротко, протокол дослідження вимагав вимірювання міченого збагачення фенілаланіном у плазмі вільного пулу фенілаланіну та плазмового альбуміну та фібриногену. Для аналізу вільного фенілаланіну зразки плазми 1,5 мл розбавляли 5 мл деіонізованої дистильованої води, додаючи 250 нмоль циклолейцину як внутрішній стандарт. Потім розбавлені зразки депротеїнізували за допомогою ультрафільтрації (конус Centrifree з 25000 молекулярною масою, Amicon, Глостершир, Великобританія) і підкислювали, а амінокислоти очищали катіонним обміном. [2 H5] - або [2 H8] збагачення фенілаланіном вимірювали за допомогою газової хроматографії-мас-спектрометрії (GC-MS) як йоготрет-похідне бутилдиметилсилилу (37). Встановлено, що [2 H8] фенілаланін з часом утворює [2 H7] фенілаланін (циркулюючий вільний фенілаланін складав ~ 50% [2 H7] фенілаланіну приблизно через 100 хв після заливної дози [2 H8] фенілаланіну). Це явище відбулося in vivo, а не в стандартах індикатора або під час обробки зразків. Для подолання цієї проблеми обидва ізотомери вимірювали у всіх зразках, і їх сума використовувалась у всіх розрахунках.
Альбумін екстрагували з 1 мл сироватки шляхом диференціальної розчинності в абсолютному етанолі з 10% (мас./Мас.) Білка, осадженого трихлороцтовою кислотою. Для видалення слідів вільного фенілаланіну етанольний розчин альбуміну тричі промивали 5 мл деіонізованої дистильованої води ультрафільтрацією. Потім очищений альбумін гідролізували і мічене збагачення фенілаланіном вимірювали за допомогою GC-MS (37).
Після триразового промивання плазми в ультрафільтраційній конусі, як описано вище, фібриноген видаляли у вигляді фібринового згустку. Згортання проводили шляхом розведення 1,5 мл плазми до 20 мл фізіологічного розчину та 0,5 мл хлориду кальцію (0,5 моль/л). Потім додавали п’ятнадцять одиниць тромбіну, що не містить альбуміну людини (Sigma, Poole, UK), і через 10 хв фібрин збирали на травленому скляному стрижні. Потім фібрин гідролізували у вакуумі при 145 ° С протягом 4 год 6 моль/л HCl, і його мічене збагачення фенілаланіном вимірювали, як описано вище.
Позначене збагачення фенілаланіном безплазмового пулу, альбумінів та фібриногену в стані голодування та годування показано на рис.2. 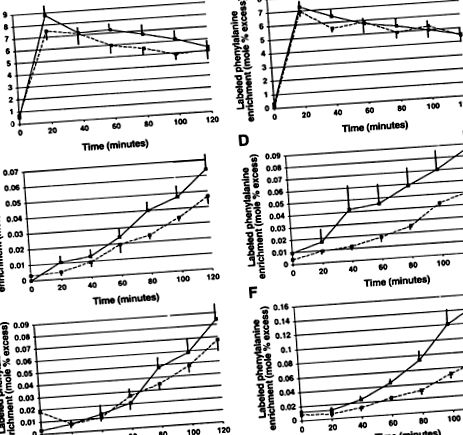
Рис.2.Позначене збагачення фенілаланіном безплазмового басейну (A і B), альбумін (C. іD) та фібриноген (Е і F) у піст (зліва) і годують (правильно) у здорових контрольних осіб (пунктирні лінії) та хворих на рак, що втрачають вагу (суцільні лінії). Наявні графіки означають ± SE.
Білкові аналізи.
Концентрації альбуміну в сироватці крові вимірювали за допомогою методу бромкрезолу зеленого кольору на автоматизованому аналізаторі Technicon RA-1000 (Technicon Instruments, Tarrytown, NY). Концентрації фібриногену в плазмі крові вимірювали шляхом оцінки часу згортання крові у присутності високої концентрації тромбіну на коагулометрі KC4A (Baxter Healthcare, Тетфорд, Великобританія).
Розрахунки.
Фракційні швидкості синтезу альбуміну та фібриногену розраховували шляхом ділення швидкості зміни міченого збагачення фенілаланіном альбуміну або фібриногену на площу під кривою збагачення попередника та часом (2).
Вимірювання посередника.
Зразки для вимірювання концентрації інсуліну, кортизолу та інтерлейкіну-6 відбирали о 8 ранку після нічного голодування. Концентрації інтерлейкіну-6 в сироватці крові вимірювали методом ІФА (Quantikine, R & D Systems, Abingdon, UK). Межа виявлення становила 0,5 пг/мл. Коефіцієнт варіації становив 2 тести, або тест Вілкоксона з підписаним рейтингом (Statview, Abacus Concepts, Берклі, Каліфорнія). A P значення
Таблиця 1. Характеристика онкологічних хворих та здорового контролю
Представлені значення є середніми та діапазоном. Порівняння за Un-тестом Манна Уітні або тестом χ 2.
Швидкості синтезу альбуміну наведені в таблиці 2. Зміни в синтезі альбумінів між стадом голодування та годування представлені на рис.3. Не було різниці в показниках синтезу альбумінів між хворими на рак, що втрачають вагу, та здоровими контролями натще [медіана 14,2 проти 15,7 г/деньP= 0,30)] або годують [загальна медіана швидкості синтезу 11,3 проти 13,9 г/день (P = 0,70)] стан. Онкологічні пацієнти та контрольна група продемонстрували подібний характер значущого стимулювання синтезу альбуміну у годуванні, медіани 29 та 24% відповідно.
Таблиця 2. Кінетика альбуміну у хворих на рак та здорових людей контролю
Значення - медіани, з діапазоном у дужках. FSR, швидкість дробового синтезу; ASR, абсолютна швидкість синтезу; TSR, загальна швидкість синтезу. Порівняння голодування проти годування за підписаним тестом рангового рейтингу Уілкоксона. Контроль проти порівняння пацієнта за U-тестом Манна Уїтні.
Рис.3.Загальні швидкості синтезу альбумінів у стані голодування та годування у здорових контрольних груп (A) та хворих на рак, що втрачають вагу (B). На графіку представлені медіани (символи) та діапазони (стовпці SE). Медіана зростання становить 24% для A і 29% для B.Порівняння значень натощак та годування здійснюється за підписаним тестом рангу Вілкоксона. Манн-Уітні не виявила суттєвої різниці між контролем та значеннями хворих на рак U-тест (P = 0,70 натще, P = 0,30 годується).
Швидкості синтезу фібриногену наведені в таблиці 3. Зміни в синтезі фібриногену між статами, що перебувають у стані, що перебуває у стані, що страждає від їжі та натощак, представлені на рис. Хворі на рак мали суттєво і суттєво підвищені показники синтезу фібриногену як натощак [медіана 3,3 проти 1,1 г/день (P = 0,0019)] та годували [медіана 4,5 проти 1,3 г/день (P = 0,0019)] стан у порівнянні з контролем. Не спостерігалось значних змін у синтезі фібриногену при годуванні у контрольних пацієнтів (медіана 14%,P = 0,12). Навпаки, спостерігалося статистично значуще стимулювання синтезу фібриногену під час годування у хворих на рак (медіана 38%, P = 0,012). Хоча відсоток стимуляції синтезу фібриногену суттєво не відрізнявся у контрольних та онкологічних хворих, між двома групами спостерігалася суттєва і значна абсолютна різниця у швидкості синтезу [медіана збільшення загальної швидкості синтезу фібриногену у хворих на рак 1,24 г/добу (діапазон 0,12 –6,91) проти 0,17 г/день (від –0,16 до +0,57) у контролі, P = 0,014].
Таблиця 3. Кінетика фібриногену у хворих на рак та здорових людей контролю
Значення - медіани з діапазонами в дужках. Порівняння голодування проти годування за підписаним тестом рангового рейтингу Уілкоксона Контроль проти порівняння пацієнта за U-тестом Манна Уїтні.
Рис.4.Загальні швидкості синтезу фібриногену натщесерце та у стані здорового контролю (A) та хворих на рак, що втрачають вагу (B). На графіку представлені медіани (символи) та діапазони (стовпці SE). Порівняння значень натощак та годування здійснюється за підписаним тестом рангу Вілкоксона. Різниця між контролем та значеннями хворих на рак за Манном-Уітні U-тест; P = 0,0019 як натщесерце, так і годування.
Це дослідження показало, що, незважаючи на значно нижчі концентрації циркулюючого альбуміну, пацієнти, які втрачають вагу, страждають на рак підшлункової залози, стимуляцією синтезу альбуміну під час годування, і ступінь, у якій це відбувається, є подібною до рівня здорових людей контролю. Концентрація фібриногену в циркуляції значно підвищена у хворих на рак, а в стані голодування синтез фібриногену значно підвищений вище контрольних значень. Хоча здорові особи не виявляють значного стимулювання синтезу фібриногену у годуванні, спостерігається значне збільшення при годуванні у хворих на рак.
Синтез альбумінів раніше не вивчався у годуванні у онкологічних хворих, але це дослідження, яке використовує метод заливної дози та пероральне годування, свідчить про те, що синтез стимулюється в аналогічному ступені (~ 30%) порівняно з контрольними суб'єктами. Таким чином, аномально низька синтетична реакція альбуміну на годування навряд чи може пояснити нижчі концентрації циркулюючого альбуміну у цих пацієнтів. Як і в попередніх дослідженнях (24), у цьому дослідженні розмір стимулюючого харчування визначався вимірюванням витрат енергії у спокої. Оскільки онкологічні хворі мали значно нижчу масу тіла, ніж контролі, з подібними витратами енергії у спокої, стимулювання годування було більшим на одиницю маси тіла у хворих на рак [медіана хворих на рак 3,15 ккал/кг (діапазон 2,73–3,37) проти контролю 2,36 ккал/кг (1,92–2,71), P = 0,0019]. Можливо, що цей порівняно більший розмір їжі міг сприяти значній стимуляції синтезу альбуміну та фібриногену у хворих на рак, тоді як лише синтез альбуміну, але не синтез фібриногену, був суттєво стимульований підживленням їжі у здорових людей контролю.
Як і в поточному дослідженні, раніше було показано, що синтез фібриногену підвищений удвічі у стані голодування у хворих на рак у порівнянні з контролем (33, 34). Більше того, подібне підвищення синтезу фібриногену було продемонстровано у пацієнтів з травмами та опіками (41), і це узгоджується з концепцією, що під час гострофазової відповіді швидкість синтезу позитивних реагентів, як правило, збільшується. У здорових суб’єктів було показано, що годування або не має ефекту (10, 13), або незначного (20%) стимулюючого впливу на синтез фібриногену (8). Це узгоджується з незначними змінами, які спостерігаються у здорових добровольців у поточному дослідженні. Навпаки, годування спричинило помітне подальше збільшення рівня синтезу фібриногену у хворих на рак. Подібне спостереження було зроблено у пацієнтів з травмою голови (25), і це свідчить про те, що після ініціювання реакції гострої фази такими факторами, як прозапальні цитокіни, синтез позитивних реагентів (наприклад, фібриноген) може бути стимульований і надалі. шляхом дієтичного споживання.
У цьому дослідженні для окремих суб'єктів не було очевидної взаємозв'язку між концентрацією білка, що циркулює, та швидкістю синтезу відповідного білка. Крім того, протягом 4-годинного періоду дослідження не спостерігалося значних змін концентрації альбуміну або фібриногену. Однак при швидкості дробового синтезу фібриногену натощак ∼1%/год, швидкості подачі ∼1,25%/год та частоті дробового розпаду ≥1%, не можна очікувати збільшення концентрації фібриногену з точністю до аналіз. З його більшим пулом та повільнішим товарообігом будь-яка зміна концентрації альбуміну буде ще меншою.
Швидкість синтезу білка є лише одним із факторів, що визначають концентрацію в циркуляції, але в даний час існує обмежена інформація про розпад білка гострої фази та транскапілярний вихід. Існують непрямі докази посилення розпаду фібриногену при раку з підвищеними концентраціями продуктів деградації фібрину (15,26); однак роль фібриногену в коагуляції ускладнює актуальність цієї знахідки. Встановлено, що транскапілярна втеча спостерігається з підвищеною швидкістю у хворих на рак, що втрачають вагу, і, як пропонується, сприяє гіпоальбумінемії реакції гострої фази (21). Однак повернення лімфи повинно бути збільшено так само, оскільки не існує взаємозв'язку між транскапілярним втечею та концентрацією альбуміну (1) і не змінюється внутрішньосудинний пул альбумінів при підвищеному транскапілярному втечі (4). Обмежена робота припускає помірне збільшення розпаду альбумінів у хворих на рак, хоча незрозуміло, чи втрачали досліджені пацієнти вагу (36). Також припускають, що сама пухлина може споживати альбумін (39), хоча значення цього явища в захворюваннях людини залишається незрозумілим. Подальше вивчення розпаду білка гострої фази у хворих на рак, які втрачають вагу.
Підводячи підсумок, це дослідження продемонструвало, що збільшення синтезу альбуміну при годуванні у хворих на рак є ідентичним такому в контрольних групах і що онкологічні пацієнти демонструють значну стимуляцію вже підвищеного синтезу фібриногену у годуванні. Ці висновки свідчать про те, що синтез білка в гострій фазі може представляти значне зменшення білкових запасів організму і, отже, може забезпечити механізм, завдяки якому реакція білка в гострій фазі пов'язана з прискоренням втрати худої тканини та погіршенням виживання хворих на рак.
Ми вдячні за технічну допомогу Джейсона Доннеллі, Жана Мейнгей та Кетрін Сангстер.
СНОПКИ
Фінансову допомогу для цього дослідження отримав Відділ продуктів Росса, лабораторії Abbott; Scotia Pharmaceuticals; та Королівський лазарет Единбурзького національного центру охорони здоров’я.
Адреса для запитів на передрук та іншої кореспонденції: Т. Престон, лабораторія біохімії ізотопів, Науково-реакторний центр шотландських університетів, Іст-Кілбрайд, Великобританія G75 0QF (електронна пошта: Т. [електронна пошта захищена] gla. Ac. Uk).
- Довгострокові наслідки збільшення споживання білка після втрати ваги на вміст внутрішньопечінкових ліпідів та
- Matrix Nutrition Diet Сироватковий протеїновий порошковий коктейль; Замінник прийому їжі для втрати ваги (шоколад,)
- Кеторолак (системний) Меморіальний центр раку Слоун Кеттерінг
- Кеторолак для перорального застосування, побічні ефекти, взаємодія, зображення, попередження; Дозування - WebMD
- Миттєвий горщик з курячого супу з сочевиці - баріатрична їжа