Шлях p53 як ціль у терапії раку: перешкоди та перспективи
Ганна Мандінова
Науково-дослідний центр шкірної біології, Масачусетська лікарня загального користування та Гарвардська медична школа, Чарльзтаун, Массачусетс 02129 США
Інститут Массачусетського технологічного університету та Гарварду, Кембридж, Массачусетс 02139, США
Сем В. Лі
Науково-дослідний центр шкірної біології, Масачусетська лікарня загального користування та Гарвардська медична школа, Чарльзтаун, Массачусетс 02129 США
Інститут Массачусетського технологічного університету та Гарварду, Кембридж, Массачусетс 02139, США, gro.srentrap@eelws
Анотація
Велика частка пухлин людини несе мутацію p53, що дозволяє ініціювати та прогресувати пухлину; крім того, тепер стає ясно, що відновлення або реактивація функції p53 дикого типу спонукає до швидкої елімінації пухлин. Відкриття та розробка сполук, які реактивують або посилюють шлях p53, призвело до ідентифікації перспективних кандидатів на наркотики, які зараз вступили в клінічні випробування протиракових стратегій. Однак деякі з цих засобів, як видається, викликають небажані токсичні ефекти на нормальні клітини та тканини, тому обмежуються в дозі, яку можна застосовувати при пухлинах. У цьому огляді ми обговорюємо проблеми та обіцянки цих активаторів p53 та пропонуємо шляхи розширення та оптимізації скринінгових стратегій для ідентифікації таких молекул.
ВСТУП
Білок-супресор пухлини p53 служить захисником генома і інтенсивно вивчається майже 30 років (1, 2). Він функціонує головним чином як фактор транскрипції шляхом зв’язування з певними послідовностями ДНК і шляхом трансактивації або репресії великої групи генів-мішеней (3–5). Ці цілі р53 регулюють шляхи зупинки клітинного циклу, апоптозу та відновлення ДНК для підтримки динамічної рівноваги між ростом та арештом клітин у відповідь на такі фактори, як пошкодження ДНК, гіпоксія (дефіцит кисню) та дефіцит факторів росту або поживних речовин. (4, 6, 7).
ЯРКА СТОРОНА p53 В ТЕРАПЕВТИКІ РАКУ
Клітини постійно піддаються дії та подразникам, які можуть спричинити генотоксичний стрес, включаючи окислювальний метаболізм та опромінення. Таким чином, здатність виявляти та відновлювати наслідки пошкодження ДНК є критично важливою функцією нормальних клітин. Нездатність ефективно відновити пошкодження ДНК може в кінцевому підсумку призвести до злоякісної трансформації. Індукція зупинки клітинного циклу (тимчасовий або постійний блок проліферації клітин) або активація шляхів загибелі клітин у відповідь на генотоксичний стрес складає основні частини осі виживання та смерті, що регулюється p53. Через ці біологічні властивості інактивація p53 дикого типу є вирішальним етапом у розвитку та прогресуванні пухлини, що відображається високою частотою мутацій TP53 у різних типах раку людини.
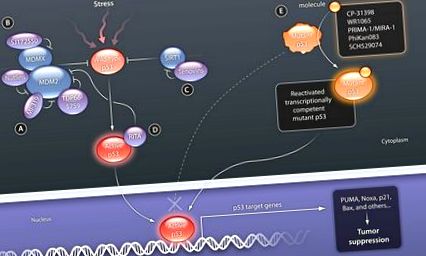
p53 зазвичай експресується на низьких рівнях, так що він не порушує клітинний цикл або не спричинює передчасну смерть клітини. Такі низькі концентрації досягаються завдяки роботі петлі негативного зворотного зв'язку, що складається з p53 дикого типу та гена MDM2 та його продукту. MDM2 - це транскрипційна мішень p53, продукт якої убіквітується p53, таким чином позначаючи її для опосередкованої протеосомами деградації (15–17). Однак p53 стабілізується і накопичується під час таких стресів, як пошкодження ДНК або активація онкогену, що призводить до зупинки клітинного циклу, старіння та/або загибелі клітини через трансактивацію його генів-мішеней, включаючи ті, що кодують p21 (що сприяє зупинці клітинного циклу) та проапоптотичні білки Bax (Bcl-2-асоційований білок), PUMA (регульований p53 модулятор апоптозу) та Noxa (індукований форбол-12-миристат-13-ацетатом білок 1) (4, 6) (рис. 1). Оскільки ідентифіковані цілі нижче за течією відіграють вирішальну роль у відповіді на придушення пухлини p53, ці мішені повинні бути основним напрямком терапевтичного втручання при активації p53 у ракових клітинах.
P53 дикого типу активується різними стресорами, включаючи пошкодження ДНК, експресію онкогену, голодування поживними речовинами, окислювальний стрес та виснаження рифонуклеотидних трифосфатів (використовуються в синтезі РНК). (A) Невеликі молекули, які націлені на MDM2 і блокують зв'язування p53, стабілізують p53. (B) SJ172550 націлений на кишеньку для зв’язування p53 MDMX, також сприяючи стабілізації p53. (C.) Теновін-6 пригнічує активність білка деацетилази SIRT. Ацетилювання призводить до стабілізації р53 та перешкоджає деградації, опосередкованій MDM2. (D) RITA зв'язується з p53 і перешкоджає взаємодії MDM2 та p53, активуючи функцію p53. (Е) Невеликі молекули, призначені для зв'язування транскрипційно інертних мутантних білків p53, стабілізують домен ядра, відновлюють природний стан і врешті-решт забезпечують зв'язування з ДНК.
КРЕДИТ: C. БІКЕЛ/НАУКОВА ПЕРЕКЛАДНА МЕДИЦИНА
Також було продемонстровано, що у значному відсотку пухлин людини р53 інактивується надмірною експресією та/або ампліфікацією MDM2 (18). Крім того, добре встановлено, що MDMX/MDM4 - непотрібний гомолог MDM2 - також регулює р53 і надмірно експресується при багатьох видах раку (15, 19). Однак, на відміну від MDM2, експресія MDMX не регулюється p53, і його продукт не має внутрішньої активності убиквитин-лігази; таким чином, це не є важливою частиною циклу негативного зворотного зв'язку, описаного вище. Однак MDMX утворює гетеродимери з MDM2, що посилює здатність MDM2 індукувати деградацію p53 (16, 17). Переривання взаємодії між p53 та його негативними регуляторами, такими як MDM2, для активації або стабілізації p53 є перспективною терапевтичною стратегією для лікування раку, що зберігає p53 дикого типу.
Пухлини, які несуть мутації в TP53, часто надмірно експресують мутант p53, що призводить до підвищення стійкості до звичайної хіміотерапії та променевої терапії порівняно з клітинами, які не надмірно експресують мутант p53. Цей висновок вказує на те, що такий мутант p53 забезпечує певну селективну перевагу для розвитку пухлини - онкогенний фенотип посилення функції. Пухлинні клітини, що містять мутант p53, повинні стати чутливими до хіміотерапії після відновлення шляху p53 дикого типу (рис. 1). Це робить мутант p53 привабливою мішенню для селективної терапії раку, яка не впливає на нормальні клітини, оскільки нормальні клітини не містять мутанта p53.
ТЕМНА БІКА p53 В ТЕРАПЕВТИКІ РАКУ
p53 в нормальній тканині
Смерть клітин, спричинена пошкодженням ДНК, під дією хіміотерапевтичних препаратів є найбільш широко застосовуваною стратегією терапії раку. Однак селективність залишається великим занепокоєнням, оскільки більшість таких препаратів вбивають як ракові клітини, так і навколишні нормальні клітини, що є важливою причиною побічних ефектів хіміотерапії раку, що суттєво обмежує поточні режими лікування. Хоча ключовим фактором успішної протиракової терапії є націлення на критичні вузли, необхідні для виживання ракових клітин, такі терапії не повинні шкодити нормальним клітинам.
Ідея відновлення дикого типу p53-шляхів (апоптоз та зупинка клітинного циклу) шляхом інгібування протеосомної деградації p53 (наприклад, за допомогою інгібування MDM2) є перспективною терапевтичною стратегією (20). На сьогоднішній день ідентифікація малих молекул, які або (i) інгібують активність лігази E3 MDM2, або (ii) можуть займати гідрофобну р53-зв'язуючу кишеню/щілину в MDM2 є цілком здійсненною (20, 21). Всі ці інгібітори MDM2 спричиняють регресію пухлини через загибель клітин на моделях ксенотрансплантата, хоча незрозуміло, як такі молекули впливатимуть на здорові клітини та тканини людини.
p53 як охоронець ракових клітин
РОЗРОБКА АКТИВАТОРІВ p53 ЯК ТЕРАПЕВТИЧНИХ ЛІК
Виклики попереду
Недавні генетичні дослідження на моделях мишей [за участю трьох типів пухлини (лімфома, саркома та гепатоцелюлярна карцинома)] показали, що реактивація шляху p53 у пухлинах з пригніченою активністю p53 є надзвичайно ефективним втручанням (30–32). Такий процес реактивації представляється можливим, оскільки білок р53 зазвичай сильно експресується в пухлинах, хоча він може бути функціонально інертним. Однак, з точки зору звичайної розвідки ліків, p53 є складною мішенню: він не забезпечує доступності взаємодії рецептор-ліганд або ферментно-активного центру. Натомість це гомотетрамерний фактор транскрипції зі складними білково-білковими взаємодіями, що робить його “неблагополучною” мішенню. Тому дослідники повинні подолати цю проблему, а також визначити засоби для належного маніпулювання ціллю в її середовищі для досягнення бажаної терапевтичної ефективності з мінімальною токсичністю. Тим не менш, нещодавні досягнення у відкритті ліків та прогрес у розробці технологій доповнюють останні 30 років досліджень на основі p53 і створюють реалістичні очікування щодо того, що відновлювальні методи лікування p53 наближаються до рівня, на якому вони можуть бути використані для клінічного застосування.
Орієнтація на шлях дикого типу p53
Було застосовано декілька підходів до відновлення функції p53 дикого типу. Спочатку використовували пухлинну терапію, засновану на екзогенній експресії p53 дикого типу за допомогою генної терапії. Генна терапія на основі аденовірусу, що включає введення функціональної копії ТР53 в пухлини шляхом місцевої ін’єкції в місці пухлини, вбиває високий відсоток ракових клітин, але також призводить до високої токсичності, частково через сильні ефекти сторонніх спостерігачів (таких, що сусідні клітини вбито через сигнали, що надходять з клітин пухлини) (33). Крім того, очевидними проблемами такого підходу є неможливість заразити вірусом кожну клітину пухлини, а також відсутність стабільності нещодавно синтезованого функціонального білка p53.
Зовсім недавно було інтенсивно досліджено використання малих молекул для ендогенної активації р53 у пухлинах, що зберігають ген р53 дикого типу (рис. 1). Більшість цих зусиль були засновані на припущенні, що незначні зміни рівня білка р53 можуть впливати на поріг толерантності пухлинних клітин до апоптотичних сигналів. Отже, сполуки, що модулюють стабільність дикого типу р53 шляхом інгібування його негативних регуляторів, можуть ефективно викликати загибель ракових клітин. Найвідоміший природний інгібітор p53 - це його власний цільовий MDM2 (17, 34, 35). За останні роки було розроблено кілька стратегій терапії пухлин для підвищення активності p53 шляхом нейтралізації функції MDM2 на різних рівнях. Васильєв та його колеги (20) визначили групу малих молекул, спрямованих на взаємодію MDM2-p53. Ці похідні імідазоліну, позначені нутлінами, специфічно зв'язують і дисоціюють MDM2 від p53, тим самим рятуючи p53 від деградації та індукуючи клітинний цикл та апоптоз (20). Експерименти in vivo також показали значний протипухлинний ефект нутлінів (36).
Бензодіазепени та сполуки на основі спірооксидолу є ще одним класом малих молекул, які, як було встановлено, націлені на взаємодію p53-MDM2 (37, 38). Ці експерименти призвели до доклінічного розвитку TDP665759 та MI-319, які порушують зв'язування MDM2 з p53 in vitro та пригнічують ріст пухлинних клітин як in vitro, так і in vivo. Обидва сполуки обмежують ріст пухлини, не викликаючи великої токсичності в навколишній тканині, хоча вони індукують низький рівень р53, підвищуючи його стабільність у нормальних клітинах, що, здається, недостатньо для активації апоптотичного каскаду (39).
Враховуючи швидкість нинішніх зусиль з розкриття лікарських засобів, розробка оптимізованих аналогів, спрямованих на взаємодію p53-MDM2, швидше за все, відбудеться найближчим часом. Однак ця стратегія також пов'язана з кількома потенційними проблемами. Оскільки MDM2 є класичним геном-мішенню p53 і є частиною індуцибельної петлі зворотного зв'язку, яка інгібує шлях p53, сполуки, що націлюються на MDM2, врешті-решт спричинять індукцію власної мішені (тобто MDM2) і, таким чином, обмежують власну ефективність. Крім того, використання спрямованих сполук MDM2 може бути проблематичним при пухлинах, що експресують високий рівень мутанта p53. Враховуючи проонкогенний вплив декількох мутацій молекули р53, звільнення цих мутантів від наслідків деградації, опосередкованої MDM2, може насправді сприяти подальшому пухлинному розвитку (40).
Одним з ключових регуляторів шляху p53 є інший представник сімейства білків MDM2, MDMX. Хоча MDM2 та MDMX поділяють гомологію у своєму домені зв'язування p53, нутлиноподібні сполуки не можуть ефективно впливати на MDMX, який утворює гетеродимер з MDM2 і тим самим стимулює деградацію p53. Тому з'являється загальний консенсус щодо того, що ефективної індукції дикого типу p53 у пухлинах можна успішно досягти одночасним інгібуванням MDM2 та MDMX. Нещодавно була опублікована ідентифікація першого інгібітора MDMX, SJ172550 (41), і хоча його молекулярний механізм дії ще не повністю зрозумілий, початкові дані свідчать про помірний успіх у поєднанні з інгібіторами MDM2 у моделях мишачого раку.
SIRT1 і 2 є двома членами нікотинамід-аденин-динуклеотид-залежного гістону деацетилаз класу III (42). Добре встановлено, що ацетилювання p53 при Lys 382 посилює зв'язування p53 з ДНК. Отже, деацетилювання SIRT1 Lys 382 у білку p53 негативно впливає на активність p53, встановлюючи SIRT1 як ще одну можливу мішень для модуляції шляху p53 (43). Справді, фенотиповий скринінг на основі p53 визначив клас малих молекул, що називаються теновінами, які є потужними інгібіторами SIRT1 та 2, як показано пізніше за допомогою генетичного скринінгу дріжджів та подальших ферментативних аналізів (44). Теновіни швидко збільшували накопичення ацетильованого p53 як in vitro, так і in vivo, і представляють раніше невідомий клас p53-активуючих агентів, який може бути надалі розроблений для клінічного використання.
В іншій спробі активувати шлях p53 через стабілізацію білка p53 дикого типу була виявлена невелика молекула, звана RITA (реактивація p53 та індукція апоптозу клітин пухлини), яка безпосередньо зв'язує p53 на кінці N і запобігає деградація (45). Чи є це єдиним механізмом, за допомогою якого RITA підвищує активність p53 у клітинах, досі залишається суперечливим, оскільки є дані, що RITA може зв'язуватися з множинними білками та активувати шлях відповіді на пошкодження ДНК незалежно від p53 (46).
КРЕДИТ: C. БІКЕЛ/НАУКОВА ПЕРЕКЛАДНА МЕДИЦИНА
Націлювання на мутанта p53: реактивація дрібними молекулами
Ранній прогрес продемонстрував доцільність цього підходу: антитіла, які пов'язують кінець p53 C (pAb421) та синтетичний пептид (p53C), отриманий з C-кінцевого домену, показали стимулюючий ефект на зв'язування ДНК декількох білків з мутаціями в центральній частині ДНК-зв'язуючий домен (за залишками His 175, Ala 143 та Ser 249), а також індукція апоптозу в ракових клітинах, що експресують такі контактні мутанти (50). Однак проблеми, пов'язані зі стабільністю пептидів або білків та транспортуванням у ракові клітини, перешкоджають клінічному випробуванню цього підходу. Отже, протягом останніх років було проведено кілька спроб скринінгу мутантних сполук, що реактивують р53, з використанням або аналізів зв’язування з білками, або аналізів на основі клітин із залученням мутантних клітин пухлини, що містять р53 (рис. 2). Нові сполуки, націлені на мутанта p53, були ідентифіковані за допомогою обох типів скринінгових аналізів (рис. 1). CP-31398, виявлений Pfizer за допомогою аналізу стабілізації p53 in vitro, показав багатообіцяючі початкові доклінічні результати у мутантних та нульових клітинах p53 (51). Проте подальший аналіз показав, що механізм дії цієї сполуки не заснований на прямому зв'язуванні з p53, а натомість опосередкований взаємодією з ДНК (52).
Ще одна ідентифікована сполука, WR1065, є активним метаболітом аміфостину (лікарського засобу, який контролює деякі побічні ефекти променевої терапії та хіміотерапії та повідомляється про повне або часткове відновлення транскрипційної активності білків-мутантів р53 за поки невідомим механізмом (53 Подібним чином, скринінговий тест на основі клітин, що включає клітинну лінію Saos-2 (отриману з остеосаркоми людини, розробленої для експресії arg273, його мутанта p53), дав PRIMA-1 та MIRA-1 (більш потужний аналог другого покоління), дві невеликі молекули, здатні до селективної індукції апоптозу в клітинах, що експресують мутантний р53. Показано, що ці сполуки індукують експресію генів-мішеней р53, таких як кодуючі p21, MDM2 та/або PUMA, та інгібують ріст пухлини in vivo у мишей (54). Широка характеристика цих сполук показала, що вони утворюють аддукти з тіолами в мутантному доменному ядрі p53 (55). Як ця ковалентна модифікація зумовлює рівновагу між мутантним та конфліктом дикого типу однак, відкриті питання, на які потрібна чітка відповідь, перш ніж стане можливим повний клінічний розвиток.
Інший підхід використовував структурні дані та використовував обчислювальні методи. У цьому випадку було визначено кристалічну структуру версії білка p53, що містила мутацію Tyr 220 → Cys 220, і виявлено, що вона включає кишеньку для зв’язування. Ця знахідка дозволила здійснити скринінг взаємодіючих молекул in silico та призвела до ідентифікації невеликої молекули, PhiKan083, яка поміщається в кишеню та стабілізує домен мутантного ядра у дикій конформації (56).
Зовсім недавно за допомогою аналізу зв'язування ДНК р53 було виявлено малу молекулу SCH529074, яка сприяє активності зв'язування ДНК мутанта р53 у безклітинних системах, індукує апоптоз у клітинах пухлини та зменшує ріст пухлини в моделі ксенотрансплантата (57). Дуже ранні доклінічні дані щодо цієї сполуки обнадіюють і відкривають шлях для фармакологічної оптимізації цієї сполуки.
Подяка
Ми дякуємо Кікі Чу, Сіньбінь Чень та колегам з CBRC за критичне прочитання рукопису та їх корисну дискусію.
- Зондове годування за допомогою болюсного методу Меморіальний центр раку Слоун Кеттерінг
- Чому деякі інфекції ВПЛ зникають, а інші перетворюються на рак - ScienceDaily
- Що надмірна вага означає для вашого ризику раку - ресурси для схуднення
- Залишатися здоровими під час лікування раку CDC
- Пряма розмова про рак; Харчування з Ендрю Абрахамом, доктором медицини