Розриви при серцево-судинних захворюваннях
З кафедри медичної фізіології Університетського медичного центру Утрехта, Утрехт, Нідерланди.
З кафедри медичної фізіології Університетського медичного центру Утрехта, Утрехт, Нідерланди.
Анотація
Анотація—Коннексини, молекули білка, що утворюють канали щілинного з’єднання, зменшуються чи перерозподіляються від інтеркальованих дисків до бічних меж клітин при різних серцевих захворюваннях. Це “реконструкція щілинних з’єднань” вважається аритмогенною. Використовуючи просту модель міокарда шлуночків людини, ми виявили, що дані кількісного ремоделювання, отримані з літератури, спричинили лише незначні та помірні зміни швидкості провідності та відношення анізотропії. Особливо для поздовжньої провідності цитоплазматичний опір (і, отже, клітинна геометрія) є набагато важливішим, ніж загальновизнаний. Жоден з даних ремоделювання не призвів до повільної провідності порядку декількох сантиметрів на секунду.
Проміжки, спеціалізовані мембранні структури, що складаються з масивів міжклітинних каналів, з'єднують сусідні клітини в багатьох тканинах і органах, забезпечуючи тим самим хімічний та електричний зв'язок. У серці розривні переходи забезпечують шляхи для протікання міжклітинного струму, забезпечуючи розповсюдження потенціалу скоординованої дії. Нещодавно було опубліковано численні звіти, які свідчать про те, що зміни розподілу щілинних з’єднань, щільності та властивостей можуть бути пов’язані з ініціацією та збереженням різних серцевих аритмій. У цьому огляді ми узагальнюємо дані, представлені в цих звітах, та обговорюємо функціональні наслідки.
Будова та властивості розривних каналів
Протягом останнього десятиліття структура та властивості каналів зазору були широко задокументовані, як це обговорювалось у кількох останніх оглядах. 1 2 3 4
Канали розриву ссавців побудовані з коннексинів, кодованих сімейством близькоспоріднених генів. Всі коннексини складаються з 4 висококонсервативних сегментів, що охоплюють α-спіральну мембрану, розділених 2 позаклітинними та 1 внутрішньоклітинною петлею. Аміно- і карбоксильні кінці розташовані всередині клітини. Визначено п'ятнадцять представників сімейства коннексинів ссавців. Вони відрізняються головним чином послідовністю їх внутрішньоклітинних петель і карбоксильних кінцевих елементів. Між кардіоміоцитами на рівні білка виявлено 3 коннексини: коннексин40 (Сх40), коннексин43 (Сх43) та коннексин45 (Сх45) (названі за їх передбачуваною молекулярною масою в кілодальтонах).
Один розривний канал з'єднання утворений прямим стикуванням 2 геміканалів (коннексонів), кожен з яких складається з 6 молекул коннексину, розташованих гексагонально навколо водної пори. Оскільки стикування опосередковується відносно збереженими позаклітинними петлями, багато коннексони, що складаються з одного виду коннексину, можуть поєднуватися з коннексонами, виготовленими з інших коннексинів, утворюючи гетеротипові канали розриву. Коннексон може також складатися з різних коннексинів 5 (гетеромерний коннексон). У серці різні коннексини колокалізуються в бляшках щілинного з'єднання, але невідомо, чи існують гетеротипові та/або гетеромерні канали щілинного з'єднання в серцево-судинній системі.
Канали розриву пропускають речовини з молекулярною масою +] i 6 та [Ca 2+] i за станом фосфорилювання коннексинів та за складом позаклітинних жирних кислот.
Експресія коннексину також модулюється. Гормони можуть регулювати або знижувати вміст коннексину. У клітинах серця новонароджених щурів in vitro cAMP може суттєво підвищити експресію Cx43 із супутнім збільшенням швидкості провідності потенціалу дії. Оборот коннексинів надзвичайно швидкий. Наприклад, у серці дорослого щура період напіввиведення становить 1,3 години. 7
Розподіл проміжків у нормальному міокарді
У міокарді коннексини регіонально виражені: Cx43 виявляється у всьому серці, за винятком можливих вузлових тканин та частин провідної системи. 4 У видів ссавців Cx40 експресується в тканинах передсердь (за винятком серця щурів) та в проксимальній провідної системі (за винятком серця морської свинки). 8 9 Експресія Cx45, схоже, обмежена вузловими тканинами та провідниковою системою, 10 11 але деякі повідомлення 12 13 стверджують, що поширення набагато ширше, ймовірно, через використання не зовсім специфічного антитіла проти Cx45. 14 На сьогодні жодного іншого коннексину між кардіоміоцитами не виявлено.
Міоцити шлуночків пов’язані ідентифікаторами з ≈10 сусідніми клітинами. 22 26 Швидкість провідності визначається площею бляшки стику зазору в кожному з цих ІД. Загальна площа бляшечного з’єднання зазору на ID становить від 47 до 94 мкм 2 у щурів, 27 42 або 13,6 мкм 2 у собак, 22 23 та ≈10 мкм 2 у людей. 26
В передсерді бляшки щілинного з'єднання містять як Cx43, так і Cx40. 9 13 Найчастіше Cx43 і Cx40 локалізуються в одних і тих же бляшках без переважного розташування ні коннексину в бічних кордонах клітин, ні бляшок ID. 9 Немає даних для розрахунку площі бляшок на щілинному спаї на кожну ID в атріумі.
У міокарді шлуночків експресія Cx40 обмежена провідною системою. 8 У більшості видів ссавців у проксимальній частині (пучок Гіса, пучки гілок) немає Cx43, тоді як у більш дистальних районах гілок пучка та волокон Пуркіньє Cx40 та Cx43 співіснують. 28 в Ксенопус ооцити, Cx43 і Cx40 не можуть утворювати функціональні гетеротипові канали розриву, 29 і було висловлено припущення, що розподіл коннексину в проксимальній провідній системі буде служити для швидкого розповсюдження потенціалу дії до дистальних частин без втрати струму через щілинні переходи до навколишніх міоцитів перегородки. Однак у клітинах ссавців несумісність Cx40 і Cx43 коннексонів здається менш чіткою. 30 У серцях мишей Cx45 експресується у всьому атріовентрикулярному вузлі, пучку Гіса та гілках пучка. 10 Вираз Cx40 обмежений серцевиною пучка Гіса та гілок пучка. 10
Розподіл щілинних з’єднань у хворому міокарді
Практично у всіх серцевих захворюваннях, схильних до аритмій, повідомлялося про зміни в розподілі та кількості щілинних з’єднань (реконструкція щілинних з’єднань). При запущеній ішемічній хворобі виявлено вузьку зону, що складається з ≈5 шарів клітин, що межують із загоєними інфарктами міокарда. 24 У цій зоні нормальний розподіл щілинних з’єднань у наскрізних ідентифікованих ідентифікаторах був порушений із зміщенням плям, що містять Cx43, до бічних меж клітини без зміни розміру плями. Звичайні, ішемізовані та гіпертрофовані ліві шлуночки людини показали однакові за розміром бляшки забарвлення проти Cx43, але загальна кількість Cx43 зменшилася на 40% у хворих серцях. 26 Кількість ідентифікаторів на клітину не відрізнялася у нормальних та хворих серцях, що означає, що клітинна геометрія кардинально не змінилася. З іншого боку, при оборотно ішемізованому та сплячому шлуночку людини у постраждалих регіонах спостерігалося зменшення розміру бляшок Cx43 на 23% та 33% відповідно, без змін у нормальному міокарді. У цих експериментах спостерігався зсув плям Cx43 від наскрізного розташування до бічного; про цей зсув також повідомляли при гіпертрофічній кардіоміопатії. 25
Здається, латералізація щілинних з’єднань є важливою особливістю хворого міокарда. Однак не зовсім зрозуміло, якою мірою це латералізація може сприяти зміненню провідних властивостей, оскільки нещодавно було показано 34, що в клітинах шлуночків щурів, що межують із загоєними інфарктами, багато бляшок, що поєднують латеральні щілини, знаходяться в інвагінаціях сарколем всередині клітини, тим самим не сприяючи комунікації між клітинами. Подібне спостереження було проведено при гіпертрофії правого шлуночка. 32
Незважаючи на те, що кількісних даних недостатньо, ще однією поширеною знахідкою у хворому міокарді є зменшення площі перетину щілин на 30% на 40%. У (пості) ішемічних шлуночках це зменшення обмежується кількома шарами клітин навколо ураженої ділянки, тоді як у гіпертрофічних шлуночках це зменшення є більш поширеним. На основі цього спостереження окремо або разом із збільшеною щільністю бляшок з перетином бічних щілин можна передбачити знижений коефіцієнт анізотропії. В одному дослідженні 23 було запропоновано підвищений коефіцієнт анізотропії в прикордонних зонах інфаркту. Це збільшення частково відбулося за рахунок зменшення бічної (інтерплікованої) щільності щільного з’єднання, а частково - зменшення кількості клітин, що мають бокові зв’язки із сусідніми клітинами.
Зміни щільності та розподілу щілинних з’єднань у ураженій тканині передсердь менш добре задокументовані. У швидко розвиваються передсердях собак було зареєстровано збільшення Cx43-позитивних плям, особливо на бічних кордонах клітин. В атріумі кози не було виявлено явних змін щільності та розподілу Cx43 через 16 тижнів стійкої фібриляції передсердь (AF), 36 37 хоча дефосфорилювання мало місце. Білок Cx40 відсутній в ділянках тканин передсердь від 0,15 до 0,6 мм після 16 тижнів ФП без зменшення мРНК Cx40. Нерівне зниження білка Cx40 було очевидним через 2 тижні ФП, приблизно в той самий час, коли ФП став стійким. Чи це зниження Cx40 причинно пов’язане із збереженням ФП, ще потрібно визначити.
Дані про участь ремоделювання щілинного з’єднання в аритміях, що виникають в провідниковій системі або в вузловій тканині, лише починають повідомлятися. 38 39 40
Розриви та швидкість проведення
Ефективний gj
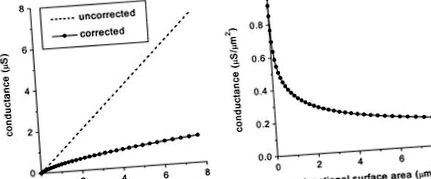
Ми провели кілька простих комп'ютерних моделювань, щоб перевірити вплив змін щільності та розподілу щілинних переходів на швидкість провідності потенціалу дії. Спочатку ми визначили ефективну розривну провідність проміжку (gj, скориговану на ефекти електричного поля, спричинені опором доступу цитоплазми), використовуючи нашу раніше опубліковану модель 18 і припустивши, що одноканальна провідність Cx43 дорівнює 75 пС при 37 ° C 41 і всі канали повинні бути у своєму провідницькому стані (але див. посилання 42). Малюнок 1А показує, що ефекти резистентності до доступу цитоплазми вже очевидні для відносно невеликих щілинних з’єднань і стають більш помітними із збільшенням розміру щілинних з’єднань. Для щілинних з’єднань> 0,5 мкм 2 ефективна провідність становить 4 мкм 2, ефективна провідність рівна 2 для малих та середніх розмірів зазорів (0,3-1,5 мкм 2) та 2 для великих зазорів (> 5 мкм 2). Як обговорювалося вище, площа поверхні стику зазору зазвичай коливається від 10 до 40 мкм 2 на ID. Якщо використовується середня ефективна провідність 0,3 мкСм/мкм 2, ефективний gj на ID між сусідніми клітинами становить 3-12 мкС.
Швидкість проведення
Далі ми оцінили важливість gj для швидкості провідності. Ми стимулювали крайню ліву клітинку в лінійній нитці з 50 клітин з частотою 1 Гц і обчислили швидкість провідності по середній третині нитки. Клітини розташовувались або впритул, або поруч, а сусідні клітини з'єднували через постійний (ефективний) gj (малюнок 2А). Ми використовували модель шлуночкової клітини людини Прібе та Бейкельмана 43 в чисельному представленні рівняння кабелю, подібного до дослідженого Шоу та Руді, 44, зі значенням 150 Ом см для питомого опору цитоплазми. 45
Функціональні наслідки
Результати моделювання становлять важливі застереження щодо інтерпретації кількісних даних (імуно) гістохімічних або (електронних) мікроскопічних досліджень. Зменшення загального вмісту щілинного з’єднання на цілих 40% без зміни розміру бляшок щілинного з’єднання, як це спостерігається у хворих серцях людини, 26 може саме по собі мати лише помірний вплив на швидкість провідності. Якщо нормальний gj між клітинами становить 5 мкСм, зменшення на 40% до 3 мкС призводить до зменшення ΘL на 11% з 65 до 58 см/с і зменшення ΘT на 27% з 24 до 18 см/с (рис. 2В). Пов’язаний коефіцієнт анізотропії збільшується на 22% з 2,7 до 3,3. В інших випадках загальний вміст розривної зони залишався незмінним, але відбувся зсув до бічних меж комірок. 25 32 Зсув на 40% призведе до зменшення 11L на 11% і збільшення ΘT на 25%, що призведе до зниження коефіцієнта анізотропії на 29%. Якщо нові бокові щілинні переходи розташовані всередині клітини, 32 34 ΘT може взагалі не змінитися.
Заключні зауваження
У багатьох дослідженнях, що стосуються ремоделювання щілинних з’єднань у хворій шлуночковій тканині, автори дійшли висновку, що зменшення швидкості провідності може посилити схильність до повторних аритмій. Однак даний аналіз обмежених наявних даних вказує на те, що зменшення швидкості провідності або зміни коефіцієнта анізотропії насправді можуть бути помірними. Звичайно, спостережувані зміни не приведуть субстрат до сфери повільної провідності, як було розглянуто в кількох останніх експериментальних 48 49 50 та теоретичних 44 51 дослідженнях. Наш аналіз показує, що цитоплазматичний опір і клітинна геометрія набагато важливіші, ніж загальнозрозумілі, висновок, який також відстоюють Спач та його колеги. 15 47 52 53
Ми не враховували в своєму аналізі викликані хворобою зміни властивостей іонних мембранних та щілинних каналів з’єднання. Безперечно, такі патофізіологічні зміни ще більше ускладнюють розуміння аритмогенезу при гострій ішемії, хронічному інфаркті міокарда, гіпертрофії та серцевій недостатності.
Фігура 1. Вплив опору цитоплазматичного доступу на gj. A, Ефективний gj (з поправкою на опір цитоплазматичного доступу) в порівнянні з площею поверхні розриву зазору, на відміну від некорегованого значення, отриманого множенням одноканальної провідності на кількість розривних каналів. B, Дані з панелі A відображаються як провідність на одиницю площі поверхні.
Малюнок 2. Комп’ютерне моделювання поширення потенціалу дії в лінійних нитках шлуночкових клітин людини з ефективним gj між клітинами. А, Схема поздовжніх і поперечних тяжів. B, Подовжня та поперечна швидкість провідності проти gj. C, Gap-перехідний та цитоплазматичний опір порівняно з gj. Зверніть увагу на логарифмічну шкалу ординат.
Цей огляд був частково підтриманий Дослідницькою радою з наук про Землю та життя (ALW) за фінансової допомоги Нідерландської організації з наукових досліджень (NWO).
- Причини, симптоми та лікування респіраторної хвороби щурів
- Гранулін у фронтотемпоральній крупозній дегенерації Молекулярні механізми захворювання
- Есцин; циркуляція ескуліну, набряки, затримка води та целюліт - LipoTherapeia, Лондон
- П'ятирічна ефективність баріатричної хірургії щодо ремісії захворювання, втрати ваги та змін
- CDC - лейшманіоз - хвороба