Розміщення епідурального катетера у породіль із патологічним ожирінням із використанням рівняння глибини епідуральної тканини до візуалізації УЗД
Сухдіп Сінгх
1 лікарня Magee-Womens, Пітсбург, Пенсільванія, 15213, США
Кіт М. Вірт
1 лікарня Magee-Womens, Пітсбург, Пенсільванія, 15213, США
Емі Л. Фелпс
2 Кафедра анестезіології Пітсбурзького університету та Школи бізнесу Університету Дукесна, Пітсбург, Пенсільванія 15282, США
Манасі Х. Бадве
1 лікарня Magee-Womens, Пітсбург, штат Пенсільванія, 15213, США
Танмей Х. Шах
1 лікарня Magee-Womens, Пітсбург, Пенсільванія, 15213, США
Ніра Сах
3 Лікарня Св. Маргарет, Пітсбург, Пенсильванія, 15203, США
Мануель К. Вальєхо
1 лікарня Magee-Womens, Пітсбург, Пенсільванія, 15213, США
4 відділення анестезіології, лікарня Магі-Жінки UPMC, 300 Halket Street, Pittsburgh, PA 15213, USA
Анотація
1. Вступ
За останні 20 років поширеність ожиріння зросла до масштабів епідемії, за оцінками, щонайменше 1,6 мільярда людей із зайвою вагою та 400 мільйонів дорослих з ожирінням у всьому світі [1]. Багато породіл отримують значну кількість ваги під час вагітності, а отже, багато пацієнток задовольняють вимогу ожиріння з ІМТ> 30 кг/м 2, що робить відповідне лікування важливим питанням для акушерських лікарів у всьому світі [2].
Хоча регіональна анестезія може запропонувати ці переваги перед загальною анестезією, збільшена кількість підшкірного та епідурального жиру в популяції ожиріння може становити значну проблему для успішного встановлення епідурального катетера. До візуалізації в США пальпація кісткових орієнтирів була єдиною доступною методикою ідентифікації поперекових проміжків. Stiffler та співавт. [11] повідомили про труднощі при пальпації орієнтирів у 5% пацієнтів з нормальним ІМТ, 33% у осіб із надмірною вагою та у 68% пацієнтів із ожирінням. Остисті відростки деяких пацієнтів із ожирінням можуть розташовуватися на відстані більше 5 см від шкіри, зв’язка флавону глибиною до 8 см, а на крайньому рівні глибиною 11-12 см [12]. Грау та ін. [13] визначив, що з часом оптимальна площа проколу на шкірі для епідуральної канюляції є меншою, канал м’яких тканин між спинномозковими відростками вужчий, а епідуральний простір також вужчим. Кожна з цих змін, швидше за все, буде перебільшена у тих пацієнтів, які страждають ожирінням. Інші причини включають труднощі в позиціонуванні пацієнта та підвищену ймовірність помилкової позитивності до техніки втрати опору при локалізації епідурального простору [13, 14].
Використання ультрасонографії (УЗД) для розміщення епідуральних катетерів набуває все більшої популярності і, як було показано, зменшує рівень відмови епідурального катетера та спроби розміщення [15, 16]. УЗД можна використовувати для ідентифікації епідурального простору, локалізації середньої лінії, оцінки глибини від шкіри до епідурального простору та оцінки точки введення та кута введення голки [16–19]. Показано, що візуалізація препунктурного епідурального простору зменшує кількість спроб епідурального розміщення та зменшує частоту випадкових дуральних пункцій, особливо серед нових резидентів, які навчаються [12, 15, 16]. Наявність збільшеної жирової тканини робить візуалізацію епідурального простору в США більш складною, і суттєвою проблемою при використанні УЗ у породжених ожирінням є те, що зменшена візуалізація епідурального простору робить оцінку відстані від шкіри до епідурального простору менш передбачуваною [12 ].
У попередньому дослідженні ми досліджували використання УЗД для розміщення епідурального катетера у породіллі, виявили високу кореляцію між оціненою глибиною УЗД та фактичною глибиною голки (НД); (Коефіцієнт кореляції Пірсона ≥0,91) [16] та отримав рівняння епідуральної глибини (ЕДЕ) з використанням поступової багатовимірної лінійної регресії для прогнозування відстані від шкіри до епідурального простору в нижній поперековій міжхребцевій області.
У дослідженні Balki et al. [20] щодо породіль із патологією ожиріння, які використовували УЗ, вони виявили коефіцієнт кореляції Пірсона 0,85 між оціненою відстань США до епідурального простору та фактичною глибиною голки (ND). Мета цього дослідження - визначити, чи може ЕДЕ для оцінки глибини епідурального простору до візуалізації в США покращити візуалізацію та призвести до кращої клінічної кореляції у породіль із ожирінням.
2. Методи
З дозволу місцевої слідчої комісії та поінформованої усної та письмової згоди до дослідження були залучені хворі на ожиріння породіллі (ІМТ ≥ 40 кг/м 2), які вимагали проведення епідуральної аналгетики або запланованого кесаревого розтину. Критеріями виключення були пацієнти з тяжкою гестозом, хірургічною операцією на спині в анамнезі, значним сколіозом, ІМТ ≤ 40 кг/м 2 та/або патологією поперекового відділу.
2.1. Визначення рівняння епідуральної глибини та ультразвукове сканування
До сканування в США та введення епідурального катетера спочатку розраховували глибину епідуральної глибини, використовуючи описане рівняння глибини епідуральної залози (EDE), отримане в результаті попереднього дослідження США в нашому закладі [16]:
Потім при пальпації гребеня клубової кістки визначали міжхребцевий простір L3-4 або L4-5, а на лінії Туф’є ідентифікували міжхребцевий простір хребців і позначали незмивним маркером. Ця відмітка була використана для візуалізації як поздовжньої серединної, так і поперечної площин УЗД, підтвердження середньої лінії та визначення кінцевої точки вставки в міжхребцевому просторі, що дало найкращий вид на зв’язку. Попередньо знаючи про розраховану глибину епідуралі, у породіллі була проведена візуалізація за допомогою УЗД у поздовжній серединній та поперечній площинах з оцінкою відстані від шкіри до фламанту зв’язок (задня тверда мозкова оболонка) перед введенням епідурального катетера (рисунки (рисунки 1 1 та 2) ) 2) первинним слідчим (МВ). Для сканування в США використовували систему SonoSite S-Nerve US (SonoSite, Bothell, WA, USA) з криволінійним зондом масиву 2–5 МГц. Спеціаліст-резидент, який був під наглядом первинного дослідника (МВ), розмістив епідуральний катетер, знаючи розраховану глибину епідуральної зони, подовжню середню епідуральну глибину США та поперечну епідуральну глибину США. Після розміщення епідурального катетера в епідуральному просторі реєстрували фактичну глибину клінічної голки до епідурального простору (ND).
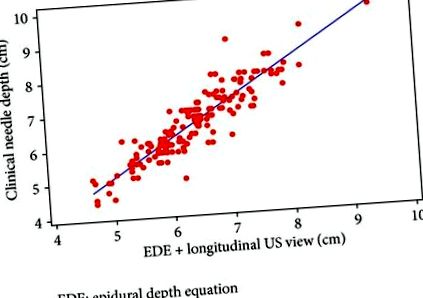
Рівняння епідуральної глибини плюс поздовжній огляд у порівнянні з глибиною клінічної голки.
Рівняння епідуральної глибини плюс поперечний огляд у порівнянні з клінічною глибиною голки.
2.2. Епідуральна техніка
Протокол дослідження дотримувався стандартної методики трудової епідуральної роботи в нашому закладі, винятком було лише використання ЕДЕ для початкової оцінки глибини голки, а також виглядів США (поперечний та поздовжній) для вимірювання глибини до епідурального простору, визначення середньої лінії, введення точку та напрямок голки перед введенням епідурального катетера. Сидяче положення зберігалося впродовж візуалізації в США та встановлення епідурального катетера.
За допомогою стерильної техніки епідуральний катетер розміщували за допомогою підходу по середній лінії через голку 17-го калібру Tuohy у міжхребцевому просторі L3-4 або L4-5, використовуючи втрату стійкості до фізіологічного розчину. Епідуральний катетер (Arrow FlexTip Plus, Arrow International, Reading, PA, USA) був введений на 5 см у епідуральний простір, а потім закріплений клейкою пов’язкою та скотчем. Всім пацієнтам вводили початковий болюс 10 мл 0,0825% бупівакаїну та фентанілу 100 мкг та ставили на інфузію епідуральної аналгезії (PCEA), контрольовану пацієнтом. Параметри PCEA включали безперервну епідуральну інфузію 8 мл/год, болюсну дозу PCEA 8 мл, блокування болюсної дози PCEA кожні 8 хвилин та загальну локальну локалізацію PCEA 24 мл. Пацієнтам, які перенесли планове кесарів розтин, спинномозкову голку ввели через епідуральну голку і дозували 12 мг 0,75% гіпербаричного бупівакаїну з 0,2 мг вільного морфіну в консерванті та 20 мкг фентанілу.
Спроба епідуральної вставки визначалася як просування голки з метою проникнення в епідуральний простір; голка, що вимагає відведення для перенаправлення або повторного введення, зараховувалася як додаткова спроба. Епідуральна недостатність визначалася як епідуральний катетер, що вимагає заміни під час пологів. Ранні та пізні збої визначали відповідно до того, чи потрібно було замінювати катетер протягом або після перших 90 хв після введення відповідно. Лікуючий персонал-анестезіолог, який був засліплений, чи були отримані думки EDE + США, прийняв рішення щодо заміни епідурального катетера. Оцінка візуальної аналогової шкали (VAS) (0 = відсутність болю, 10 = найсильніший біль) була використана для оцінки болю до та після епідуральної активації та при оцінці пацієнтів на наявність неадекватного знеболення. Невдала епідуральна процедура була визначена як блок, що забезпечує неадекватну аналгезію (VAS ≥ 4/10), незважаючи на наступні послідовні етапи: (1) 10 мл болюсу епідуральної інфузійної суміші та повторна оцінка через 15 хв; (2) другий 10 мл болюсу епідуральної інфузійної суміші та повторна оцінка через 15 хв; та (3) 5 мл 1,5% болюсу лідокаїну.
Виміряні змінні включали демографічні та акушерські дані (вік, зріст та вага), кількість вагітностей, співвідношення, розширення шийки матки, невдала епідуральна швидкість, спроби епідуральної вставки (перенаправлення), спроби епідуральної установки (повторні вставки), втручання персоналу (необхідність відвідування допомога анестезіолога під час спроби влаштування), кількість додаткових епідуральних доплав (болюсів), швидкість випадкової дуральної пункції (АДФ) та результат пологів матері (вагінальні пологи, кесарів розтин та кесарів розтин за вибором). Розрахована глибина епідуральної тканини від EDE, середня поздовжня епідуральна глибина США (ligamentum flavum/задня тверда мозкова оболонка), поперечна епідуральна глибина США (ligamentum flavum/задня тверда мозкова оболонка) та фактична глибина клінічної голки (ND) до епідурального простору, виміряна за допомогою стерильного лінійки з точністю до 0,1 см, також були записані.
2.3. Статистичний аналіз
Балки та ін. [20] виявив, що коефіцієнт кореляції Пірсона між глибиною UD та ND становив 0,85; 95% ДІ, 0,75–0,91. Ми вважаємо, що використання EDE + US призведе до коефіцієнта кореляції приблизно 0,91, як повідомлялося в нашому попередньому дослідженні [16]. Розподіл вибіркових коефіцієнтів кореляції зазвичай не було розподіленим, а довірчі інтервали для коефіцієнтів кореляції не були симетричними. Отже, щоб утримати оцінку нижньої межі в межах 0,04 з кореляцією 0,91 та підтримувати рівень довіри 95%, потрібно взяти вибірку для 140 пацієнтів. Щоб дозволити пацієнтам, які можуть не завершити дослідження, було зараховано 160 пацієнтів.
Демографічні дані аналізували за допомогою описової статистики, включаючи середнє значення (± SD) для інтервальних даних, відсотки для номінальних даних та медіану (діапазон) для порядкових даних. Коефіцієнт кореляції Пірсона був розрахований для вимірювання епідуральної відстані, яке включало фактичну глибину клінічної епідуральної голки (ND) та рівняння епідуральної глибини (EDE), ND та попередній EDE + US середньої лінії поздовжньої площини, а також ND та попередній EDE + US поперечної площини.
3. Результати
З серпня 2010 року по червень 2011 року було вивчено 160 породіл. Усі жінки, до яких звертались, брали участь і проводили дослідження. Демографічні дані про матері представлені в таблиці 1. Було 9 порушень епідуральної блокади: дві - ранні (90 хвилин). У жодного пацієнта не було більше однієї невдалої епідуральної блокади. Була виявлена лише одна випадкова випадкова дуральна пункція (АДП), яка в подальшому перетворилася на постдуральну пункційну головний біль (ПДФН) і потребувала терапевтичного епідурального пластиру крові (табл. 2). Розміщення епідуральної голки було зроблено без повторних введень у 92% пацієнтів, без необхідності перенаправлення голки у 54% породіл. Максимальна кількість повторних встав на одному і тому ж міжхребцевому рівні становила чотири, і 90% катетерів були успішно розміщені в трьох або менше спробах перенаправлення через те саме місце проколу.
- Важке епідуральне розміщення у вагітних із ожирінням та без ожиріння систематичний огляд та
- Заборона хірургії суглобів хворим на ожиріння - це тупикова ортопедія цього тижня
- Труни шотландців із ожирінням занадто великі, щоб їх кремувати The Independent The Independent
- Вплив хронічного лікування бета-адреноблокаторами на споживання енергії в спокої у гіпертоніків із ожирінням
- Вплив голодування та фізичних вправ на чергування на метаболізм холестерину у людей із зайвою вагою та ожирінням