Роль мінерального живлення у зменшенні теплового стресу у рослин бавовни, вирощених у тепличних та польових умовах
Предмети
Анотація
Вступ
Отже, враховуючи вирішальну роль макро (K) та мікроелементів (Zn та B) у захисті сільськогосподарських культур від широкого спектру абіотичних стресів, екзогенне застосування в стресових умовах може виявитись потужним інструментом для полегшення несприятливого впливу стресу. У цьому дослідженні порівнюється потенційна роль позакореневого розпилення макроелементів (калію) у фотосинтезі, регулюванні водних відносин та провідності устьиць та мікроелементів (цинку та бору) у розмноженні та антиоксидантах. Ці фізіохімічні норми можуть викликати толерантність до морфологічних ознак посівів бавовни, що піддаються різним тепловим режимам при квадратурі, цвітінні та формуванні цибулин. Отже, були проведені серії тепличних та польових експериментів з метою: (1) побачити вплив різних температурних режимів на фізіологію листя та врожай бавовни і (2) виявити роль макро- та мікроелементів (K, Zn та B ) для полегшення впливу високих температурних навантажень.
Матеріали і методи
Тепличний експеримент
Польовий експеримент
Спостереження
Біохімічні аналізи
Зразки листя масою 0,5 г екстрагували 10 мл фосфатного буфера (рН 7,8) для екстракції ферментів. Супернатант використовували для визначення ферменту після центрифугування, а залишки викидали. Витягнутий матеріал зберігали при 4 ° C 27. Зразки для всіх ферментативних та неферментативних антиоксидантів піпетували в 96-лункові планшети. Потім пластини зчитували мікропланшером (ELX800, Bio-Tek Instruments, Inc., Winooski, VT, USA) з різною довжиною хвилі. Вміст супероксиддисмутази визначали 28 методом. Супероксиддисмутазу кількісно визначали як ферментні одиниці, що пригнічували фоторедукцію нітроблютетразолію (NBT) та реєстрували поглинання при 470 нм. У той час як CAT вимірювали як ферментні одиниці, які перетворювали H2O2 в H2O та O2, використовуючи протокол, як описано в Liu 29. Реакційну суміш [50 мМ фосфатний буфер (рН 7) + 5,9 мМ H2O2] змішували з 0,1 мл ферментного екстракту і зчитували абсорбцію при 240 нм. Вміст пероксидази визначали за допомогою методу, наведеного в 29. Кількісно пероксидазу визначали як одиниці ферментів, що окислюють гваякол. Реакційна суміш складалася з 50 мМ фосфатного буфера (рН 5) + 40 мМ H2O2 + 20 мМ гваяколу та 0,1 мл ферментного екстракту на кожну пробу. Поглинання реєстрували при довжині хвилі 470 нм.
Для оцінки аскорбінової кислоти 900 мкл дист. H2O + 100 мкл екстракту зразка + 1 мл дихлорфенол-індофенолу + 100 мкл 0,1% мета H3PO4 змішували в пробірці, і поглинання реєстрували при 520 нм 30. Для визначення TPC 31 використовували метод реагенту Фолін-Ціокальтеу (FC). Зразки листя масою 0,5 г екстрагували 80% ацетоном (10 мл) і центрифугували. Екстракт ферменту (20 мкл) + FC-реагент (100 мкл) + 1,5 мл води змішували в кюветі і поміщали на 30 хвилин. Потім додавали 700 мМ Na2CO3 і інкубували при кімнатній температурі протягом 2 годин. Поглинання брали при 765 нм, маючи 200 мкл зразка в кожній лунці. Вміст MDA у листі бавовни визначали згідно з процедурою, адаптованою до 32. Зразок листа (0,5 г) гомогенізували в 10 мл 0,1% розчину трихлороцтової кислоти (ТСА) і центрифугували при 12000 × g протягом 15 хвилин. Для кожного мл екстракту використовували 4,5 мл тіобарбітурової кислоти (0,5%) з реакційною сумішшю, нагрівали при 95 ° С протягом 30 хв і охолоджували. Поглинання приймали при 532 і 600 нм, і концентрацію MDA визначали за формулою:
A = коефіцієнт поглинання зі значенням 156 мм -1 см см -1 .
Вміст хлорофілу
Листя бавовни (0,5 г) подрібнювали в 10 мл 80% холодного ацетону і пробірки зберігали в темряві при 20 ° С протягом ночі, що вказує на незначні модифікації раніше описаного способу 33. Суміш фільтрували через ватман № 1. Пропускали заготовку з 80% ацетоном; вимірювання проводили при 645 та 663 нм за допомогою спектрофотометра. Вміст хлорофілу розраховували за формулою:
де W - маса зразка листя, тоді як V - об'єм зразка, що використовується в спектрофотометрі (U-2001, Hitachi, Японія).
Чиста швидкість фотосинтезу та провідність устьиць
Чисту швидкість фотосинтезу та провідність устьиць визначали на трьох репродуктивних стадіях посіву бавовни через портативний інфрачервоний газоаналізатор (LCiAnalyser з широкою головкою, номер деталі LCi-002/B із серійним номером 32455). Pn вимірювали на кожній репродуктивній стадії через 3 дні розпилення між 10:00 та 12:00. на повністю розширених молодих листках.
Водні відносини
Зразки листя (вода води та осмотичний потенціал) збирали перед світанком (6:00 год.), Як описано раніше 34. Потенціал листкової води визначали в барокамері типу Шоландера (ARIMAD 2, Корея) за методикою, описаною 35 відразу після відбору проб. Поки листя зберігали при -20 ° C протягом тижня, потім розморожували, екстрагували сік і визначали осмотичний потенціал за допомогою осмометра (Osmomat 030).
Агрономічні атрибути
Десять рослин були обрані випадковим чином у кожній експериментальній одиниці заявленого дослідження, тоді як п'ять рослин були обрані з п'яти випадкових горщиків оптимального, суб- та надооптимального теплових режимів дослідження теплиці. Середню масу цибулини зазначали шляхом ділення загального врожаю насіння бавовни на рослину на загальну кількість цибулин. У той час як урожай бавовни з насіння зважували окремо для кожної ділянки/горщика та переводили на урожайність з гектара з кожної ділянки.
Статистичний аналіз
Для визначення значущості (F-тест) тепла та позакореневих поживних речовин застосовували дисперсійний аналіз. У той час як засоби лікування порівнювали за допомогою тесту на найменшу значущу різницю (p ≤ 0,05). Кореляцію між різними змінними реакції обчислювали за допомогою методів лікування, розрахованих за трьома блоками. Силу, тип і значення кореляції визначали за допомогою програмного забезпечення STATISTIX 8.1 (Analytical Software, Таллахассі, Флорида, США). Кількість пар спостережень (n) для визначення кореляції склала 36 (реплікації × основні ділянки × субдіаграми). Фігури були розроблені з використанням MS excel-2016.
Результати
Експеримент в теплиці
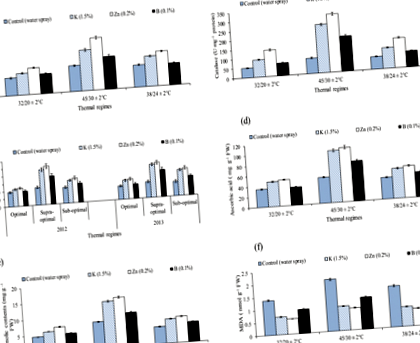
Для всіх досліджених ознак було зафіксовано значну взаємодію тепла та позакореневих поживних речовин. Супер оптимальний режим, за яким слідував неоптимальний режим, спричинив збільшення антиоксидантів, МДА та зменшення вмісту хлорофілу, швидкості фотосинтезу, газообмінних компонентів, водних відносин, маси цибулини та врожаю бавовни за оптимального температурного режиму. Позакореневе застосування `` 0,2% Zn '' показало видатні результати щодо зменшення несприятливих впливів тепла, за якими слідували `` 1,5% K '' та `` 0,1% B '' для всіх досліджуваних ознак (таблиці 2–4, рис. 1–3).
Вплив різних термічних режимів та розпилення поживних речовин на супероксиддисмутазу (SOD), каталазу (CAT), пероксидазу (POX U мг -1 білка), аскорбінову кислоту (AsA мг g -1 -1 FW), загальний вміст фенолу (TPC мг г - 1 FW) та вміст малонового диальдегіду (MDA нмоль g −1 FW), (усереднене по квадратурі, цвітінню та формуванню цибулин) листя бавовни в умовах скляного будинку.
Вплив різних теплових режимів та розпилення поживних речовин на вміст хлорофілу (a + b) (мг г −1 FW), чиста швидкість фотосинтезу - Pn (мкмоль м −2 сек −1), FW), провідність усть (Gs m моль м −2 с -1, водний потенціал листя (−MPa) та осмотичний потенціал листя (−MPa) (усереднений по квадратурі, цвітінню та формуванню цибулини) листя бавовни в умовах скляного будинку.
Вплив різних термічних режимів та розпилення поживних речовин на середню масу цибулини (г) та урожай бавовнику насіння на рослину (г) врожаю бавовни в умовах скляного будинку.
Хлорофіл a і b вміст зменшився на 15% та 66% під контролем (рослини, що очищуються водою), суб- та надноптимального теплових режимів порівняно з очищеними водою рослинами оптимального теплового режиму. Чиста швидкість фотосинтезу була зменшена на 20% та 60%, якщо порівнювати водоочищені рослини суб- і надноптимального теплових режимів з водоочищеними рослинами оптимального теплового режиму (усереднене за три стадії розмноження). Подібним чином зменшували провідність устьиць та водний потенціал, тоді як осмотичний потенціал збільшували за нижчих та надоптимальних теплових режимів.
Порівняльні поліпшення хлорофілу a, b вмісту, Pn та Gs завдяки «0,2% Zn» щодо розпилення води були статистично вищими при нижчому та надоптимальному теплових режимах. Наприклад, Zn поліпшив хлорофіл a вміст на 23% і 46% при нижчому та нижчому оптимальному тепловому режимі, ніж рослини, оброблені водою. Подібним чином цинк також покращував хлорофіл b вміст, Pn, Gs та водний потенціал при нижчому та надоптимальному теплових режимах. (Таблиця 3, рис. 2).
Хоча вихід насіння бавовни (SCY) був знижений на 66% і 23% у контролях над та неоптимального теплових режимів, ніж контроль оптимального теплового режиму. Подібне зниження було виявлено для середньої ваги цибулини. Листяне розпилення трьох поживних речовин (K, Zn та B) покращило SCY на 21%, 16% та 7% у високотемпературному режимі, ніж рослини, оброблені водою. Подібним чином поживні речовини покращували середню масу цибулини за режиму високих температур (табл. 4, рис. 3).
Польовий експеримент
Надноптимальні температурні режими були відносно більш згубними, і за ними слідували субоптимальні температурні режими (табл. 1). У той час як екзогенно застосовувані поживні речовини мали суттєві покращення порівняно з розпиленням води (контроль). Однак порівняно більш перспективні результати були отримані з використанням "0,2% Zn", потім "1,5% K", "0,1% B" та водяного розпилення. Зафіксовані поліпшення застосування екзогенних поживних речовин суттєво відрізняються за різних температурних режимів. (Таблиці 5–8, рис. 4–6).
- Харчування калію та сольовий стрес - Амтманн - Основні довідкові роботи - Інтернет-бібліотека Wiley
- Харчування - тіло, що використовується, вода, процес, життя, рослини, хімічна речовина, форма, енергія
- Мінерали в харчуванні людини - Mineral BioSciences
- Експерти з питань харчування Дискусії щодо вартості вітамінних та мінеральних добавок далеко не закінчені - ScienceDaily
- Харчування для спеки Як процвітати, коли піднімаються спокуси; Триатлоніст