РН сперми впливає на рухливість та ємність сперми
Цзі Чжоу
1 Центр репродуктивної медицини, лікарня Цзіньлін, клінічна школа медичного коледжу, Нанкінський університет, Нанкін, Китайська Народна Республіка,
Лі Чень
1 Центр репродуктивної медицини, лікарня Цзіньлін, клінічна школа медичного коледжу, Нанкінський університет, Нанкін, Китайська Народна Республіка,
Jie Li
2 Департамент нейрохірургії лікарні Цзіньлін, клінічна школа медичного коледжу, Нанкінський університет, Нанкін, Китайська Народна Республіка,
Хонджун Лі
3 Кафедра урології, лікарня Пекінського союзу медичного коледжу, Китайська академія медичних наук та Медичний коледж Пекінського союзу, Пекін, Китайська Народна Республіка,
Чживей Хонг
1 Центр репродуктивної медицини, лікарня Цзіньлін, клінічна школа медичного коледжу, Нанкінський університет, Нанкін, Китайська Народна Республіка,
Мін Се
1 Центр репродуктивної медицини, лікарня Цзіньлін, клінічна школа медичного коледжу, Нанкінський університет, Нанкін, Китайська Народна Республіка,
Шенгронг Чень
1 Центр репродуктивної медицини, лікарня Цзіньлін, клінічна школа медичного коледжу, Нанкінський університет, Нанкін, Китайська Народна Республіка,
Бінг Яо
1 Центр репродуктивної медицини, лікарня Цзіньлін, клінічна школа медичного коледжу, Нанкінський університет, Нанкін, Китайська Народна Республіка,
Задумав та спроектував експерименти: JZ BY. Виконував експерименти: JZ JL HJL. Проаналізовано дані: JZ JL HJL. Внесені реагенти/матеріали/інструменти для аналізу: ZWH MX SRC. Написав папір: JZ LC JL HJL BY.
Пов’язані дані
Усі відповідні дані містяться в роботі.
Анотація
Вступ
Згідно зі статистичними даними, приблизно кожна шоста пара безпліддя, з яких майже половина пояснюється чоловічими факторами [1]. Основні клінічні прояви чоловічого безпліддя включають зменшення кількості сперматозоїдів (олігозооспермія), зниження рухливості сперматозоїдів (астеноспермія) та морфологічні відхилення сперми (тератозооспермія) [2,3]. Понад 85% безплідних чоловіків насправді можуть виробляти сперму [4], але їх сперма часто не в змозі запліднювати яйцеклітину.
Деякі повідомлення про клінічні випадки вказують на те, що рН сперми чоловічої астеноспермії міг змінитися [11,25]. Однак чи впливає і як рН сперми на рух сперми та її ємність, залишається незрозумілим. Розуміння впливу рН насінної плазми може бути корисним для клінічного лікування безпліддя. Тому ми досліджували зміни рухливості та життєздатності сперми у біологічно значущому діапазоні рН та вимірювали відповідну активність Na +/K + -ATPase та внутрішньоклітинні зміни Ca 2+ сперматозоїдів.
Матеріали і методи
Збір сперми
Це дослідження було схвалено Комітетом з етики лікарні Нанкін Цзіньлінь відповідно до національних та міжнародних рекомендацій. У цьому дослідженні брали участь 136 добровольців чоловічої статі, середній вік яких становив 27,54 ± 3,98 (середнє ± стандартне відхилення). Перед початком дослідження від усіх учасників було отримано письмову інформовану згоду. Сперма, яку піддавали аналізу, була взята від здорових чоловіків-добровольців. Відповідно до критеріїв Всесвітньої організації охорони здоров’я (2010) у цих чоловіків була доведена фертильність та нормальна якість сперми. Зразки сперми отримували за допомогою мастурбації після принаймні 3 днів утримання.
Зразки еякулювали у стерильні контейнери та давали їм зріджуватися принаймні 30 хв, перш ніж обробляти центрифугуванням у градієнті Percoll 60% (GE Healthcare, Waukesha, WI, США) для видалення насінної плазми, незрілих статевих клітин та не сперматозоїдів клітини (переважно епітеліальні клітини), як описано Loredana-Gandini et al. [26,27]. Потім очищені сперми промивали в розчині для живлення сперми (NaCl 670,8 мг; KCl 35,6 мг; 147 мг/мл CaCl2 · 2H2O 171 мкл; KH2PO4 16,3 мг; MgSO4 · 7H2O 29,3 мг; NaHCO4 210,6 мг; D-глюкоза 100 мг; 60 % Na · лактату 0,37 мл; HEPES 238 мг; Penicllin 6 мг, розчинений у 100 мл стерильної води) 3 рази перед подальшим аналізом. У всіх наступних експериментах використовували очищену сперму, об’єднану з 3–4 добровольців, віднесених до чотирьох груп, і всі експерименти проводились принаймні у трьох повторностях.
Оцінка рухливості сперми
Очищені сперми ресуспендували в живильному розчині сперми рН 5,2, 6,2, 7,2 та 8,2 та інкубували відповідно 15, 30, 60, 90 та 120 хв. Для оцінки рухливості сперми використовували комп’ютерний аналіз сперми (CASA; WLJY-9000; Weili New Century Technology Development Co., Ltd; Пекін; Китай). Непрогресуюча моторика (NP, всі інші моделі моторики з відсутністю прогресування), прогресуюча моторика (PR, сперматозоїди, які рухаються активно, лінійно або по великому колу, незалежно від швидкості), рухливість (PR + NP), середній шлях швидкість (VAP, швидкість по розрахованому згладженому шляху), криволінійна швидкість (VCL, швидкість над фактичною доріжкою сперми, включаючи всі відхилення руху голови сперми), швидкість прямої лінії (VSL, швидкість на прямій відстані між початком і початком кінець доріжки сперми) були розраховані для кожної групи з трьох записів щонайменше 100 сперми.
Тест HOS
Тест HOS використовували для оцінки життєздатності сперми. Сперму ресуспендували в живильному розчині сперми рН 5,2, 6,2, 7,2 та 8,2 відповідно протягом 60 хв і центрифугували при 760 г протягом 15 хв. Надосадову рідину відкидали, і осад змішували з 0,5 мл розчину набухання (0,735 г дигідрату цитрату натрію і 1,351 г D-фруктози, розчиненого в 100 мл очищеної води) з наступною інкубацією протягом 30 хв при 37 ° С. Після інкубації CASA дослідила понад 200 сперматозоїдів. Відповідно до критеріїв Всесвітньої організації охорони здоров’я (2010), кількість сперматозоїдів, що набрякли та не набрякли, була зафіксована відповідно [28].
Тест на вимірювач проникнення сперми (SPM)
Капіляри, повні розчину для живлення сперми з різним рН, перпендикулярно вставляли в пробірки, що містять 200 мкл сперматозоїду (очищена сперма людини в розчині для живлення сперми). Зверху капілярні піпетки та отвір пробірок закривали герметичною плівкою з наступною інкубацією протягом 1 години при 37 ° С. Відповідно до критеріїв Всесвітньої організації охорони здоров’я (2010), відстань руху сперми вимірювали під оптичним мікроскопом (CX31; OLYMPUS; Японія).
Аналіз Na +/K + -ATPase
Сперму (10 7) розбавляли 2 мл розчинів для живлення сперми при рН 5,2, 6,2, 7,2 та 8,2 відповідно, інтенсивно перемішували та інкубували протягом 60 хв при 37 ° С в 5% інкубаторі CO2. Пробірки центрифугували при 760 г протягом 15 хв для видалення живильного розчину, осад промивали звичайним сольовим розчином 3 рази та лізували ультразвуком (4 ° С, 40% енергії, обробляли ультразвуком протягом 5 с, зупиняли на 5 с, цикл 1 хв) (VCX750; Sonics; США). Концентрацію білка визначали за допомогою аналізу біцинхонінової кислоти (BCA) (продукт № 23225, Thermo, США). Активність Na +/K + -ATPase сперми вимірювали за допомогою набору для вимірювання Na +/K + -ATPase (Nanjing Jiancheng Bioengineering Inc.), і одиницю демонстрували як μmolPi/мг prot/година.
Внутрішньоклітинний аналіз Са 2+
Рівень внутрішньоклітинного Ca 2+ сперми визначали за допомогою проточної цитометрії (FCM) та лазерної конфокальної скануючої мікроскопії (LSCM).
Сперму інкубували в ємнісних середовищах (розчини для живлення сперми з 10 мг/мл бичачого сироваткового альбуміну [BSA; NoA8806; Sigma; США]) [29], при рН 5,2, 6,2, 7,2 та 8,2 відповідно. Після інкубації протягом 3,5 год при 37 ° С в 5% -ному інкубаторі CO2, 200 мкл супернатанту, що містить ємнісну сперму, відбирали і регулювали до концентрації сперми 2 × 10 6/мл. Ці зразки були підготовлені для внутрішньоклітинного аналізу сперми на Ca 2+.
Коротко, 200 мкл сперми в ємнісному розчині центрифугували при 3000 об/хв протягом 5 хв; супернатант відкидали, а сперму ресуспендували в 300 мкл 0,01 моль/л PBS (Ca 2+ та Mg 2+ плюс). Потім зразки інкубували з 2 мкМ Fluo3-AM (Molecular Probe Inc. USA) протягом 30 хв при 37 ° C, промивали PBS і, нарешті, ресуспендували в 1 мл PBS з Ca 2+ і Mg 2+ .
Зразки суспендованої сперми, забарвлені Fluo3-AM (0,8 мл), аналізували FCM на FACS Calibur (Бектон Дікінсон, США). Для кожного зразка було виміряно 20 000 клітин та отримано інтенсивність флуоресценції кожного окремого сперматозоїда. Зміни внутрішньоклітинного Ca 2+ виражали як середню флуоресценцію, поділену на фонову флуоресценцію. Отримані дані були нарешті проаналізовані програмним забезпеченням Cell Quest (версія 3.2.1, Becton Dickinson Immunocytometry Systems, Silicon Valley, CA).
LSCM (ZEISS LSCM510, Німеччина) також використовували для вимірювання відносної інтенсивності флуоресценції в окремій спермоплазмі, доданій за допомогою Fluo3-AM. Флуоресценцію реєстрували при довжині хвилі збудження 488 нм та довжині хвилі випромінювання 530 нм. Динамічний ряд оптичних зрізів комірки отримували за допомогою XY-кроку. Вимірювання флуоресценції для різних полів зору проводили під об'єктивом 400 ×, а середню інтенсивність флуоресценції всіх клітин сперми в одному полі зору використовували для відображення інтенсивності флуоресценції цього зразка сперми.
Статистичний аналіз
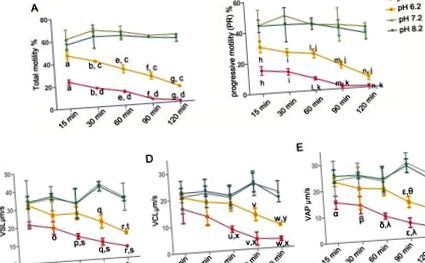
Для статистичної оцінки було використано програмне забезпечення SPSS 13.0 (SPSS Inc., Чикаго, Іллінойс, США). Лінійна регресія була використана для оцінки зв'язку між рухом сперми та швидкістю HOS. Інші результати (рухливість, PR, швидкість HOS, SPM, концентрації Na +/K + -ATPase та внутрішньоклітинні Ca 2+) порівнювали за допомогою одностороннього методу ANOVA, а однорідність дисперсії тестували раніше (з 0,1 як стандартний тест проведений тест Левена). Коли припускали рівні дисперсії, було обрано тест на ЛСД. В іншому випадку проводили тест Даннета на Т3. Дані були виражені як середнє значення ± стандартне відхилення. Різниці вважали статистично значущими, коли p Фіг. 1A, загальна рухливість сперми лише незначно зменшилася протягом усього періоду інкубації 120 хв. (PH 7,2: 59,86 ± 0,85%; pH 8,2: 56,52 ± 3,30%) при рН 7,2 та 8,2 рішення. Навпаки, кисле середовище (рН 5,2 та 6,2) суттєво знижувало відсоток загальних рухомих сперматозоїдів залежно від часу. Більше того, кисле середовище (рН 5,2 та 6,2) також знизило PR сперми (рис. 1В). Також оцінювали параметри швидкості (VSL, VCL та VAP) (рис. 1C, 1D та 1E). Параметри швидкості були подібними до PR сперматозоїдів, тобто кисле середовище (pH 5,2 та 6,2) знижувало VSL, VCL та VAP сперми.
Очищені сперми людини інкубували в рН 5,2, 6,2, 7,2 та 8,2 поживних розчинів протягом 15, 30, 60, 90 та 120 хв відповідно. (A) Рух сперми (PR + NP): a, b, e-g p c p d p h, i, l-n p j p k p o-r p t p s p u-w p y p x p α, β, δ, ε, η p θ p λ p Рис. 2B). Крім того, взаємозв'язок між швидкістю HOS та рухом сперми при різному рН аналізували через 60 хв. Виявлено позитивну кореляцію загальної рухливості сперми (r = 0,98, p, рис. 3А). Те саме стосувалося кореляції між швидкістю HOS та PR сперми (r = 0,98, p Рис. 3B).
Порівняно з групою рН 7,2, висота сперми за зростанням у групах рН 5,2 та 6,2 була значно нижчою * р +/К + -АТФазна активність знижувалася в кислому середовищі
Порівняно з pH 7,2, активність сперми Na +/K + -ATPase помітно знизилася при pH 5,2 або 6,2, тоді як не було значних відмінностей з такою при pH 8,2. * p 2+] i під час ємності сперми людини
На фіг.6 показано внутрішньоклітинний рівень Ca 2+ у спермі в розчинах ємності для сперми при різному рН, проаналізованому FCM. Інтенсивність флуоресценції внутрішньоклітинного Са 2+ (264,15 ± 81,57) досягала максимуму при рН 7,2. Порівняно з pH 7,2, інтенсивність флуоресценції внутрішньоклітинного Ca 2+ в інших групах (132,55 ± 40,11 при pH 5,2; 162,76 ± 34,34 при pH 6,2) суттєво знизилася, крім pH 8,2 (234,82 ± 55,24).
(A), результати FCM сперматозоїдів у розчинах для живлення сперми при рН 5,2, 6,2, 7,2 та 8,2 відповідно. (B), порівняно з групою рН 7,2, середня інтенсивність флуоресценції внутрішньоклітинного Са 2+ у групах рН 5,2 та 6,2 суттєво знизилася, але група рН 8,2 не показала суттєвих відмінностей. * p 2+ досягла максимуму при рН 7,2 (200,87 ± 27,43; рис. 7). Слабкі флуоресцентні сигнали спостерігалися в цитоплазмі сперми як при рН 5,2 (147,93 ± 32,90), так і при 6,2 (152,18 ± 38,05), що припускає, що кисле середовище призводить до значно нижчої концентрації внутрішньоклітинного Са 2+ і впливає на ємність сперми.
(A), результати LSCM сперматозоїдів у живильних розчинах сперми при рН 5,2, 6,2, 7,2 та 8,2 відповідно. (B), порівняно з групою рН 7,2, середня інтенсивність флуоресценції внутрішньоклітинного Са 2+ у групах рН 5,2 та 6,2 суттєво знизилася, але група рН 8,2 не показала суттєвих відмінностей. * р 0,05) [12]. Цей звіт не погоджується з нашими висновками, можливо тому, що в групі гіпомотильності було лише 39 чоловіків, а інші фактори, такі як концентрація неорганічного фосфату та іонізованого кальцію, можуть бути головним фактором, що визначає запліднення сперми. Наше дослідження, з усуненням інших факторів, може краще проілюструвати вплив рН на рухливість сперми людини.
Кальцій важливий для рухомості сперми, метаболізму, реакції акросом, гіперактивованої моторики та запліднення [46]. Зміни у внутрішньоклітинній концентрації Са 2+ пов'язані з різними аспектами функції сперми [12]. Масивний приплив Са 2+ та Са 2+ індукує гіперактивовану рухливість сперми під час реакції акросом [47,48]. Коли гіперактивовані сперми переносяться на вільне від Ca 2+ середовище протягом 30–60 хв, гіперактивований рух зупиняється, але додавання 2 мМ Ca 2+ відновлює гіперактивовану моторику [49]. Са 2+ може посилити амплітуду джгутикового биття сперми, і існує прямий зв’язок між внутрішньоклітинним рівнем Са 2+ та гіперактивованим рухом [50,51]. Повідомлялося, що Na +/K + -ATPase міг брати участь у внутрішньоклітинному гомеостазі кальцію [23,52], і його активність зростала під час ємності [53]. Наші результати показали, що низька активність Na +/K + -АТФази в середовищах рН 5,2 та 6,2 погіршить ємність сперми. Вимірявши рівень внутрішньоклітинного Са 2+, ми виявили, що рівень внутрішньоклітинного Са 2+ різко знизився при рН 5,2 і 6,2 порівняно з рН 7,2, що може призвести до зниження активності Na +/K + -АТФази, а потім знизилося Приплив Са 2+. За умови низького вмісту Ca 2+ реакція акросом не може бути ініційована, що в кінцевому рахунку вплине на запліднення.
Наші результати показали, що рН сперми впливає на рухливість сперми, маючи на увазі, що рН вагінального мікросередовища у жінок може також впливати на активність сперми. Після еякуляції сперма проходить через жіночі репродуктивні шляхи насінною плазмою; тому сперматозоїди вразливі до різних хімічних речовин як у спермі, так і в жіночих репродуктивних шляхах, і ці хімічні речовини можуть безпосередньо впливати на рухливість та метаболізм сперми, а також впливати на весь процес ємності та запліднення [54]. Зміна рН відбувається не тільки в чоловічій спермі, але і в жіночій піхві при інфекціях, таких як трихомоніаз, бактеріальний вагіноз та цитолітичний вагіноз [55], які можуть впливати на рухливість та ємність сперми та навіть призвести до безпліддя.
Висновки
На закінчення ми виявили, що слаболужні умови стимулюють рухливість і ємність сперми людини. Різко знижена активність Na +/K + -ATPase, спричинена кислим середовищем, може бути причиною зниження рухливості сперми та рівня Ca 2+, що в кінцевому рахунку вплинуло на вагітність. Однак механізми рН, що впливають на активність Na +/K + -АТФази в сперматозоїдах людини, не з’ясовані повністю. На додаток до впливу Na +/K + -ATPase, кисле середовище може мати можливість безпосередньо пошкодити мембрану сперматозоїдів або збільшити вміст активного кисню, впливаючи таким чином на рухливість і ємність сперми, що вимагає подальших досліджень.
- Це історія вашого Jizz - 21 вражаючий факт про сперму та сперму - Fistfy
- Ковтання сперми Безпека, переваги та ризики
- Ложка Семена
- Дослідження показує, як мотивація впливає на харчування та дієту EurekAlert! Новини науки
- Який зв’язок? Розуміння того, як вага впливає на жири в крові Торн