Різниця у вираженні, змісті та активності 11β-HSD1 в жировій тканині між ожирілими чоловіками та жінками
А. Торрес
1 Інститут досліджень матері та дитини, Медичний факультет, Чилійський університет, Касілла 226-3, 8360160 Сантьяго, Чилі
Г. Інігес
1 Інститут досліджень матері та дитини, Медичний факультет, Чилійський університет, Касілла 226-3, 8360160 Сантьяго, Чилі
М. Ферраріо
2 Хірургічне відділення, Клініка Лас Кондес, Сантьяго, Чилі
В. Мерік
1 Інститут досліджень матері та дитини, Медичний факультет, Чилійський університет, Касілла 226-3, 8360160 Сантьяго, Чилі
Анотація
У всіх суб'єктів, що передували операції, брали зразок крові натще. Антропометричну інформацію (вік, вагу та зріст) отримували з клінічних даних кожного суб’єкта.
Під час процедури було отримано 5 г вісцеральної жирової тканини (VAT) та 5 г підшкірної жирової тканини (SAT). Зразки були отримані з Центру хірургії ожиріння в м. Клініка Лас Кондес та клінічної лікарні Сан-Борха-Арріаран у Сантьяго, Чилі. Протокол дослідження був схвалений Інституційною комісією з огляду Клініка Лас Кондес, і всі пацієнти давали письмову інформовану згоду при прийомі на роботу.
2.1. Обробка жирових тканин
Під час операції був отриманий зразок жирової тканини з підшкірного та вісцерального відділів. Обидва зразки очистили, негайно розділили і заморозили в рідкому азоті і витримали при –80 ° C для загальної екстракції РНК та аналізу білка.
2.2. Біохімічні аналізи сироватки крові
Інсулін у сироватці крові визначали за допомогою IRMA (DIAsource, Бельгія), з коефіцієнтами варіації (CV) у межах та між аналізами 2,1 та 4,5% відповідно. Глюкозу вимірювали методом глюкозооксидази від фірми Roche Diagnostics (Мангейм, Німеччина), з інтра-аналізом та коефіцієнтом взаємодії 2,5%. Загальний холестерин, тригліцериди та холестерин ЛПВЩ та ЛПНЩ у сироватці крові визначали кількісно за допомогою системи діагностики Рефлотрон (Діагностика Roche). Тригліцериди вимірювали ферментативно за допомогою спектрофотометричного методу. Внутрішньо- та міжвипробувальне значення CV становило 1,9 та 3,7% відповідно. Чутливість до інсуліну (ІС) оцінювали на основі інсуліну натще (I0) та рівня глюкози за допомогою моделі гомеостазу (HOMA-IR) [13].
2.3. Експресійні аналізи
2.3.1. Повне виділення та кількісне визначення РНК
Загальну РНК екстрагували із приблизно 100 мг ПДВ та SAT, використовуючи реагент TRIzol (Invitrogen Corp., CA, USA) відповідно до інструкцій виробника. Шматочки жирової тканини гомогенізували в 1 мл TRIzol, доповненого глікогеном (0,25 мг/мл, Amersham Life Sciences), використовуючи механічний гомогенізатор (Kontes Glass Company, Vineland, NJ, США), фази розділяли центрифугуванням (12000 об/хв протягом 20 хв при 4 ° C) після додавання хлороформу. Для осадження РНК до супернатанту додавали ізопропанол і центрифугували при 12000 об/хв протягом 15 хв при 4 ° С. Гранулу промивали в 500 мкл 75% етанолу. РНК ресуспендували у воді, обробленій діетилпірокарбонатом. Цілісність РНК оцінювали електрофорезом на 2% (мас./Об.) Агарозних гелях, і кількість визначали спектрофотометрично в NanoDrop ND-1000 (NanoDrop Technologies, Wilmington, DE, USA). Комплементарну ДНК синтезували з 2 мкг загальної РНК, перевареної раніше ДНКазою I (Fermentas, США), використовуючи випадкові праймери (Invitrogen) та 200 U зворотної транскриптази RevertAid H Minus M-MuLV (Fermentas), дотримуючись інструкцій виробника.
2 мкл кДНК використовували для ампліфікації 11β-HSD1, відрегульованого до загального об’єму 25 мкл, додаючи ПЛР-буфер, що містить 3 ммоль/LMgCl2, 0,63 U Taq ДНК-полімерази (Invitrogen), суміш нуклеотидів та 0,4 мкмоль/л кожного з двох конкретні праймери (вище за течією: 5 ′ ′ - AGGAAAGCTCATGGGAGGACTAG-3 ′ ′ і нижче за течією: 5 ′ ′ - ATGGTGAATATCATCATGAAAAAGATTC-3 ′ ′). Реакцію проводили в Thermocycler PT-100 (MJ Research Inc., Watertown, MA, USA), використовуючи умови, які були раніше стандартизовані: денатурація при 94 ° C протягом 1 хв; відпал при 55 ° С протягом 1 хв; продовження при 72 ° С протягом 1 хв 30 сек і повторювати їх протягом 31 циклу.
Як внутрішній контроль, кДНК 18S рРНК ампліфікували в кожному зразку при тих же умовах, описаних вище, за винятком 1,5 ммоль/л MgCl2 і повторювали протягом 18 циклів. Щоб визначити, що ампліфікація всіх генів була в лінійному діапазоні, ми оцінили лінійність ампліфікації відповідних транскриптів в жировій тканині і згодом вибрали кількість циклів. Амплікони (139 п.о., для 11β-HSD1 та 191 п.н. для 18S рРНК) візуалізували на 2% агарозному гелі, використовуючи GelRed Nucleic Acid Stain (Biotium). Напівкількість продуктів ПЛР проводили за допомогою аналізу зображень (система документації та аналізу електрофорезу KODAK EDAS 290, програмне забезпечення для аналізу зображень Kodak 1D). Результати виражаються як співвідношення між дослідженим мРНК геном/18S рРНК (AU = довільні одиниці).
2.4. Ферментативні аналізи
Екстракція білка -
Тканини VAT та SAT гомогенізували в крижаному 0,1 М PBS pH 7,5, доповненому антипротеазами (Complete, Mini, коктейльні таблетки, що не містять ЕДТА, інгібітори протеази, Roche Applied Science). Потім гомогенат тканини центрифугували при 12000 об/хв протягом 30 хв при 4 ° C, і отриманий супернатант збирали та аналізували на концентрацію білка, використовуючи набір для аналізу білка BCA (Pierce, Rockford, IL, USA) із BSA як стандарт.
2.4.1. Ферментативна активність 11β-HSD1
Ферментативний аналіз був раніше описаний Mericq та співавт. [14], модифікований відповідно до типу досліджуваної тканини. Умови реакції встановлювали з використанням різних концентрацій кофактора, неміченого кортизону та часу інкубації. Також оцінювали лінійність ферментативної реакції.
Коротко кажучи, 200 мкг білкового екстракту інкубували в 0,5 мл фосфатного буфера (0,1 моль/л рН 7,6) у присутності 25000 ц.м. [3] -кортизону (Amersham, Великобританія), 0,05 мкМ кортизону та 400 мкМ NADPH (Sigma Chemicals). Реакцію ініціювали додаванням кофактора протягом 24 год при 37 ° С на струшуючій водяній бані. Аліквоти екстрагували в 7 обсягів дихлорметану, а стероїди відокремлювали за допомогою високоефективної тонкошарової хроматографії (HPTLC, Merck), використовуючи метанол-хлороформ (8: 92) як рухому фазу. Смуги, що містять мічений кортизон і кортизол, ідентифікували за допомогою УФ-світла холодних носіїв, розрізали та підраховували в сцинтиляційному лічильнику (Tracor Analytic Delta 300). Норми кортизону до кортизолу розраховували на основі питомої активності міченого кортизолу та радіоактивності кортизолу (пікограми), що утворюється на мг білка на годину.
2.4.2. Вестерн-блот-аналіз
Рівні кількості (12,5 мкг) жирових білків розчиняли електрофорезом із застосуванням 14% гелів SDS-поліакриламіду, а потім переносили в нітроцелюлозні мембрани (Bio Rad Laboratories, Геркулес, Каліфорнія, США). Мембрани блокували 5% BSA в TBS-T (20 ммоль/л трис рН 7,2, 137 ммоль/л NaCl, 0,1% (об/об) Твін-20) протягом 1 год при кімнатній температурі. Пляки досліджували антитілами проти 11β-HSD1 (Санта Круз Біотехнологія, Санта Круз, Каліфорнія, США) та β-актином (Sigma-Aldrich, Сент-Луїс, Міссурі, США). Після тривалого промивання смуги виявляли з відповідними кон’югованими з пероксидазою хрону вторинними антитілами (Rockland Immunochemical Research, Gilbertsville, PA, USA) з подальшим посиленням хемілюмінесценції (ECL плюс система Western Blotting Detection System; Amersham Biosciences, Little Chalfont, UK). Зображення отримували та оцінювали за допомогою програмного забезпечення для збору та аналізу зображень UltraQuant (Ultralum Inc., Клермонт, Каліфорнія, США), нормалізованого щодо β-актину та вираженого як довільні одиниці (AU).
2.4.3. Статистичний аналіз
Результати відображаються як середнє значення ± SEM. Відповідно до розподілу даних між t-критерієм або критерієм Манна-Уітні використовували для порівняння груп та парним t-критерієм або критерієм Вілкоксона для внутрішньогрупового порівняння. Дослідження кореляції проводили за допомогою тесту Пірсона або Спірмена відповідно до розподілу даних. Статистика проводилася за допомогою SPSS v11.5.
3. Результати
3.1. Експресія жирової тканини 11β-HSD1
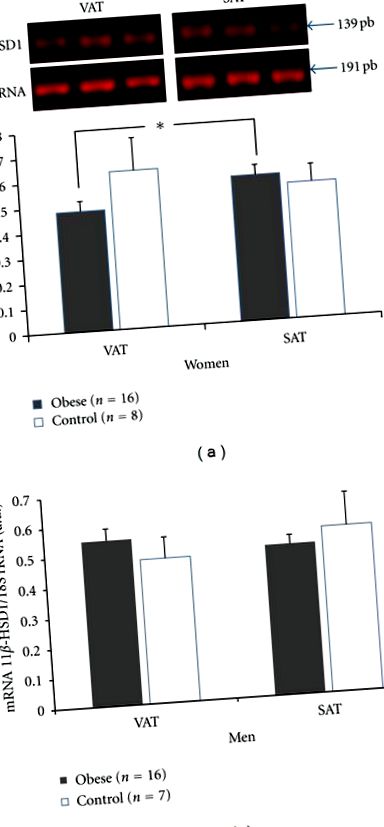
Не було виявлено відмінностей у експресії генів ферменту 11β-HSD1 у ПДВ та САТ у осіб, що страждають ожирінням та серед осіб, які не страждають від захворювання. Крім того, не виявлено відмінностей у експресії гена VAT ензиму 11β-HSD1 ні серед людей із ожирінням, ні серед негрубих, ні в САТ серед тих, що страждають ожирінням, порівняно з їх аналогами.
RT-PCR 11β-HSD1. Рівні мРНК у вісцеральній жировій тканині (VAT) та підшкірній жировій тканині (SAT), розділених за статтю. (а) жінки, (б) чоловіки. Дані виражаються як середнє значення ± SEM.
3.2. Рівні білка жирової тканини 11β-HSD1
Репрезентативне зображення Вестерн-блот-аналізу в жировій тканині з використанням специфічного антитіла показано на малюнку 2 для 11β-HSD1 з молекулярною масою 34 кДа (очікувана смуга) і двома додатковими смугами 50 і 68 кДа.
Рівні білка та активність 11β-HSD1. Рівні білка та активність ферментів у вісцеральній жировій тканині (VAT) та підшкірній жировій тканині (SAT), розділених за статтю. (a, c) Жінки, (b, d) чоловіки, відповідно. Дані виражаються як середнє значення ± SEM. K: нирка F: фібробласт шкіри людини.
Вміст білка в ізоформі 34 кДа 11β-HSD1 ПДВ не відрізнявся у пацієнтів із ожирінням та без них (0,35 ± 0,08 проти 0,41 ± 0,17 AU відповідно, P = ns), а також у SAT (0,14 ± 0,04 проти 0,06 ± 0,05). Додаткова смуга 50 кДа раніше була описана в жировій тканині людини як ізоформа 11β-HSD1 [15, 16]. У нашому дослідженні ця форма 50 кДа була більш поширеною, ніж ізоформа 34 кДа. Ця смуга спостерігалася також у фібробластах шкіри та нирок шкіри людини (рисунок 2).
Додаткова смуга в 68 кДа, що відповідає димерній формі 11β-HSD1, раніше описаній у цій тканині [15, 16], у ПДВ та САТ не відрізнялася між ожирінням та неблудними чоловіками чи жінками (дані не наведені).
3.3. Активність жирових тканин 11β-HSD1
Активність ферменту 11β-HSD1 при ПДВ ожиріння була нижчою, ніж активність ферменту у суб'єктів, які не страждають на ожиріння (дані не наведені). Не було виявлено відмінностей в активності ферментів у САТ ожиріння порівняно з пацієнтами, які не страждали на ожиріння.
Поєднуючи всіх суб'єктів (з ожирінням та без), ми виявили значну негативну кореляцію між активністю ферменту 11β-HSD1 та ІМТ (SDS) (r = - 0,290; P = 0,046) (дані не наведені). Далі ми розділили вибірку за статтю і виявили, що суттєва кореляція спостерігалася лише у жінок (r = - 0,418; P = 0,042; рисунок 4). Подібним чином була виявлена зворотна кореляція між вмістом ферменту в білках VAT та ІМТ (SDS) у жінок, але не у чоловіків (r = - 0,513; P = 0,012; Рисунок 3). Ці кореляції не спостерігались у СБ.
Зв'язок між рівнем білка 11β-HSD1 у вісцеральній жировій тканині та індексом маси тіла (SDS) у всій групі, розділеній за статтю.
Зв'язок між ферментативною активністю 11β-HSD1 у вісцеральній жировій тканині та індексом маси тіла (SDS) у цілій групі, розділеній статтю.
Ми також проаналізували, чи була якась різниця експресії або активності ферменту 11β-HSD1 між пацієнтами з ожирінням (M + W) з найгіршим метаболічним профілем із використанням HOMA-IR та тригліцеридів. Порівнюючи вищі та нижчі рівні цих параметрів, ми не виявили відмінностей серед осіб, що страждають ожирінням (дані не наведені).
4. Обговорення
У цьому дослідженні ми проаналізували можливі зміни експресії генів, активності та вмісту білка 11 β-гідроксистероїддегідрогенази типу 1, що бере участь у метаболізмі кортизолу, в підшкірній (SAT) та вісцеральній жировій тканині (ВДС) дорослих із ожирінням обидва статі проходять баріатричну хірургію. Крім того, ми порівнювали результати з результатами, отриманими серед дорослого населення, що не є глубокими. Ми також визначили концентрацію глюкози в сироватці крові, інсуліну, загального холестерину та тригліцеридів як у людей, що страждають ожирінням, так і в групах, які не страждають від нубу.
У цьому дослідженні ми відібрали однорідну за статтю групу осіб, що страждають ожирінням, і, як очікувалося, спостерігались значні відмінності у вазі та ІМТ як для чоловіків, так і для жінок у порівнянні з відповідними групами контролю.
Експресія генів 11β-HSD1 не показала жодних відмінностей при порівнянні групи ожиріння та групи, яка не страждає на ожиріння, що узгоджується з результатами, про які повідомляли Купер та Стюарт [17]. Однак Марінієлло та ін. Виявили вищу експресію 11β-HSD1 у ПДВ із ожирінням порівняно з контролем, можливо, через менший обсяг вибірки [15]. Автори припускають, що ІМТ може бути фактором, який може вплинути на результати. Середній ІМТ у звіті Mariniello et al. [15] становив 44 кг/м 2, а у звіті Купера та Стюарта [17] - 33 кг/м 2, останній був ближчим до нашої досліджуваної групи (35 кг/м 2), де були знайдені подібні результати. Хоча експресія гена 11β-HSD1 не відрізнялася при порівнянні ожиріння та контролю, ми виявили нижчу експресію 11β-HSD1 у ПДВ жінок.
Щоб піти на крок далі у пошуку причин зміненого метаболізму кортизолу в жировій тканині, ми далі перейшли до визначення вмісту білка та активності ферментів 11β-HSD1 у цій тканині. Згідно з результатами, отриманими в цьому дослідженні, і результатами, про які повідомляють Канністо та Марініелло, молекулярна форма 11β-HSD1 34 кДа, мабуть, не відіграє важливої ролі в жировій тканині, що змушує нас зосередитися на формі 50 кДа. Наявність цієї форми була характерною для цього типу тканин і мала вищий відносний достаток у порівнянні з ізоформою 34 кДа. У пацієнтів із ожирінням ми виявили нижчий вміст білка у формі 50 кДа в ПДВ ожиріння порівняно з негрубими жінками, що не спостерігалося ні в САТ серед жінок, ні в ПДВ, ні у САТ у чоловіків, і ці рівні білка були негативно пов'язані з ІМТ тільки у жінок. Хоча докази залишаються невідомими щодо біологічної активності цієї форми, цей документ створив прецедент для подальших досліджень цієї форми 50 кДа.
Щодо ферментативної активності 11β-HSD1, результати були подібні до тих, що були виявлені за вмістом білка. Активність ферменту 11β-HSD1 відповідно до статі була знижена у людей із ожирінням у ПДВ порівняно з жінками, які не страждають на лоб. Ці результати не були виявлені у чоловіків. Ця знижена активність 11β-HSD1 у ПДВ, виявлена у жінок, негативно пов'язана з ІМТ, що також не спостерігалося у чоловіків, що свідчить про те, що метаболізм кортизолу через фермент 11β-HSD1 регулюється в ПДВ із статевим диморфізмом.
Є кілька повідомлень, які вимірювали активність ферментів 11β-HSD1 в жировій тканині. Хоча було встановлено, що як активність, так і експресія ферменту в САТ, як правило, підтримують позитивну асоціацію з ІМТ [17, 18], результати щодо ПДВ суперечливі. В одному випадку не було різниці в активності між ожирілими та худими суб’єктами, що свідчить про можливий вплив концентрації NADPH-кофактору на модуляцію ферментної активності [19], в той час як в іншому дослідженні була встановлена пряма залежність між активністю вісцеральних 11β-HSD1 з Повідомлялося про ІМТ та масу вісцерального жиру [20]. Запропоновано можливий внесок макрофагів у модуляцію активності ферменту, хоча і в меншій мірі [21].
Наявні у мишей звіти демонструють чіткий зв’язок між ефектом анатомічного розподілу жирової тканини та розвитком типових особливостей метаболічного синдрому, в якому вісцеральна жирова тканина відіграє ключову роль порівняно із САТ. Однак результати щодо експресії генів та активності ферментів 11β-HSD1 у дослідженнях вісцеральної та підшкірної жирової тканини у людей були суперечливими та не підтвердили спостереження на мишачих моделях. Хоча деякі дослідження виявили різницю в експресії та/або активності ферменту 11β-HSD1 у ПДВ ожиріння порівняно з контролем [15] або між ПДВ та САТ суб'єктів із ожирінням [11, 22], інші не виявили відмінностей між ожирінням та жінки, які не страждають на глубокий вираз [11].
Наші результати свідчать про існування можливого модуляторного механізму ферментативної активності 11β-HSD1 в жировій тканині жінок, який відрізняється від чоловічого.
Це зниження активності ферментів є результатом нижчої експресії та вмісту білка 11β-HSD1 у ПДВ жінок. Ці висновки можуть призвести до зменшення концентрації портального кортизолу, що захищає організм від шкідливого впливу вісцерального ожиріння. Однак загальна кількість жирової маси у людей з ожирінням, мабуть, досить висока, щоб цей компенсаторний ефект міг послабитись. Ці висновки повинні бути підтверджені в майбутніх дослідженнях, включаючи більшу кількість досліджуваних. Нещодавно внесок печінкового та одержуваного з жиру кортизолу в регуляцію осі HPA-наднирники досліджували на моделі трансгенних мишей із специфічною для печінки делецією 11β-HSD1 [23]. Автори показали, що ці миші LKO змогли регенерувати кортизол з кортизону до 40% контролю, а циркулюючий кортикостерон був незмінним, але розмір надниркових залоз був збільшений, що свідчить про хронічну стимуляцію HPA. Вони прийшли до висновку, що специфічна для печінки делеція 11β-HSD1 зменшує регенерацію кортикостерону і може бути важливою для встановлення аспектів тону осі ГПА, не впливаючи на профіль метаболіту стероїдних клітин у сечі, підкреслюючи внесок перехресних зв’язків між тканинами-мішенями глюкокортикоїдів у визначенні метаболічного фенотипу.
Підводячи підсумок, ми повідомляємо про нижчу експресію та активність ферментів 11β-HSD1 при ПДВ ожиріння порівняно з жінками, які не страждають на ожиріння, що призведе до зменшення місцевого виробництва кортизолу.
Конфлікт інтересів
Не існує конфлікту інтересів, який міг би сприйматись як упередження неупередженості дослідження.
- Повна стаття Відмінності експресії генів у жировій тканині, пов’язані з пухлиною грудей
- Визначники впливу на експресію гена жирової тканини людини на дієту, стать, метаболічний статус та цис
- Повна стаття Оцінка жирової тканини епікарда у маленьких дітей із ожирінням
- Зберігання жиру як жирової тканини з книги «Їжа та регулювання ваги» Стівена Гісласона
- Вподобання щодо їжі та активності у дітей худорлявих та ожирілих батьків - PubMed