Рівні ендоканабіноїдів у лімбічному передньому мозку та гіпоталамусі щурів щодо голодування, годування та насичення: стимулювання прийому їжі 2-арахідоноїл гліцерином
Тім Сі Кіркхем
1 1 Департамент психології, Університет Редінга, Ерлі Гейт, Уайт Найтс, Редінг RG6 6AL
Клер М Вільямс
1 1 Департамент психології, Університет Редінга, Ерлі Гейт, Уайт Найтс, Редінг RG6 6AL
Філомена Фецца
2 2 Дослідницька група ендоканабіноїдів, Istituto di Chimica Biomolecolare, Consiglio Nazionale delle Ricerche, Comprensorio Olivetti, Fabbr. 70, 80078, Поццуолі (Неаполь), Італія
Вінченцо Ді Марцо
2 2 Дослідницька група ендоканабіноїдів, Istituto di Chimica Biomolecolare, Consiglio Nazionale delle Ricerche, Comprensorio Olivetti, Fabbr. 70, 80078, Поццуолі (Неаполь), Італія
Анотація
Ендоканабіноїди беруть участь у регулюванні апетиту та маси тіла. У гризунів анандамід стимулює прийом їжі, діючи на центральні рецептори CB1, і ендоканабіноїди гіпоталамусу можуть перебувати під негативним контролем лептину. Однак зміни рівня ендоканабіноїдів у мозку безпосередньо у зв’язку з годуванням або зміною харчового статусу не досліджувались.
Ми вимірювали рівні анандаміду та 2-арахідоноїл гліцерину (2-AG) у ділянках мозку щурів, пов’язаних із годуванням, під час голодування, годування смачною їжею або після насичення. Рівні ендоканабіноїдів порівнювали з рівнями щурів, які годувались “ad libitum”, у той момент їх щоденного циклу, коли мотивація до їжі відсутня. Підвищення рівня голодування анандаміду та 2-АГ у лімбічному передньому мозку та, меншою мірою, 2-АГ у гіпоталамусі. Навпаки, гіпоталамусовий 2-AG знижувався, коли тварини їли. У насичених щурів змін не виявлено. На рівні ендоканабіноїдів у мозочку, контрольній області, яка безпосередньо не бере участь у контролі надходження їжі, ніякі маніпуляції не впливали.
Оскільки 2-AG був найбільш чутливим до варіацій під час годування та регуляції лептину в попередньому дослідженні, ми вивчали поведінкові ефекти 2-AG при введенні в оболонку nucleus accumbens, область лімбічного переднього мозку, сильно пов'язана з мотивацією харчування. 2-АГ сильно і залежно від дози стимулює годування. Цей ефект послабив антагоніст рецептора CB1 SR141716.
Ці висновки дають перші прямі докази змінених рівнів ендоканабіноїдів у мозку та, зокрема, 2-AG під час голодування та годування. Природа цих ефектів підтримує роль ендоканабіноїдів у контролі апетитивної мотивації.
Вступ
Відкриття каннабіноїдних рецепторів у центральній нервовій системі (Devane et al., 1988; Matsuda et al., 1990) та їх ендогенних лігандів, ендоканабіноїдів арахідоноїл етаноламід (анандамід; Devane et al., 1992), 2-арахідоноїл гліцерин (2-AG; Mechoulam et al., 1995, Sugiura et al., 1995) та 2-арахідонілгліцериловий ефір (ефір ноладину; Hanus et al., 2001) породили значні дослідження щодо їх поведінкового значення. З'являється все більше доказів про роль ендоканабіноїдних систем у регуляції апетиту (Kirkham & Williams, 2001a), причому як екзогенний канабіноїд, Δ 9 -тетрагідроканабінол (Δ 9 -ТГК), так і анандамід надійно викликають переїдання (Foltin et al. ., 1988; Williams & Kirkham, 1998; Williams & Kirkham, 1999; 2002a; Hao et al., 2000; Jamshidi & Taylor, 2001; Koch, 2001; Koch & Matthews, 2001). Ці гіперфагічні дії опосередковані канабіноїдними рецепторами центрального типу CB1 (Williams & Kirkham, 1999; 2002a), оскільки вони вибірково блокуються антагоністом CB1, SR141716, але не SR144258, антагоністом периферично експресованих рецепторів CB2 (Munro et al., 1993; Рінальді-Кармона та ін., 1998). Навпаки, селективна блокада CB1 сама по собі пригнічує годування (Arnone et al., 1997; Simiand et al., 1998; Colombo et al., 1998; Kirkham & Williams, 2001b; Le Fur et al., 2001), тоді як миші з генетично порушеними рецепторами CB1 їдять менше, ніж миші дикого типу у відповідь на дефіцит їжі (di marzo et al., 2001).
Є й інші вказівки на те, що ендоканабіноїди є ключовими компонентами систем, що регулюють як годування, так і масу тіла. Наприклад, ендоканабіноїди, як видається, мають вирішальне значення для вигодовування новонароджених (Fride et al., 2001), і вони беруть участь у реакціях живлення у філогенетичному масштабі (de petrocellis et al., 1999). Крім того, біосинтез гіпоталамічного анандаміду та 2-АГ може контролюватися лептином, пептидним гормоном, що виробляється адипоцитами, який, як вважають, сигналізує про стан харчування в областях мозку, що контролюють апетит (Friedman & Halaas, 1998). Таким чином, введення лептину пригнічує рівень ендоканабіноїдів гіпоталамусу у звичайних щурів; в той час як генетично ожиріні, хронічно гіперфагічні щури та миші експресують підвищений, реверсивний лептин, рівень гіпоталамусу анандаміду або 2-АГ (di marzo et al., 2001).
Здатність блокувати або генетично видаляти рецептори CB1 пригнічувати прийом їжі свідчить про те, що тонічне вивільнення ендоканабіноїдів може мати вирішальне значення для нормальної експресії годування. Однак досі не було прямих вимірювань рівня ендоканабіноїдів у мозку, пов'язаних конкретно з випадком годування або мотиваційними факторами, що впливають на споживання їжі.
У цьому дослідженні ми досліджували зміни, пов’язані з харчуванням, в ендоканабіноїдах головного мозку, і ми вирішили дослідити рівні анандаміду та 2-АГ у гіпоталамусі та лімбічному передньому мозку щурів. Як зазначено вище, є непрямі докази того, що ендоканабіноїди гіпоталамусу сприйнятливі до маніпуляцій, що впливають на поведінку годування, таких як потенційно аноректичні ефекти введення лептину та гіперфагія, проявляється тваринами з генетичним ожирінням. Лімбічний передній мозок містить низку ділянок, пов’язаних із годуванням, включаючи область оболонки ядра accumbens (AcbSh). Регіон оболонки акумбенсу значною мірою причетний до генерації емоційного збудження та поведінкової активації у відповідь на нагороджувальні стимули, включаючи стимулювання їжі (Kelley, 1999; Ikemoto & Panksepp, 1999; Stratford et al., 1998). В якості контролю ми також дослідили рівні анандаміду та 2-AG в мозочку - області мозку, яка безпосередньо не пов'язана з мотивацією годування.
За допомогою чутливої та специфічної газової хроматографії-мас-спектрометричного аналізу (Bisogno et al., 1999) ми досліджували регіональні рівні анандаміду та 2-AG у тварин, яких було вбито: після позбавлення їжі; займаючись споживанням смачної їжі або після насичення цією їжею. Рівні ендоканабіноїдів у цих тварин порівнювали з рівнями не обділених щурів, убитих у певний момент під час їх щоденного циклу годування, коли мотивація до їжі була мінімальною, а годування відсутнє. Ми розсудили, що якщо ендоканабіноїдна активність є ключовою для апетитної фази мотивації прийому їжі, то позбавлення їжі з її очевидною здатністю викликати голод максимізує нашу здатність виявляти відповідні зміни в анандаміді та 2-АГ. Як варіант, якщо ендоканабіноїдна активність сприяє більш безпосередньому оросенсорному винагороді під час прийому всередину, відповідні зміни слід максимізувати, дозволяючи тваринам жадібно споживати дуже смачну їжу. Нарешті, дослідження мозку тварин, які поїли до насичення, забезпечило додатковий контроль для оцінки специфічної участі ендоканабіноїдів на всіх етапах апетиту та годування.
На додаток до цих аналізів, ми також дослідили гострі дії на прийом їжі при введенні 2-АГ. Хоча було показано, що анандамід екзогенно вводить гіперфагію у щурів та мишей (Williams & Kirkham, 1999; Hao et al., 2000; Jamshidi & Taylor, 2001), і 2-AG може відновити вигодовування у новонароджених мишей, які отримували SR141716 (Fride та ін., 2001), прямі гіперфагічні ефекти 2-AG ще не опубліковані. Ми вирішили дослідити ефекти 2-AG, що вводиться безпосередньо в оболонку nucleus accumbens. Цей регіон експресує рецептори CB1, а також пов'язаний із стимулюванням годування та обробкою заохочувальної та винагородної цінності їжі, а отже, є потенційно чутливим місцем для гіперфагічних дій агоністів канабіноїдних рецепторів. Щоб оцінити локалізацію будь-яких поведінкових ефектів 2-АГ в оболонці акумбенсу, ми також ввели ендоканабіноїд у бічний шлуночок.
Ми наводимо докази змін як анандаміду, так і 2-АГ у мозку щурів відповідно до змін харчового статусу та поведінки годування, і демонструємо, що 2-АГ може стимулювати харчування шляхом дії на рецептори CB1 переднього мозку в ключовому ядрі, пов'язаному з апетитом.
Методи
Тварини
Дорослих самців щурів з капюшоном Lister (Harlan, Великобританія) вагою приблизно 450 г на початку випробувань утримували поодиноко під зворотним циклом 12: 12 год світло/темно (світло вимикається при 1000). Їжа та вода були у вільному доступі завжди, за винятком випадків, зазначених нижче. Усі процедури проводились згідно з вимогами Закону про тварини Великобританії (про наукові процедури) 1986 року.
Рівні ендоканабіноїдів мозку щодо годування та депривації
Лікування тварин
Усі тварини були вбиті при підвищенні концентрації СО2, їх мозок негайно видалено і заморожено на сухому льоду. Гіпоталамус і лімбічний передній мозок тварин у кожній групі швидко розтинали, об'єднували та заморожували в рідкому азоті. Потім зразки відправляли на сухий лід до лабораторії Неаполя.
Вилучення та кількісна оцінка ендоканабіноїдів
Тканини гомогенізували в 5 об. Хлороформу/метанолу/трис HCl 50 мМ (2: 1: 1), що містить 1 нмоль d8-анандаміду та d8-2-AG. Дейтеровані стандарти були синтезовані з d8 арахідонової кислоти та етаноламіну або гліцерину, як описано відповідно у Devane et al. (1992) та Bisogno та співавт. (1997). Гомогенати центрифугували при 13000 g протягом 16 хв (4 ° C), водну фазу та сміття збирали і двічі екстрагували 1 об. Хлороформу. Органічні фази з трьох екстракцій об'єднували і органічні розчинники випаровували у обертовому випарнику. Потім ліофілізовані зразки зберігали замороженими при -80 ° C в атмосфері азоту до аналізу.
Аналіз вмісту ендоканабіноїдів за допомогою ГХ-МС
Статистичний аналіз
Засоби ± семе (n = 4) кількості ендоканабіноїдів у одній і тій же зоні з різних груп годівлі порівнювали одностороннім ANOVA з подальшим тестом Бонферроні з порогом значущості Р -1 та 3 мг кг -1, відповідно) після індукції анальгетики бупренорфіном (0,3 мг кг -1). Потім щурам імплантували направляючі канюлі з нержавіючої сталі 26 калібру, використовуючи стереотаксичну техніку з плоским черепом. Одна група отримала двосторонні канюлі, спрямовані на оболонку nucleus accumbens (AcbSh; координати щодо брегми: передньозадня, +1,2 мм; латеромедіальна, ± 1,0 мм; дорзовентральна, -7,0 мм). Другій групі імплантували одну канюлю, спрямовану на бічний шлуночок (LV; координати: AP, -1,0 мм; LM +1,6 мм; DV 3,0 мм). Координати визначались за посиланням на атлас Paxinos & Watson (1986). Після фіксації на черепі гвинтами з нержавіючої сталі та стоматологічним цементом канюлі герметизували стилетами, щоб зберегти свою прохідність.
Процедура
Починаючи з 14 днів після операції, щурів ознайомили з процедурами інфузії препарату та умовами випробувань, описаними нижче. Щоб встановити стабільний прийом, протягом 1 тижня проводили фіктивні інфузії та тести на прийом протягом 2 годин з внутрішньомозковою сольовою інфузією в останній вихідний день.
У кожну дослідну добу, за 10 хв до настання темряви, щурів виймали з клітин для тестування і давали одноразові LV або одночасні двосторонні мікроінфузії AcbSh 0,15 М сольового розчину або 2-AG (0,125, 0,5, 2,0 мкг на щура; Alexis Chemical, Ноттінгем, Великобританія). Термін ін'єкцій був обраний таким чином, щоб збігатися з нічними звичками годування щурів, щоб посилити ендогенну, пов'язану з харчуванням активність канабіноїдних систем мозку. Інфузії подавали протягом 90 с через інжектори 33-го калібру (виступаючи 1,0 мм за кінчик направляючої канюлі), використовуючи автоматичні мікрошприцеві насоси в обсязі 0,5 мкл на сторону (AcbSh) або 1,0 мкл на щура (LV). Для двосторонніх ін’єкцій в кожну сторону мозку вводили половину загальної дози. Через одну хвилину після завершення кожної інфузії інжектори видаляли, канюлі повторно герметизували, а щурів поміщали в їх випробувальні камери. Їжу (чау; PCD Mod C; Special Diet Services, Witham, Великобританія) та споживання води згодом вимірювали через 1 та 2 год, з відповідною корекцією щодо розливу їжі. Усі щури отримували всі обробки відповідно до врівноваженої конструкції, принаймні 48 годин між послідовними обробками.
Після завершення початкової серії реакції доза-реакція щурів з канюлями AcbSh повторно тестували для вивчення здатності антагоніста CB1 SR141716 ([N-піперидино-5- (4-хлорфеніл) -1- (2,4-дихлорфеніл) -4-метилпіразол-3-карбоксамід]; Vernalis Ltd, Вокінгем, Великобританія) для блокування поведінкових дій найпотужнішої дози 2-АГ. За тридцять хвилин до настання темряви щурам вводили підшкірну ін’єкцію 0,5 мг кг -1 SR141716 (розчиненого в 10% розчині ДМСО, в обсязі 1 мл кг -1). Двосторонні інфузії фізіологічного розчину або 0,5 мкг 2-АГ вводили через 20 хв, а споживання їжі контролювали протягом наступних 2 год. Доза SR141716 була обрана на основі попереднього спостереження за її здатністю послаблювати гіперфагічні дії Δ 9-ТНС та анандаміду (Williams & Kirkham, 1999; 2002a).
Гістологія
По закінченню випробувань щурів вбивали CO2 і обезголовили. Чорнило Індії вводили в кожну канюлю ЛШ об'ємом 1 мкл перед декапітацією. Голови поміщали у 10% розчин, забуференний фосфатом формальдегіду, на 4 дні. Згодом мозок видалили, розрізали коронально і зафарбували крезилфіолетовим. Доріжки канюлі визначали візуальним оглядом під мікроскопом. Наявність чорнила в шлуночках підтверджує розміщення канюлі ЛШ. Ці інспекції виявили, що місця ін’єкцій для двох тварин із групи акуменс лежать за межами AcbSh. Дані цих тварин були виключені з подальшого аналізу даних.
Статистичний аналіз
Дані про споживання для кожної групи аналізували, використовуючи односторонній ANOVA для повторних вимірювань. Порівняльні порівняння були проведені за допомогою тесту Ньюмана – Кельса для множинних порівнянь.
Результати
Зміни, пов’язані з годуванням, у рівнях ендоканабіноїдів
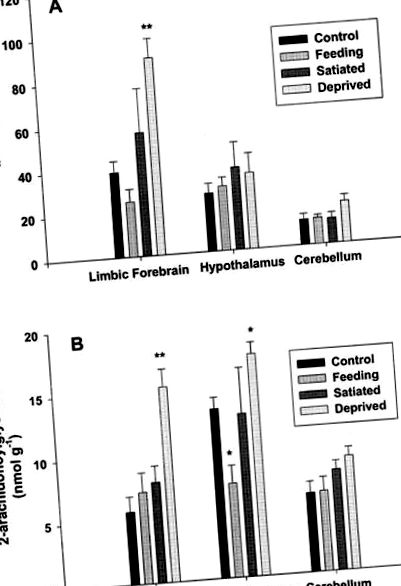
Аналіз регіональних рівнів анандаміду та 2-AG у тканині мозку виявив чіткі зміни у відповідь на наші експериментальні маніпуляції (рис. 1). В умовах контролю (група 1) рівні анандаміду були найвищими в лімбічному передньому мозку, тоді як 2-АГ були найвищими в гіпоталамусі. Рівні анандаміду в мозочку контрольних щурів були нижчими, ніж в інших тканинах, тоді як рівні 2-АГ були подібними до рівня в лімбічному передньому мозку. Важливо, що рівні анандаміду мозочка та 2-АГ залишались незмінними за будь-яких умов.
Рівні ендоканабіноїдів у лімбічному передньому мозку, гіпоталамусі та мозочку щурів щодо голодування, годування та насичення. Наведені дані щодо рівнів анандаміду (A) та 2-арахідоноїл-гліцерину (B), які виражаються як пмоль або нмоль відповідно на грам маси вологої тканини. Усі значення є середнім значенням ± с. Е. Середнє значення n = 4. * P ** P Рисунок 2) показав, що у наших щурів, що вільно харчуються, двостороння ін’єкція 2-AG у оболонку nucleus accumbens призвела до чіткої короткочасної стимулюючої дії на поведінку годування. Зокрема, ендоканабіноїд суттєво збільшив кількість з’їденої протягом першої години після введення (P Рисунок 2). Введення одного лише антагоніста не мало надійного впливу на і без того низький рівень споживання їжі на початковому рівні (дані не наведені). На відміну від впливу на споживання їжі, ніякого впливу на споживання води після лікування 2-AG не виявлено; тварини рідко займаються питтям під час будь-якого з тестів. Нарешті, слід зазначити, що, як видається, 2-AG не представляв якоїсь незвичної, неспецифічної поведінки, яка могла б пояснити збільшення споживання їжі.
Дозозалежне збільшення споживання їжі протягом однієї години після двосторонньої інфузії 2-арахідоноїл гліцерину оболонки. Всі значення є середнім значенням ± с. Е. Середнього значення для восьми щурів. ** P *** P †† P −1, s.c.).
На відміну від гіперфагічних ефектів, спричинених внутрішньоакумбенсом 2-AG, інфузія 2-AG у бічний шлуночок не могла здійснити жодного очевидного впливу на споживання їжі протягом будь-якого періоду вимірювання. Середні 1-годинний прийом після латерального шлуночкового введення 2-AG становив: носій = 2,84 ± 0,4 г; 0,125 мкг = 2,72 ± 0,57 г; 0,5 мкг = 2,05 ± 0,49 г; 2,0 мкг = 2,99 ± 0,8 г. Хоча базовий рівень споживання для цієї групи був відносно високим, малоймовірно, що стельові ефекти затуляли б гіперфагію 2-АГ. Дійсно, 1-годинний прийом після найефективнішої дози 2-AG внутрішньоакумбензу (0,5 мкг) значно перевищував вихідний рівень бічного шлуночка (Р 9-ТНС, який може викликати гіперфагію, а також сприяє вивільненню дофаміну всередині накопичувачів) (Tanda et al., 1997; Gardner & Vorel, 1998; Ameri, 1999) і значно стимулюють біосинтез анандаміду в передньому мозку лімбіки (di marzo et al., 2000).
Ми вже повідомляли в іншому, що периферично введені Δ 9-ТГК та анандамід активно провокують ситих тварин наближатися до їжі та починати годування (Williams & Kirkham, 2002b). Ми інтерпретували ці ефекти як доказ дії канабіноїдів для збільшення виокремленості чи стимулюючого значення харчових стимулів та збудження апетиту до їжі, аналогічно ефекту позбавлення їжі. Відповідно до цього твердження, мишей CB1 -/- з генетично порушеними рецепторами CB1 відрізняють від одноліток дикого типу зниженою гіперфагічною реакцією на голодування (di marzo et al., 2001), хоча, мабуть, відображають нормальний рівень споживання та масу тіла в умовах ad libitum. Ефективність 2-AG в оболонці акумбенсу також узгоджується із участю ендоканабіноїдів у стимулюванні апетиту. Як ми вже обговорювали раніше, існують вагомі докази інших парадигм щодо участі ендоканабіноїдів у стимулюючих/апетитних процесах. Таким чином, Галлате та його колеги виявили, що агоніст CB1, CP 55940, збільшував точки розриву у щурів, що вилизують розчини сахарози (тобто щури працювали б інтенсивніше, щоб отримати сахарозу), ефект, який був заблокований SR141716 (Gallate & McGregor, 1999 ).
На закінчення, ці дослідження показали чіткий зв'язок між ендогенною активністю канабіноїдів та мотивацією годування. Вони також показали, що ендоканабіноїд 2-AG може сильно стимулювати харчування. Загалом, ці висновки узгоджуються з попередніми звітами та посилюють роль ендоканабіноїдів у фізіологічній регуляції апетиту та маси тіла, потенційно завдяки діям на системи мозку, які опосередковують процеси стимулювання та винагороди.
- Оцінка впливу рамаданського голодування на мусульманських хворих на діабет у зв'язку з використанням
- Настанови щодо посту Різдва Швидкого 2019; Церква Всіх Святих
- Піст протягом 24 годин сонячного світла Рамадан в Полярному колі Mvslim
- Голодування в Рамадан не пов'язане з погіршенням хронічної хвороби нирок
- Піст є одним із п’яти стовпів ісламу