Рапаміцин погіршує індукований HPD сприятливий вплив на гомеостаз глюкози
Ген-Руей Чанг
1 кафедра ветеринарної медицини Національного університету Чунг Хсінг, Тайчжун, Тайвань
2 Відділ залишкового контролю, Інститут досліджень сільськогосподарських хімікатів та токсичних речовин, Рада сільського господарства, Тайчжун, Тайвань
І-Шін Чіу
1 кафедра ветеринарної медицини Національного університету Чунг Хсінг, Тайчжун, Тайвань
Інь-Інь Ву
1 кафедра ветеринарної медицини Національного університету Чунг Хсінг, Тайчжун, Тайвань
Ю-Чі Лінь
1 кафедра ветеринарної медицини Національного університету Чунг Хсінг, Тайчжун, Тайвань
По-Хсун Хоу
1 кафедра ветеринарної медицини Національного університету Чунг Хсінг, Тайчжун, Тайвань
3 Відділ психіатрії, Загальна лікарня ветеранів Тайчжун, Тайчжун, Тайвань
Френк Чіаунг Мао
1 кафедра ветеринарної медицини Національного університету Чунг Хсінг, Тайчжун, Тайвань
Пов’язані дані
Таблиця S1 Склад експериментальних дієт.
Таблиця S2 Вплив рапаміцину на масу тіла, метаболічні ефекти, рівень лептину в сироватці крові, масу органів та показники жирності печінки у худих мишей, які отримували протягом 35 днів носій або рапаміцин.
Анотація
Передумови та призначення
Також пропонується, щоб рапаміцин, який клінічно використовується для лікування відторгнення трансплантата, впливав на метаболічний синдром; однак існує дуже мало інформації про його вплив на худорлявих тварин/людей. Метою цього дослідження була подальша характеристика ефектів постійного використання рапаміцину на гомеостаз глюкози у худих мишей C57BL6/J.
Експериментальний підхід
Мишей годували високобілковою дієтою (HPD) протягом 12 тижнів, щоб розробити худу модель, а потім обробляли щодня рапаміцином протягом 5 тижнів, залишаючись на HPD. Параметри метаболізму, ендокринні профілі, тести на толерантність до глюкози, індекс чутливості до інсуліну, експресію транспортера глюкози GLUT4 та розподіл хрому вимірювали in vivo.
Ключові результати
Більш низький приріст маси тіла, а також зниження споживання калорій, жирових прокладки, показники жирності печінки, розмір адипоцитів та показники тесту на толерантність до глюкози спостерігались у мишей, що годувались HPD, порівняно з мишами, які харчувались жирною або стандартною дієтою. Незважаючи на ці сприятливі ефекти, худорляві миші, які отримували рапаміцин, демонстрували більшу непереносимість глюкози, знижену чутливість до інсуліну, меншу експресію м’язів GLUT4 та зміни рівня хрому в тканинах навіть при високому рівні інсуліну.
Висновки та наслідки
Наші висновки демонструють, що безперервне введення рапаміцину може призвести до розвитку синдрому діабету, оскільки було встановлено, що це викликає гіперглікемію та непереносимість глюкози на худих тваринних моделях.
Таблиці посилань
| Транспортери a | Ферменти b |
| КЛЮЧ4 | Акт (ПКБ) |
| mTOR | |
| S6K1 |
У цих таблицях перераховані ключові білкові мішені та ліганди в цій статті, які гіперпосилаються на відповідні записи в http://www.guidetopharmacology.org, загальному порталі даних з Інструкції IUPHAR/BPS з ФАРМАКОЛОГІЇ (Pawson et al., 2014) та постійно архівуються у Стислому посібнику з ФАРМАКОЛОГІЇ 2013/14 (a, b Alexander et al., 2013a, b).
Вступ
Цукровий діабет 2 типу є визнаним розладом перевантаження поживних речовин, який виникає у осіб із ожирінням, коли вивільнення інсуліну через дисфункціонуючі бета-клітини підшлункової залози не контролює рівень глюкози в крові у відповідь на резистентність до інсуліну (Kahn et al., 2006). Обмеження енергії, особливо більш ніж на 50% енергії у вигляді білка, є загальним і успішним альтернативним методом лікування ожиріння, який, як правило, ефективний для досягнення втрати маси тіла та запобігання подальшому виникненню діабету (St Jeor et al., 2001). Більше того, люди з діабетом 2 типу, які харчуються високобілковою дієтою (HPD), знизили рівень глюкози в крові після їжі та покращили загальний контроль глюкози (Gannon et al., 2003). Тим не менш, добавки з високим вмістом білка корелюють із сприянням загоєнню ран, захистом від шоку, недоїданням, контролем анемії, розвитком набряків та посиленням імунного захисту після операції та опікової травми (Spence et al., 1946).
Методи
Тварини та лікування наркотиками
Самці мишей C57BL/6J у віці 5 тижнів, отримані з Ресурсу досліджень освіти, Національний лабораторний центр тварин, Тайвань, використовувались відповідно до Керівних принципів по догляду та використанню лабораторних тварин за рекомендацією уряду Тайваню. Протокол для експериментальних мишей також був розглянутий та затверджений Інституційним комітетом з догляду та використання тварин (IACUC) Національного університету Чунг Хсінг (схвалення IACUC № 98-85). Всі дослідження за участю тварин повідомляються відповідно до рекомендацій ARRIVE для звітування про експерименти з тваринами (Kilkenny et al., 2010; McGrath et al., 2010). Всього в цих експериментах було використано 60 тварин. Тварин було вбито передозуванням анестетика, уретану (1,2 мг кг -1) комбінованого вуглекислого газу.
Експеримент I
Тварини були розділені на три групи для встановлення моделі худих тварин: (i) контрольна група: мишей годували стандартною дієтою (SD; дієта 5008, збагачена білками дієта, 49,4% вуглеводів; PMI Nutrition International, Brentwood, MO), США); (ii) група з високим вмістом жиру (HFD): мишей годували HFD (дієта 592Z, збагачена білками дієта та модифікована лабораторія з 35,5% сала; PMI Nutrition International Inc); (iii) Група HPD: мишей годували HPD (дієта 5787, дієта, збагачена білками, 60,0%, PMI Nutrition International Inc) (Довідкова інформаційна таблиця S1). Усі групи годувались довільно протягом 12 тижнів. Мишей розміщували індивідуально у стандартних пластикових клітках для гризунів у приміщеннях для тварин з контрольованою температурою (22 ± 1 ° C), вологістю (55 ± 5%) та циклом світло-темнота 12:12 год. Вагу тіла всіх мишей вимірювали протягом 12 тижнів, а потім аналізували.
Експеримент II
П’ятитижневих самців мишей C57BL/6J годували HPD протягом 12 тижнів для розвитку худорлявої тварини з нормальним рівнем глюкози, після нашого попереднього дослідження, описаного в експерименті I. Потім мишей випадковим чином розділили на дві групи у віці 17 тижнів. Одній групі мишей вводили i.p. рапаміцин (2 мг · кг -1 ваги тіла) один раз на день протягом 35 днів (миші, що харчуються HPD, лікуються рапаміцином; HPDR). Друга група мишей, контроль HPD, отримала відповідний об'єм носія (стерильний 10% PEG400/8% етанол, а потім рівний об'єм стерильного 10% Tween 80) (Eshleman et al., 2001; Chang et al., 2009а). Ця доза рапаміцину у мишей еквівалентна дозуванню 0,17 мг · кг -1 кг/день -1 для людини, коли нормалізується до площі тіла (Chodera and Feller, 1978; Chang et al., 2009b), щоб імітувати типову терапевтичну концентрацію в клінічних дослідженнях на людях (Saunders et al., 2001).
Вимірювання маси тіла, споживання їжі/калорій та концентрації гормонів
Вага тіла та споживання їжі мишами реєстрували та вимірювали щотижня. Щоб оцінити споживання їжі, споживання їжі оцінювали шляхом зважування їжі в кожному дозаторі клітини, включаючи їжу, яка пролилася на підлогу клітини. Крім того, наприкінці досліджуваного періоду тварин знеболювали та збирали різні тканини, а також сироватку для подальшого аналізу. Концентрації лептину та інсуліну в сироватці крові вимірювали за допомогою набору мишей лептину елізи та набору інсуліну елізи щурів (# 90030 та # INSKR020; Crystal Chem Inc, Downers Grove, IL, США).
Гістологічний та морфометричний аналіз тканин
Ми вимірювали ваги серця, печінки, селезінки, нирок, заочеревинної та епідидимальної жирових прокладки; визначається як відсоток від загальної маси тіла. Інфільтрація жиру в печінці була виявлена за допомогою фарбування гематоксиліном та еозином наступним чином: відсутність видимого жиру: оцінка 0; 50% жиру: оцінка 4 (Chang et al., 2009b).
Були отримані численні зрізи із заочеревинної та епідидимальної жирової тканини та систематично аналізовані щодо розміру та кількості адипоцитів. Фарбування зрізів проводили гематоксиліном та еозином. Для кожної проби аналізували щонайменше 10 полів (що представляють ∼100 адипоцитів) на предметне скло (Bluher et al., 2004). Зображення отримували за допомогою цифрового мікроскопа з високою роздільною здатністю (Moticam 2300, Motic Instruments, Канада), а розподіл розмірів адипоцитів аналізували за допомогою програмного забезпечення Motic Images Plus 2.0. Кореляцію розміру адипоцитів та його розподілу (%) визначали для контролю HFD, контролю HPD та мишей, оброблених рапаміцином, на HPD.
Тест на толерантність до глюкози
Наприкінці експерименту I, i.p. Тест на толерантність до глюкози (IPGTT) проводили у дозі 1 г · глюкози · кг -1 маси тіла у тварин, які голодували протягом ночі з вільним доступом до води. Рівні глюкози в крові визначали через 0, 30, 60 та 120 хв після в/в. ін'єкція глюкози. Протягом вищезазначеного експерименту рівень глюкози в крові вимірювали у крові, взятій з хвостової вени, у зазначені раніше моменти, за допомогою глюкометра One Touch ™ (LifeScan Inc, CA, США). Для вивчення толерантності до глюкози розраховували площу під кривою толерантності до глюкози (0–120 хв). Подібним чином, в експерименті II, після 28 днів лікування носієм або рапаміцином, також проводили ІПГТТ тваринам, яких годували HPD.
Вестерн-блот-аналіз
В кінці кожного експерименту тварин вбивали через передозування анестетика, а м’язи шлунково-кишкового тракту швидко видаляли, подрібнювали грубо, а потім негайно гомогенізували. Вестерн-блот проводили, як описано раніше (Chang et al., 2009b). Антитіла, що використовувались для вестерн-блот-аналізу, були наступними: анти-GLUT4, анти-фосфо-S6K (фосфотреонін 389-специфічний), анти-S6K та анти-актинові антитіла. Імунореактивні сигнали виявляли за допомогою посилених хемілюмінесцентних реагентів, а мембрани експонували на рентгенівських плівках. Кількісну оцінку експресії білка та фосфорилювання проводили на плівках із використанням програми NIH Scion image (Scion Corporation, Frederick, MD, USA).
Аналіз концентрацій хрому
Статистичний аналіз
Результати відображаються як середнє значення ± SEM. Відмінності між двома групами аналізували за допомогою t-критерію для порівняння. Тест anova, за яким слідував пост hoc тест Бонферроні, використовувався для визначення відмінностей, коли аналізували більше двох груп. Значення Р менше 0,05 вважалося значущим. Точний тест Фішера також використовувався для оцінки значущості даних на випадок непередбачених ситуацій.
Матеріали
Рапаміцин був із лабораторій LC (Woburn, MA, США). Анти-GLUT4, анти-фосфо-S6K, анти-S6K та анти-актинові антитіла були придбані у Cell Signaling Technology (Beverly, MA, USA). Посилені хемілюмінесцентні реагенти були від Pierce Chemical Co (Рокфорд, Іллінойс, США).
Результати
Вплив HPD на показники маси тіла, споживання їжі/калорій, ефективність харчування та рівень лептину в сироватці крові
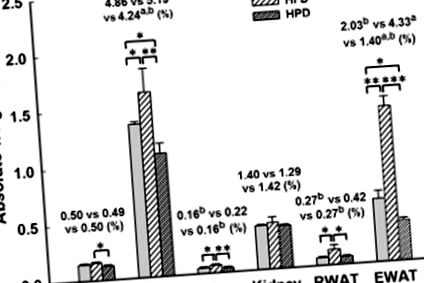
Ми годували самців мишей C57BL6/J SD, HFD або HPD протягом 12 тижнів. Різні споживання їжі призвели до різниці в метаболічних показниках у організмі та рівнях лептину в сироватці крові (рис. 1). Ваги мишей, що годувались HPD, через 12 тижнів були відповідно на 9 та 19% нижчі, ніж у мишей, які годували SDD та HFD, що показує статистично значущу різницю (рис. 1 А). Крім того, приріст маси тіла (мас. Мас. Тіла) значно зменшився у мишей, що годувались HPD, на 40 та 64%, відповідно, паралельно SD та HFD групі (рис. 1 B). Однак у мишей, що годувались HPD, було значно збільшено середньодобове споживання їжі (2,59 ± 0,06 проти 2,29 ± 0,04 г на день миші -1, відповідно P 1 C), але добове споживання калорій у групі HPD було зменшено (9,76 ± 0,22 проти 13,49 ± 0,24 ккал на день миші -1, відповідно P 1 D). Однак добове споживання їжі та добове споживання калорій у групі HPD були значно нижчими (P -1 їжа, відповідно P -1 їжа, P 1 E). Лептин бере участь у регулюванні споживання їжі. Миші, яких годували HPD, продемонстрували значне зменшення у 3,2 рази (P 1 F). Цей результат узгоджується з даними про споживання їжі. Крім того, рівень лептину у сироватці мишей, що годувались HPD, продемонстрував 1,7-кратне збільшення (P * P * * P * * * P 2). За винятком сердець, селезінки та нирок, вага печінки та епідидимальних жирових прокладки мишей, що харчуються HPD, також були значно нижчими, ніж у групи SD. Порівняно з групою HFD, ваги печінки, селезінки, RWAT та EWAT у мишей, що годувались HPD, були значно нижчими, на 18, 27, 36 та 68%, відповідно, коли нормалізувались за масою тіла (рис.2). Крім того, печінка та EWAT у відсотках до маси тіла у мишей, які отримували HPD, значно зменшились, на 13 та 31%, відповідно, порівняно з відповідними вагами групи SD. Однак не виявлено відмінностей для серця та нирок як відсотка маси тіла серед трьох груп.
Вплив дієти на абсолютну масу маси органу та білої жирової тканини, а також вага всіх органів і тканин, нормалізована на масу тіла (%) у мишей після 12 тижнів споживання ad libitum або SD (23,5% білка), HFD (16% білка) ) або HPD (60% білка). Усі значення наведені як середнє значення ± SEM, n = 10 для всіх груп. Статистично значущі при * P * * P * * * P a, b P 3 A). Цей висновок узгоджувався з меншою вагою жирових прокладок, що спостерігалася у тварин, що годувались HPD, порівняно з групами, що годували SD та HFD. Ці висновки вказують на те, що HPD запобігав накопиченню жиру в печінці, і це, можливо, зменшило гіпертрофію жирових прокладок. Крім того, для визначення впливу дієти на показники жирності печінки (рисунок 3 B), оцінювали розміри жирових клітин у RWAT (малюнок 3 C) та EWAT (малюнок 3 D). Ці результати вказують на те, що між трьома групами існували суттєві відмінності. Ми спостерігали 10-кратне та трикратне зменшення показника жирності печінки у мишей, що годувались HPD, порівняно з мишами, що годували HFD та SD. Рівні експресії для середнього розміру адипоцитів показали, що адипоцити у мишей, які годували HPD, були стабільно меншими порівняно з такими в групі, яка отримувала HFD, із середнім зменшенням розміру на 86 та 85% для ретроперитонеальних та епідидимальних жирових прокладок відповідно. Крім того, розміри адипоцитів у RWAT та EWAT у групі, яка отримує HPD, також були меншими, ніж у групі, що годували SD, із середнім зменшенням на 53 та 33% відповідно. Таким чином, HPD мав більший профілактичний ефект на гіпертрофію жирових клітин, ніж SD.
Мікрофотографії зразків (A) печінки, заочеревинної та епідидимальної білої жирової тканини, забарвлених гематоксиліном та еозином, (B) жирових балів печінки, (C) адипоцитарної клітинності RWAT та (D) адипоцитарної клітинності EWAT у мишей після 12 тижнів споживання до лібіту або SD (23,5% білка), HFD (16% білка) або HPD (60% білка). Усі значення наведені як середнє значення ± SEM, n = 9-11 для всіх груп. Всі мікрофотографії визначали як збільшення для гістологічного аналізу (× 400). Статистично значуще при * P * * P * * * P 4 A). Примітно, що толерантність до глюкози та рівень глюкози в крові через 0, 30, 60 та 120 хв були суттєво (P 4 B). Використовуючи критерій непереносимості глюкози як рівень глюкози в крові вище 900 мг · L −1 через 120 хв після в/в. ін'єкції глюкози, ми виявили, що значна частина мишей на HPD та SD виявляла нижчу непереносимість глюкози, ніж миші, що годували HFD (P 4 C). Концентрація інсуліну в сироватці крові показала значну різницю серед трьох груп. Миші, які годували HPD, мали нижчий рівень інсуліну, ніж ті, що годували HFD (P 4 D). Таким чином, миші, яких годували HPD, демонстрували нормальний гомеостаз глюкози з гіпоінсулінемією.
Вплив дієти на (A) тест на толерантність до глюкози: 1 г · кг -1 глюкози, (B) AUC протягом 120 хв після введення глюкози, (C) критерій непереносимості глюкози (точний тест Фішера) та (D) сироватковий інсулін рівні у мишей після 12 тижнів споживання ad libitum SD (23,5% білка), HFD (16% білка) або HPD (60% білка). Усі значення наведені як середнє значення ± SEM, n = 10 для всіх груп. * P * * P * * * P ### P 5 A). Введення рапаміцину призвело до значного (Р 5 В). Використовуючи критерій непереносимості глюкози як рівень глюкози в крові вище 900 мг · L −1 через 120 хв після в/в. ін'єкції глюкози, ми виявили, що значна частина мишей, які отримували лікування рапаміцином, виявляла непереносимість глюкози (P 5 C). Однак у мишей, які отримували рапаміцин, був вищий рівень інсуліну в сироватці крові (P 5 D). Таким чином, у худих мишей, які отримували рапаміцин, розвивалися симптоми діабету з гіперглікемією, гіперінсулінемією та непереносимістю глюкози.
Вплив рапаміцину на (A) тест на толерантність до глюкози: 1 г · кг -1 глюкози, (B) AUC протягом 120 хв після ін’єкції глюкози, (C) критерій непереносимості глюкози (точний тест Фішера) та (D) сироватковий інсулін рівні вимірювали у худих мишей, оброблених носієм або рапаміцином, протягом 35 днів. Усі значення наведені як середнє значення ± SEM, n = 12 для всіх груп. * P * * * P 6 A) та індекс чутливості до інсуліну (Рисунок 6 B) відповідно. Для подальшої характеристики засобів, за допомогою яких транспорт глюкози зменшується після інгібування mTOR, ми оцінили вплив рапаміцину на експресію транспортера глюкози. Порівняно з контрольною групою, лікування рапаміцином різко (P 389) застосовується як специфічний маркер активності mTOR, який патологічно характеризується при розвитку діабету (Dann et al., 2007; Chang et al., 2009b). Ми також виявили, що експресія GLUT4 у м'язах була значною (P 6 C).
Дані представлені як середнє значення ± SEM. Статистично значуще на
- Харчування та загоєння ран Огляд, зосереджуючи увагу на корисних ефектах куркуміну
- Ожиріння погіршує фертильність чоловіків через тривалий вплив на сперматогенез
- Мірицитрин виявляє антиатеросклеротичні та антигіперліпідемічні ефекти при дієті
- Сортування наслідків алкоголю для здоров’я - Гарвардський журнал охорони здоров’я - Гарвардське здоров’я
- Переваги кверцетину, побічні ефекти, дозування та взаємодія