Рандомізоване контрольоване втручання з риб’ячим жиром проти соняшникової олії віком від 9 до 18 місяців: вивчення змін у зростанні та товщині шкірних складок
Предмети
Анотація
Показано, що багатонасичені жирні кислоти n-3 (n-3 LCPUFA) з риб’ячого жиру (FO) у гризунів зменшують адипогенез. Докази впливу на масу жирової тканини у людини обмежені, і жодні дослідження спеціально не спрямовані на з’ясування цього у грудному віці. Щоб дослідити, чи впливає споживання n-3 LCPUFA на ріст жирової тканини, ми випадковим чином виділили 154 здорових немовлят на щоденне підживлення FO або соняшниковою олією (SO) у віці від 9 до 18 місяців та виміряли z-оцінка змін у різних антропометричних оцінках розмірів тіла та товщини шкірних складок та концентрації адипокіну в плазмі. Серед 133 немовлят, які завершили життя, еритроцит n-3 PUFA збільшився більше у тих, хто отримував FO, ніж у немовлят, які отримували SO [12,2 ± 0,7 (середнє значення ± SE) проти 2,0 ± 0,4 відсотка жирних кислот (FA%), стор
Малорухливий спосіб життя, який сприяє позитивному енергетичному балансу, як правило, визнається основною причиною збільшення поширеності ожиріння, але інші потенційні фактори, що сприяють цьому, також приділяють увагу. Серед них - дієтичні зміни споживання поліненасичених жирних кислот (ПНЖК) у бік вищого споживання n-6 та нижчого споживання n-3 ПНЖК, що пропонується як частковий пояснювальний фактор (1). Доведено, що дієтичний n-3 PUFA (LCPUFA) у гризунів запобігає індукованому ожирінням ожирінню (2), а також повідомляється, що він посилює зменшення маси жиру в двох рандомізованих дослідженнях втрати ваги у дорослих із надмірною вагою (3) та ожирінням. жінки з діабетом 2 типу (4).
Раннє життя - це період бурхливого зростання, що суттєво змінюється як у розмірах, так і в складі тіла. Добре встановлено, що докозагексаєнова кислота (DHA, 22: 6n-3) важлива для, напр., візуальний розвиток у грудному віці (5), але в даний час невідомо, наскільки n-3 LCPUFA слід вважати актуальним щодо ожиріння. Встановлено, що природний вміст ПНЖК n-3 у грудному молоці позитивно пов’язаний із збільшенням ваги новонароджених недоношених (6), але не народжених у термін (7). Крім того, два дослідження з втручанням, що дають n-3 LCPUFA вагітним та/або годуючим матерям, пропонують вплив на програмування ІМТ пізніших дітей, хоча і в протилежних напрямках (8,9). Однак жодних досліджень, на нашу думку, не було спеціально спрямовано на вивчення того, чи дієтичний n-3 LCPUFA у ранньому віці пов'язаний з розміром жирової маси як такі.
Натхнене чіткою знахідкою у гризунів, це дослідження було проведено з метою з’ясувати, чи пов’язані ріст та відкладення жиру у здорових немовлят Данії протягом періоду прикорму, віком 9–18 місяців, із споживанням їжі n-3 LCPUFA. Щоб забезпечити різницю в добовому споживанні в досліджуваній популяції, ми провели рандомізацію до щоденних добавок або риб'ячого жиру (FO, n-3 LCPUFA), або соняшникової олії (SO, n-6 PUFA). Через дослідницький характер цього дослідження ми цього не зробили апріорі мають якісь конкретні гіпотези, і, отже, низка різних заходів, пов’язаних із ростом та відкладенням жиру, була отримана до і після періоду дослідження. Крім того, ми дослідили, чи пов'язаний харчовий n-3 LCPUFA з плазмовими рівнями гормонів, що виробляються та секретуються адипоцитами, адипонектином та лептином.
ПРЕДМЕТИ І МЕТОДИ
Предмети та навчальний дизайн.
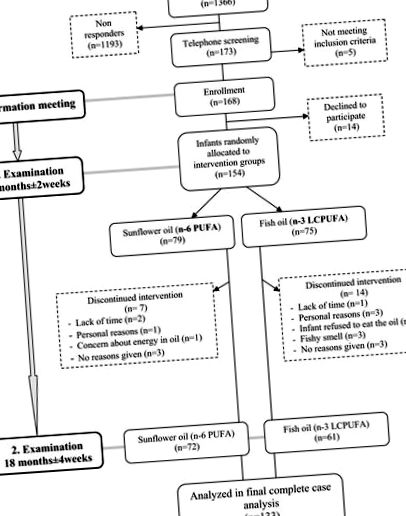
Блок-схема дослідження.
Дієтичне втручання, рандомізація та розподіл груп.
Втручання складалося з щоденної 5 мл олійної добавки віком від 9 до 18 місяців або FO [багата ейкозапентаеновою кислотою (20: 5n-3, EPA) і DHA, але без вітамінів] або SO [багата лінолевою кислотою, (18: 2n-6)] (ласкавий подарунок від Axellus A/S). Ми вибрали SO в якості контролю, оскільки ми хотіли дослідити специфічні ефекти n-3 PUFA. Призначена доза забезпечить немовлят групи FO 1,6 г/день EPA + DHA, а дітей групи SO 3,1 г/день лінолевої кислоти. Через додаткову енергію в добавках батькам було наказано замінити частину звичайного жиру в раціоні немовляти поставленим маслом і давати масла ложкою або змішувати з продуктами. В інструкції зазначено, що всі невідкриті пляшки слід зберігати в морозильній камері та охолоджувати після відкриття, щоб мінімізувати окислення жирних кислот.
Усі 154 зараховані немовлята мали однакову ймовірність розподілу до двох груп. Людина, яка не брала участі у дослідженні, склала список рандомізації шляхом рандомізованої комп'ютером рандомізації блоків із різними розмірами блоків 4, 6, 8 та 10 у випадковому порядку (www.randomization.com). Таким чином, ідентифікаційні номери 1–170 були присвоєні одній із двох груп втручання. Десять темних пластикових 150-мл пляшок, що містять інтервенційні масла, згодом були закодовані та марковані кожним ідентифікаційним номером. Слідчі, відповідальні за контакт з немовлятами та сім'ями, виділили наступний доступний номер зі списку під час наступного вступу в дослідження, а 10 флаконів з інтервенційною олією (достатньо для всього періоду втручання) були надані після базового обстеження. Слідчі завжди були засліплені для розподілу, і розклеювання проводилося лише після завершення аналізу даних. Список рандомізації зберігався у закритому конверті в сейфі кафедри.
Дотримання нафтового втручання.
Батьків попросили повернути всі 10 пляшок на огляді 18 місяців та повідомити про розлив олії та ін. Відповідність 131 із 133 немовлят, що виховуються, була оцінена з початкової ваги 10 повних пляшок та повернутих пляшок, включаючи залишки, плюс точна кількість днів, коли певний учасник був у дослідженні. Оцінка забезпеченої кількості ПНЖК із добавок була розрахована на основі середньої ваги% окремих жирних кислот, отриманих в результаті двох окремих аналізів жирних кислот інтервенційних масел. Крім того, відповідність оцінювали за складом PUFA еритроцитів (еритроцитів), біомаркером тривалого прийому PUFA (11), який визначали у учасників до та після втручання.
Результати дослідження.
Усі первинні аналізи являли собою повний аналіз випадків із залученням усіх учасників, яких випадковим чином розподілили до однієї з груп втручання та закінчили дослідження. Аналіз ANOVA показав значний вплив вихідного значення на зміну 9–18 міс як для антропометричних вимірювань, так і для плазмових концентрацій адипокінів. Таким чином, зміни як первинної, так і вторинної кінцевих точок аналізуються за допомогою ANCOVA, скоригованих на базові значення оцінюваного результату, а також аналіз коефіцієнта шкірних складок також коригується для статі. Всі моделі з z-оцінки визначаються за визначенням з урахуванням статі та точного віку. стор також були розраховані значення, скориговані на вихідний рівень, рівні IGF-1 у плазмі крові та грудне вигодовування, оскільки, як відомо, грудне вигодовування впливає на схему росту немовлят. Ці скориговані моделі також аналізували вплив кількості споживаної олії (відповідність). Значення лептину були перетворені в журнал перед усіма аналізами.
Аналіз відповіді дози на основі вмісту n-3 PUFA в еритроцитах проводили у немовлят з успішним забором крові як 9, так і 18 місяців (n = 115). Це було зроблено шляхом заміни „групи втручання” у моделях ANCOVA у повному обсязі з спостережуваними змінами еритроцитів n-3 PUFA, а також досліджено у двовимірних кореляціях. Нарешті, для отримання параметрів оцінок споживання олії на товщинах шкірних складок використовувались множинні лінійні регресії. Нормальність залишків усіх остаточних моделей підтверджена.
РЕЗУЛЬТАТИ
Учасників набирали з грудня 2007 року по травень 2008 року. Базові та результати експертизи проводились з січня по червень 2008 року та жовтня 2008 року по березень 2009 року, відповідно. У групі FO 14 немовлят покинули дослідження під час втручання та сім у групі SO. Повідомлялося, що половина тих, хто кинув навчання в групі FO, спричинена інтервенційним маслом, але різниці в швидкості стирання між групами не було.
Базові характеристики груп були подібними (табл. 1). Групових відмінностей у ІМТ батьків не було [24,4 ± 2,7 (середнє значення ± SD) проти 24,6 ± 2,7 кг/м 2 у групах FO та SO відповідно] або ІМТ матері (23,1 ± 3,4 проти 23,5 ± 3,6 кг/м 2 відповідно), а їхній освітній рівень також був подібним у групах (дані не наведені).
У немовлят середнє споживання олії в інтервенті становило 3,8 (3,2–4,2) г/день, і хоча в абсолютних кількостях група FO споживала трохи менше, ніж група SO (таблиця 2), це не було статистично значущим (стор = 0,17). Виходячи із середньої маси тіла на 18 міс (11,5 кг в обох групах), добавки забезпечували близько 3,5% середньої оціненої потреби немовлят у енергії. Розрахункові щоденні споживання конкретних жирних кислот із добавок представлені в таблиці 2. Оскільки приблизно 41% FO складався з n-3 LCPUFA (34% EPA + DHA) і 67% SO SO, доданий n- 3 ПНЖК становили 1,4% від загального споживання енергії (Е%) у групі FO, тоді як доданий ПНЖК n-6 становив 2,4 Е% у групі SO.
Зміни жирнокислотного складу еритроцитів немовляти.
Невелика різниця у споживанні ПНЖК через 9 місяців не відображалася на еритроцитах у немовлят, де група СО мала дещо більший вміст ПНЖК (стор = 0,06). Передбачувана різниця в споживанні може бути пов’язана з невизначеністю в Данському банку даних про харчовий склад. Вміст еритроцитів n-3 PUFA збільшувався під час втручання в обох групах, але значно більше у немовлят із доповненням ФО порівняно із вмістом у групі SO (табл. 4). Орієнтовна середня різниця у зміні вмісту еритроцитів у загальній кількості ПНЖК n-3 становила 10,16 (95% ДІ; 8,63–11,69) FA%, а зміна еритроцитів у групі FO добре корелювала зі споживанням нафти (р = 0,6, стор Таблиця 4 Склад жирних кислот еритроцитів немовлят у учасників, яким призначено споживати риб’ячий жир або соняшникову олію щодня з 9 до 18 місяців
Результати дослідження.
Плазмові концентрації лептину та адипонектину.
У віці 9 місяців концентрація лептину в плазмі корелювала з ІМТ (р = 0,6, стор Таблиця 6 Концентрація адипонектину та лептину в плазмі до та після втручання у немовлят, щоденно підживлюється або риб'ячим жиром, або соняшниковою олією у віці від 9 до 18 місяців
ОБГОВОРЕННЯ
Жоден із виміряних адипокінів не був пов’язаний з нашим втручанням. На відміну від цього, було показано, що збільшення в їжі n-3 LCPUFA збільшує концентрацію циркулюючого адипонектину у дорослих (20) і знижує рівень циркуляції лептину у гризунів (2). Рівні адипонектину в плазмі крові у 9 місяцях у нашому дослідженні були подібними до рівня, про який повідомляли інші (21), але залишались у тій же концентрації від 9 до 18 місяців. Відповідно до спостережень у дорослих (22), ми виявили, що рівні лептину в плазмі позитивно корелювали з ІМТ як 9, так і 18 місяців, і подібні результати також повідомляли інші (21,23).
- Рандомізоване контрольоване дослідження для оцінки теорії самовизначення щодо дотримання фізичних вправ та
- Тако з рибними тако в азіатському стилі з в’яленим капустяним салатом Хайнен; s Продуктовий магазин
- ЧОРНЕНИЙ РИБНИЙ ТАКОС; Немає виправдань Харчування
- Надутий гузовий гупі - Питання про годування та голодування хвороби прісноводних риб та риб
- 10 Виставкові основні страви з риби