Псоріаз: Ожиріння та жирні кислоти
Анотація
Псоріаз - це хронічне запальне захворювання шкіри, що вражає шкіру, суглоби, серцево-судинну систему, мозок та метаболізм. Патогенез псоріазу опосередкований складною взаємодією імунної системи, медіаторів запалення різних шляхів, наприклад, TNF-альфа та IL-23/IL-17 шляхів, локусів сприйнятливості до псоріазу, аутоантигенів та багатьох факторів навколишнього середовища. Псоріаз викликається поєднанням генетичних факторів та факторів навколишнього середовища. Новим фактором екологічного ризику, що має все більше значення, є ожиріння. Кілька досліджень довели, що ожиріння є незалежним фактором ризику виникнення та тяжкості псоріазу. Завдяки різкому збільшенню ожиріння у всьому світі цей міні-огляд зосереджується на ожирінні як основному факторі екологічного ризику псоріазу та механізмах загострення псоріазу, спричиненого ожирінням.
Вступ
Псоріаз - це полігенне хронічне запальне захворювання шкіри (1–3). Значна частина (20–30%) хворих на псоріаз страждає від додаткового ураження суглобів, що вражає головним чином дистальні відділи кінцівок, а також більші суглоби (3). Псоріаз типу нальоту, найпоширеніший варіант захворювання, який спостерігається у
У 85% випадків зазвичай проявляється матово-червоними, еритематозними, лускатими бляшками, особливо на розгинальних поверхнях ліктів, колін та шкіри голови. До менш поширених підтипів псоріазу належать пустульозний, гутатовий, зворотний, еритродермічний та долонно-підошовний псоріаз (4).
Псоріаз має значний генетичний фон, що показано підвищеним ризиком розвитку захворювання у нащадків та братів та сестер хворих на псоріаз та сімейних явищ (5, 6). Генетичні асоціації вульгарного псоріазу в основному були описані для основного локусу комплексу гістосумісності (MHC) на хромосомі 6, що несе гени людського лейкоцитарного антигену (HLA) та інших імунорегуляторних генів, таких як фактори комплементу та TNF-α (6). Найбільш сильна асоціація спостерігалась для алелю HLA-C Cw6, класичного алелю класу HLA класу I, який був виявлений у 46% хворих на псоріаз, але лише у 7% контрольної популяції (7). Подальші дослідження загальногеномних зв’язків методом мікросателітного аналізу надали подальший набір можливих геномних областей, пов’язаних із псоріазом, таким як локус PSORS1 та іншими локусами, не пов’язаними з MHC, такими як локуси PSORS2-5 (8). Нещодавно проведені дослідження, пов’язані з геномною асоціацією (GWAS) щодо псоріазу вульгаріс, виявили кілька додаткових факторів ризику псоріазу, які включають гени, пов’язані з хронічним запаленням, включаючи IL12B (9, 10), IL23A та IL23R (9), IL2/IL21 (7) TNFAIP3 і TNIP1 (9), ZNF313 (11), а також епідермальні/антимікробні гени, такі як SLC12A8 і HBD (ген β-дефензину людини) (12), а також кластер генів LCE (пізня мозолена оболонка) (10).
На відміну від вульгарного псоріазу, пустульозний псоріаз демонструє генетичні асоціації з мутаціями гена IL36RN з найсильнішою асоціацією для генералізованого пустульозного псоріазу та слабшою асоціацією для дощово-підошовного пустульозу та продовження акродерматиту Hallopeau (13). Пальмоплантарний пустульоз виявляє вищу поширеність серед жінок та курців. Гутатовий псоріаз пов’язаний з факторами зовнішнього середовища, такими як стрес та інфекції, але досі не було визначено чіткого генетичного походження. Різні патогенні механізми можуть також впливати на відповідь на лікування, наприклад, гутатний псоріаз менш реагує на лікування антитілами до TNF, ніж псоріаз типу нальоту (14).
В даний час псоріаз розглядається як аутоімунне захворювання, оскільки воно має багато особливостей з іншими аутоімунними захворюваннями, такими як хронізація клінічних симптомів та хронічне запалення, залучення TNF-α та генетичний фон із накладанням генних локусів на інші аутоімунні захворювання ( 15, 16). Потенційні аутоантигени, такі як кератин 17 з послідовністю гомологій до стрептококових М-білків, антимікробний пептид LL37 та меланоцитарний аутоантиген ADAMTSL5, були виявлені нещодавно. LL37 та ADAMTSL5 розпізнаються Т-клітинами після зв’язування з HLA-C * 06:02, підкреслюючи роль різних генотипів HLA у патогенезі псоріазу (17–19).
Центральними патогенними типами клітин при псоріазі є епідермальні кератиноцити, антигенпрезентаційні клітини та запальні Т-клітини зі складними механізмами зворотного зв’язку (1, 2, 20–22).
Роль IL-23 як головного регулятора при псоріазі була підкреслена індукцією псоріазоподібного набряку вух, епідермальної гіперплазії та акантозу при введенні IL-23 у вуха миші, що залежало від IL17- та IL-22 (27, 28). Ці висновки підтвердили роль IL-23, IL-17 та IL-22 при псоріазі. Роль цих цитокінів у патогенезі псоріазу ще більше підкреслюється використовуваними в даний час високоефективними методами лікування псоріазу та псоріазного артриту з використанням антитіл, спрямованих проти TNF-α, IL-23p19 та IL-17 (4, 29, 30). Аналіз закономірностей експресії генів у шкірі псоріазу при ураженні біологічними препаратами показав, що закономірності експресії генів IL-23- та IL-17-індукованих генів дійсно зменшувались обробкою анти-IL-12/23 антитілом у загоєнні шкіри ураження (31).
Шкідливий запальний процес при псоріазі не обмежується шкірою. Неконтрольована запальна реакція сприяє ряду супутніх захворювань при псоріазі, включаючи кардіометаболічні захворювання, інсульт та метаболічний синдром (ожиріння, гіпертонія, дисліпідемія та діабет) (32–36).
Як правило, псоріаз викликається поєднанням генетичних факторів та факторів навколишнього середовища. Прийнято вважати, що взаємодія між екологічними та генетичними факторами сприяє появі, розвитку та клінічним симптомам псоріазу. Значна кількість досліджень визначила ультрафіолет, наркотики, куріння, алкоголь та інфекції, а також психічний та біомеханічний стрес як фактори екологічного ризику, що впливають на псоріаз, втручаючись у його генетичну схильність та імунну відповідь (37).
Новим фактором ризику псоріазу, що має високе соціально-економічне значення, є ожиріння. Кілька досліджень показали, що ожиріння є незалежним фактором ризику виникнення та тяжкості псоріазу (38, 39). Завдяки різкому збільшенню ожиріння у всьому світі, цей міні-огляд зосереджується на ожирінні як одному з факторів ризику навколишнього середовища для псоріазу та механізмах загострення псоріазу, спричиненого ожирінням.
Псоріаз та ожиріння
Захворюваність на псоріаз серед дорослих майже подвоїлася між 1970-ми та 2000 роками (40). Оскільки генетична основа не повинна суттєво змінюватися, фактори навколишнього середовища, включаючи західний спосіб життя, могли зіграти свою роль у зростанні поширеності (41). Дієтичні звички в індустріальних країнах часто підтримують дієти з високим вмістом жиру, високим вмістом солі та високим вмістом цукру з надмірним споживанням калорій, що призводить до ожиріння та метаболічного синдрому (42). У сучасному великому популяційному норвезькому дослідженні, яке охоплює близько 35 000 суб'єктів, було описано зв'язок метаболічного синдрому з підвищеним ризиком розвитку псоріазу. Аналіз метаболічних факторів показав, що ожиріння є центральним фактором у цій асоціації (43). Про подібні висновки повідомляли інші [оглянуто в (38, 39)]. Важко показати, що перше, псоріаз або ожиріння. Виражена соціальна ізоляція, погані харчові звички, депресія, збільшення споживання алкоголю та зниження фізичної активності у хворих на псоріаз можуть пояснити, як псоріаз може призвести до ожиріння (38).
Оскільки жирова тканина є важливим ендокринним органом, що секретує розчинні фактори, що беруть участь у запаленні та імунітеті, існує припущення, що розширення жирової тканини та секреція прозапальних медіаторів може погіршити псоріаз. Високий рівень резистину та лептину був виявлений у хворих на псоріаз із ожирінням (39). Недавній мета-аналіз показав, що у хворих на псоріаз рівень лептину вищий у порівнянні з особами без псоріазу (49).
Крім того, ожиріння змінює клітинний склад та активність запальних клітин шкіри. Nakamizo та його співробітники описали накопичення γδ Т-клітин, що продукують IL-17A, у псоріатичних ураженнях шкіри, спричинених дієтою (HFD), індукованих мишами з ожирінням, що призвело до загострення псоріатичного дерматиту (50). Більше того, генетично сконструйовані діабетичні (db/db) миші продемонстрували посилене псоріатичне запалення шкіри з підвищеним рівнем IL-17A та IL-22 (51). Інше дослідження показало, що тривалий HFD протягом 9 місяців сприяв накопиченню специфічних CD11c + макрофагів у шкірі залежно від епідермального зв’язуючого білка жирних кислот (E-FABP) (52). У вишуканих дослідженнях Христос та його колеги показали, що західна дієта (ВД) викликає тривалий тренований імунітет у мієлоїдних клітинах. Автори викликали системне запалення у мишей Ldlr -/- шляхом годування WD, яке вщухло після переведення мишей на дієту чау. Індукований WD тривалий транскриптомічний та епігеномний перепрограмування клітин-попередників мієлоїдів, що призводить до збільшення проліферації та вроджених імунних відповідей (53).
Іншим важливим аспектом є той факт, що ожиріння та харчування впливають на мікробіом (54, 55). Нещодавно було показано, що мікробіом, що позначає цілі мікроорганізми, що мешкають на зовнішній і внутрішній поверхнях тіла людини, робить сильний вплив на аутоімунні захворювання людини (56). Уже є певні докази того, що це може бути і при псоріазі (57). Роль мікробіому для метаболічних процесів також підкреслювалася в останніх експериментальних дослідженнях (58). Цікаво, що існує кореляція між мікробіомом та продукцією IL-17 при аутоімунних захворюваннях (59–61). Зміни мікробіому кишечника при псоріазі стосуються зменшення рівня Bacteroidetes із збільшенням роду Faecalibacterium. Було припущено, що бактерії викидають свої компоненти клітинної стінки, такі як ліпополісахарид та ліпотейхоєва кислота, у кровотік, підтримуючи тим самим хронічний запальний стан. В цьому напрямку було показано, що пробіотичні речовини впливають на аутоімунні захворювання, такі як хвороба Крона, виразковий коліт та ревматоїдний артрит, але до цих пір не перевірені на їх вплив на псоріаз (62).
Псоріаз і жирні кислоти
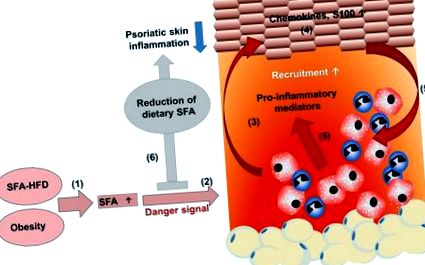
SFA, що походять від HFD, посилюють псоріатичне запалення. (1) Дієта, багата насиченими жирними кислотами (СФА), підвищує концентрацію СФА в сироватці крові. (2) Хронічне споживання дієти з високим вмістом жиру збільшує жирову тканину, що призводить до ожиріння з високим рівнем SFA в сироватці крові. (2) SFA сенсибілізують мієлоїдні клітини, що призводить до посиленої прозапальної реакції з посиленою секрецією прозапальних медіаторів за наявності сигналу небезпеки. (3) Посилена активація мієлоїдних клітин сприяє порушенню проліферації, диференціації та (4) посилює вироблення хемокінів та білків S100. (5) Отже, більше мієлоїдних імунних клітин набирається в пошкодження шкіри і активізується, додатково посилюючи псоріатичне запалення шкіри. (6) Зменшення дієтичного вмісту SFA зменшує псоріатичне запалення шкіри, що може підтримати ефективність лікування у хворих на псоріаз.
Через обмежені докази сприятливого впливу риб’ячого жиру на псоріаз, добавки риб’ячого жиру не рекомендуються для лікування псоріазу (47). Дані нашого дослідження можуть пояснити невдачу прийому ПНЖК як терапевтичного заходу при псоріазі (66–69). Здається, зменшення SFA є більш ефективним, ніж добавки PUFA. В даний час обмеження калорій рекомендується хворим із псоріазом із надмірною вагою та ожирінням. Майбутні клінічні випробування повинні перевірити, чи уточнення цієї рекомендації - зменшення SFA як допоміжної дієтичної міри - може підтримати звичайну протизапальну терапію.
Жирні кислоти та запалення
PPAR - це спеціалізовані рецептори, що виявляють похідні FFA сигнальні молекули. Втрата PPAR-γ зменшує біосинтез de novo sterol і збільшує продукцію IFN-β, що, у свою чергу, пригнічує транскрипцію IL-1α та IL-1β у LPS-стимульованих макрофагах (80). Поглинання SFA призводить до посиленого вироблення кераміду, який, у свою чергу, активує PKC-ζ та MAPK, що призводить до збільшення секреції IL-6 та IL-8 при стимуляції LPS (79).
Підвищений рівень FFA, спричинений HFD або ожирінням, активує запалення NLRP3 у макрофагах, що призводить до збільшення секреції IL-1β та IL-18 (78). За наявності сигналів небезпеки SFA індукують активацію запалення шляхом індукції мітохондріально активних форм кисню або стимулюванням AMP-активованої протеїнкінази, аутофагії або залежних від лізосом та кальциневрину шляхів (70, 78). Надмірне поглинання SFA індукує внутрішньоклітинну кристалізацію SFA, що призводить до активації запалення NLRP3 та подальшого вивільнення IL-1β через лізосомну дисфункцію (81).
Взяті разом, SFA можуть посилити прозапальну реакцію за допомогою прямих та непрямих дій (рис. 2). Таким чином, обмеження дієтичних SFA може бути корисним для придушення псоріатичного запалення.
Регуляція прозапальної реакції при псоріазі. (Ліворуч половина фігури) Ожиріння та дієта з високим вмістом жиру (HFD) збільшують концентрацію насичених жирних кислот (SFA). SFA здатні безпосередньо стимулювати експресію прозапальних цитокінів. SFA активують платоподібні рецептори (TLR) і зв'язуються з цитоплазматичними епідермальними білками, що зв'язують жирні кислоти (E-FABP), активуючи рецептор ретиноїдної кислоти (RAR) і стимулюють диференціацію CD11c + макрофагів (MØ). Збільшення SFA модулює синтез цераміду. (Правильно половина фігури) SFA підсилюють прозапальну реакцію за наявності сигналу небезпеки. SFA стимулюють експресію прозапальних цитокінів шляхом зв’язування з PPAR, активацією запалення та модуляцією синтезу кераміду. До цього часу не ясно, які рецептори беруть участь у зв’язуванні FFA, транслокації в клітину та подальшій протизапальній активності.
Висновки
Псоріаз - це хронічне запальне захворювання шкіри, яке опосередковується складною взаємодією між імунними клітинами та клітинами-резидентами. Генетичні та екологічні фактори сприяють патогенезу псоріазу. Екологічні фактори, такі як ожиріння та харчування, мають важливий вплив на виникнення та тяжкість псоріазу. Недавні дослідження показують, що дієтичні SFA, здається, є ключовими підсилювачами псоріатичного запалення, і припускають, що обмеження SFA може бути корисним як для худих, так і для пацієнтів із ожирінням. Клінічна значимість повинна бути доведена в майбутніх клінічних випробуваннях для покращення реакцій на лікування псоріазу та супутніх захворювань.
Внески автора
А.С. і М.К. написали рукопис. Дж. С. редагував і обговорював рукопис.
Заява про конфлікт інтересів
MK отримав гранти на подорожі від UCB Pharma та є членом дорадчих рад Novartis Pharma та LEO Pharma. JS отримав нагороди спікерів та є членом дорадчих рад Novartis Pharma, Janssen Pharma, UCB Pharma та AbbVie Pharma, а також отримав гранти на подорожі від цих компаній та від LEO Pharma. Автор, що залишився, заявляє, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які могли б трактуватися як потенційний конфлікт інтересів.
Подяка
Автори відзначають підтримку Німецького дослідницького фонду (DFG), PsoNet Leipzig, Deutsche Psoriasisbund та Universität Leipzig в рамках програми Open Publishing.
- Мікробіом, жовчні кислоти та ожиріння Як мікробно модифіковані метаболіти формують протипухлинний імунітет
- Мононенасичені жирні кислоти при дієті з високим вмістом жиру та ніацин захищають від дисфункції білого жиру в
- Ооцити жінок із ожирінням мають нижчий рівень технологічних мереж жирних кислот Омега-3
- Статус зайвої ваги перед вагітністю та ожиріння як фактори ризику кесаревого розтину
- Сільські райони сприяють збільшенню глобального ожиріння - Scientific American