Простий метод визначення випаровування та компенсації втрат рідини в дрібних системах культури клітин
Вінсент Вігманн
1 Поглиблений центр біохімічної інженерії, Департамент біохімічної інженерії, Університетський коледж Лондона, Торрінгтон-Плейс, Лондон, WC1E 7JE UK
Крістіна Берналь Мартінес
2 Applikon-Biotechnology BV, Heertjeslaan 2, 2629 JG Delft, Нідерланди
Френк Баганц
1 Поглиблений центр біохімічної інженерії, Департамент біохімічної інженерії, Університетський коледж Лондона, Торрінгтон-Плейс, Лондон, WC1E 7JE UK
Анотація
Завдання
Встановити метод непрямого вимірювання випаровування в системах культури клітин на основі мікрозвернень та показати, що запропонований метод дозволяє компенсувати втрати рідини в періодичних процесах подачі.
Результати
Виявлено кореляцію між випаровуванням та концентрацією Na + (R 2 = 0,95) при використанні мініатюрної системи біореакторів на основі 24 лунок (мікро-матриця) для періодичної культури з GS-CHO. На основі цих результатів було розроблено метод протидії випаровуванню з періодичними додаваннями води на основі вимірювань концентрації Na +. Впровадження цього методу призвело до зменшення відносних втрат рідини через 15 днів вирощування з періодичною подачею періодично з 36,7 ± 6,7% без об'ємних поправок до 6,9 ± 6,5% з об'ємними поправками.
Висновок
Була встановлена процедура побічного вимірювання випаровування за допомогою кореляції з рівнем іонів Na + у розчині та виведення простої формули для обліку втрат рідини.
Вступ
Біотехнологічні процеси зазвичай протікають при підвищеній температурі, і, як результат, повітря в системі, як правило, має високу вологість, що, в свою чергу, може призвести до високого вмісту рідини у відхідних газах. У міру того, як пара виходить із системи через газовідвід, об’єм заповнення культиваційного судини поступово зменшуватиметься. Ці зміни обсягу не тільки безпосередньо впливають на умови роботи, випаровування може також негативно впливати на процес через концентраційні ефекти та високий осмотичний тиск, що призводить до обмежень у рості клітин (Silk et al. 2010; Bareither and Pollard 2011; Lattermann and Büchs 2016 ).
Незважаючи на те, що закриття свердловин зменшує випаровування, невідповідність швидкостей випаровування залишається проблемою для систем з аеруванням, зокрема мікробіореакторів, де нерівномірний тиск газу призводить до розбіжностей у швидкості випаровування (Chen et al. 2009). У цих системах швидкість випаровування регулюється швидкістю потоку газу, на яку в свою чергу можуть впливати умови культури. Особливо під час тривалих експериментів з культурою клітин стає необхідним компенсувати випаровувану рідину шляхом періодичного додавання стерильної дистильованої води, щоб забезпечити постійні умови протягом усього експерименту. У форматах на основі мікропланшетів, випаровування на лунку зазвичай визначають із загальної втрати ваги пластини (Betts et al., 2014). Однак цей метод передбачає, що швидкість випаровування однакова у всіх свердловинах, що потенційно може призвести до сильно мінливих робочих обсягів та умов культивування. Вимірювання концентраційного ефекту одного або декількох компонентів середовища може бути використано як життєздатну альтернативу, яка менш інвазивна і легко проводиться поряд з аналізом зразка.
У цій роботі проводиться оцінка придатності трьох потенційних електролітів для використання в якості маркерів випаровування та пропонується недорогий метод опосередкованого вимірювання випаровування в дрібних компартментах клітинних культур. Цей новий метод продемонстровано в рамках зразкового експерименту з періодичною подачею з клітинами СНО, вирощеними в мікробіореакторі micro-Matrix.
Матеріали і методи
Докультура
Флакони IgG, що експресують промислову клітинну лінію GS-CHO (Лонза, Великобританія), розморожували і розбавляли 49 мл підігрітого CD-CHO (Life-Technologies, Великобританія), що містить 25 мкМ MSX. Потім клітини розширювали протягом 7 днів у струшувальній колбі з вентиляційним ковпачком (номінальний об’єм 250 мл, Corning Life Sciences, США), встановленому на орбітальному шейкері (Сарторіус, Великобританія) при 37 ° C, 5% СО2 та 70% вологість.
мікро-матриця
Мікро-матриця (Applikon-Biotechnology B.V, Нідерланди) - це мікробіореакторна платформа, яка дозволяє проводити 24 паралельних культивації з індивідуальним контролем рН, розчиненого кисню (DO) та температури. Культивування проводять в одноразовій 24-лунковій касеті з оптимальним робочим об'ємом від 2 до 5 мл.
процедура мікрокулькової клітини культури
Значення зміщення для калібрування зонда рН визначали заповненням кожної лунки касети micro-Matrix 2 мл 1 × PBS (Life-Technologies, Великобританія) та встановленням касети на систему micro-Matrix. Потім зонди залишали для рівноваги без будь-якого струшування або подальшого додавання газів. Через 1 год з кожної лунки витягували по 1 мл і вимірювали рН за допомогою автономного рН-метра (Mettler Toledo, Швейцарія). Потім значення зміщення коригувались таким чином, щоб вимірювання в режимі он-лайн відповідали значенням у режимі офлайн.
Суспензію з кінцевою концентрацією 3 × 105 життєздатних клітин мл -1 готували із застосуванням відповідної кількості середовища CD-CHO. 3,5 мл цієї суспензії заповнювали в кожну лунку касети з квадратною ямою площею 24 глибини (Аплікон, Нідерланди). Касета micro-Matrix була покрита верхньою пластиною, підключена до ліній подачі газу, а потім затиснута на оптичному тепловому модулі (OTM) мікро-матриці. Встановлені значення задавали при pH 7,2, 30% DO та 37 ° C. Зниження рівня рН було досягнуто з додаванням CO2; DO контролювали за допомогою додавання O2 та N2. Швидкість струшування встановлювалася як 220, так і 250 об/хв. PH і DO вимірювали через 10 с з використанням оптичних датчиків, розташованих на дні кожної лунки. Температуру свердловини контролювали для кожної свердловини за допомогою елементів Пельтьє, також розташованих на дні кожної свердловини.
Протокол пакетної подачі
Підживлення розпочали на 3 день вирощування, а потім повторювали кожні два дні. Болюсні добавки Efficient Feed B (Life-Technologies, Великобританія) були встановлені на рівні 10% об./Об. Від початкового робочого обсягу. Крім того, суспензію клітин додавали бікарбонатним буфером (250 мМ Na2HCO3 та 250 мМ NaH2CO3), встановленому на рівні 2,5% об./Об. формування.
Відбір проб та аналіз
Для періодичної культури три лунки відбивали в кожен пробний день. Клітинна суспензія всередині цих лунок була повністю видалена і зважена для того, щоб визначити об'ємні втрати внаслідок випаровування. Всі параметри, що залежать від об'єму, були виправлені на втрату об'єму. У випадку з періодичною культурою з кожної лунки відбирали обсяги проб від 350 до 500 мкл під час відбору проб. Точний обсяг залежить від аналізів, які проводяться в певний день (табл. 1). Концентрацію клітин визначали за допомогою Vi-CELL XR (Beckman Coulter, Великобританія), а залишок клітинної суспензії центрифугували при 1000 × g протягом 5 хв. Аналізатор Bioprofile FLEX (Nova Biomedical, США) був використаний для визначення рівнів усіх відповідних поживних речовин, метаболітів та електролітів. Кількісне визначення IgG4 проводили з використанням високоефективної рідинної хроматографії (ВЕРХ) Agilent 1200 (Agilent Technologies, UK) з колоною HP HP 1 мл HiTrap Protein G (GE Healthcare, Великобританія).
Таблиця 1
Тип проведених аналізів та їх відповідні обсяги вибірки
| Кількість клітин | Vi-CELL XR | 50 | 10 |
| Поживні речовини та метаболіти | Біопрофіль FLEX | 166 | 3 |
| Гази та електроліти | Біопрофіль FLEX | 166 | 3 |
| Титр | Agilent 1200 | 50 | 2 |
Результати і обговорення
Оцінка різних маркерів випаровування
У початковому періодичному експерименті оцінювали концентрації Na +, K + та Ca 2+ як потенційні маркери випаровування. Вибір саме цього набору електролітів був зумовлений вимірювальними можливостями наявного біоаналізатора. Крім того, ключовим є те, що обраний електроліт має профіль концентрації, який, як правило, не залежить від клітинного росту і потрапляє в діапазон відповідних концентрацій для біоаналізатора для забезпечення точних вимірювань.
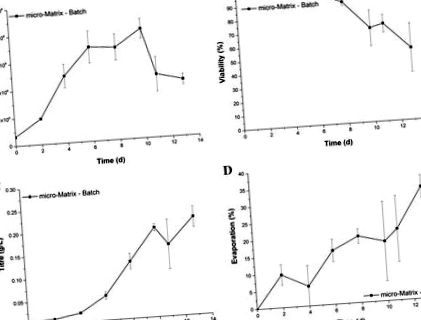
Кінетика росту та виробництва в мікро-матриці, показана на рис. 1, відповідає результатам попередніх досліджень із використанням клітинної лінії GS-CHO у подібному форматі (Silk et al. 2010) і, отже, дає типову періодичну культуру. І навпаки, втрати рідини на початку процесу перевищували прийнятий діапазон. Найвищий ступінь випаровування відповідає вимірюванню кінцевої точки на 13 день із втратою рідини 32,9 ± 3,4%. Крім того, широкі смуги похибок вказують на те, що випаровування піддається значній мірі мінливості.
Профіль зростання (a), життєздатність (b), титр (c), а також втрати рідини при випаровуванні (d) клітин GS-CHO, вирощених як періодична культура в мікро-матриці при швидкості струшування 220 об/хв, робочому обсязі 3,5 мл та активному контролі температури (37 ° C), DO (30%) та рН ( 7.2). Смужки помилок представляють одне стандартне відхилення щодо середнього значення (n = 3)
На малюнку 2 показані відносні втрати рідини з відповідними концентраціями електроліту в різні моменти часу протягом періоду культивування партії. Лінійність кореляції як для K +, так і для Na + свідчить про те, що їх концентрації залишаються або мінімально позначеними, або повністю не зазнають впливу клітинного росту цієї специфічної клітинної лінії. Кореляція між електролітом та випаровуванням незначно краща для Na + (R 2 = 0,95) порівняно з K + (R 2 = 0,92). Кореляція менш чітка (R 2 = 0,45) у випадку Ca 2+; результати більш розкидані через те, що ріст клітин впливає на концентрацію Ca 2+, або через те, що рівень концентрації занадто наближений до нижньої межі діапазону вимірювань приладу (0,1 ммоль L -1). Оскільки трохи покращений R 2 і рівні концентрацій знаходяться в межах діапазону вимірювань (40–220 ммоль L -1), Na + був обраний маркером для випаровування.
Концентрація електролітів Na + (a), K + (b) і Ca 2+ (c) в залежності від відносного випаровування (заповнений квадрат), відповідні лінійні кореляції (лінія) під час періодичного посіву з клітинами GS-CHO, вирощеними в мікро-матриці. Швидкість струшування встановлювали на 220 об/хв при робочому обсязі 3,5 мл. DO контролювали на рівні 30%, а рН - 7,2. Na +: y = 0,56 · x - 60,4, R 2 = 0,95; K +: y = 6,94 · x - 55,6, R 2 = 0,92; Са 2+: 42,9 · х + 2,1, R 2 = 0,45. Смужки помилок представляють одне стандартне відхилення щодо середнього значення (n = 3)
На основі цих висновків можна встановити просту кореляцію між концентрацією натрію та випаровуванням (рівняння 1).
де VEvap - об'єм випаровуваної рідини, V0 - початковий об'єм рідини, [Na] 0 - початкова концентрація іонів натрію, а [Na] t - концентрація натрію в момент часу t.
У разі вигодовування періодичної культури або для врахування додавання інших рідин, таких як кислота або основа, бажану концентрацію натрію в рідині слід скоригувати, виходячи з концентрації натрію в живильному середовищі та обсягу живильного середовища. що додається до суспензії клітин. Для системи, що містить три компоненти - базальне середовище, буфер та живильне середовище, випаровування можна розрахувати за допомогою рівняння. (2).
де Vtotal - теоретичний об'єм усередині культиваційної камери в момент часу t.
Вибір електролітів значною мірою визначався можливостями вимірювання наявного обладнання. Звичайні біоаналізатори, що використовуються в промислових умовах, часто обмежуються кількома вибраними аналітами. Хоча інші іони можуть дати більш точні оцінки втрат рідини, орієнтація на ті, які підтримуються загальновживаним обладнанням, надає більш практичний підхід, який може бути реалізований без додаткових витрат.
Застосування компенсації за випаровування в контексті вирощування з періодичною подачею
На сьогоднішній день партія поданих речовин досі є найкращим режимом роботи в промислових виробничих процесах з клітинами CHO (Pan et al. 2017). За своєю природою підгодівля продовжує тривалість вирощування, що потенційно може спричинити вищий загальний випар у порівнянні зі звичайними періодичними вирощуваннями. Як результат, описаний спосіб протидії випаровуванню був протестований в контексті операції з подачею.
На малюнку 3 узагальнено результати двох прогонів періодичної подачі, виконаних у мікро-матриці. При пробігу 1 корекції обсягу не проводились, при прогоні 2 процедуру повторювали кожні 2 дні, починаючи з 5-го дня і далі.
Профіль зростання (a, d), життєздатність (b, e) та титр (c, f) клітин GS-CHO, вирощених як культивована партія в мікро-матриці при швидкості струшування 280 об/хв, робочому обсязі 3 мл та активному контролі температури (37 ° C), DO (30%) та рН (7,2). У запуску 1 (a-c) компенсація за випаровування не проводилась, тоді як пробіг 2 (d-f) був підданий цій процедурі п'ять разів. Стрілки вказують часові точки додавання dH2O для протидії випаровуванню на основі вимірюваного рівня натрію
Спочатку обидві культури прогресували подібним чином, перш ніж відмінності стали очевидними на пізніх стадіях процесу. Починаючи з 7-го дня, життєздатна щільність клітин демонструвала вищу мінливість для лунок без корекції об’єму (середня КВ 15,5%) порівняно з лунками, в яких випаровувана рідина неодноразово замінювалась (середня КВ 9,5%). Пікова щільність життєздатних клітин становила від 12,01 × 10 6 до 14,86 × 10 6 клітин мл −1 для лунок з корекцією об’єму та 11,75 × 10 6 –15,47 × 10 6 клітин мл −1, коли втрати рідини не протидіяли. Відповідно, кінетика виробництва продемонструвала подібне збільшення поширення з кінцевими титрами в межах від 0,62 до 0,71 г L -1 з корекціями обсягу та від 0,53 до 0,89 г L -1 без корекції обсягу. Крім того, без компенсації втрат рідини життєздатність клітин передчасно знизилася у більшості лунок.
На малюнку 4 узагальнено втрати рідини та осмоляльність у кожній лунці в кінці обох дослідів. Завдяки багаторазовим корекціям обсягу втрати рідини можуть бути істотно зменшені з 36,7 ± 6,7 до 6,9 ± 6,5%. В одному випадку (свердловина В1) втрати рідини були дещо перекомпенсовані, що призвело до негативного значення. Як наслідок надмірного випаровування, кінцеві осмоляльності культур також суттєво відрізнялись в обох умовах. Без об'ємних корекцій спостерігались середні значення 273,8 ± 13,1 мОсмоль, тоді як в середньому 430,4 ± 31,2 мОсмоль було досягнуто без додавання води.
Кінцеві значення відносних втрат рідини (a) та осмоляльність (b) через 15 днів двох періодичних культивувань із клітинами GS-CHO, вирощеними в мікро-матриці. При пробігу 1 компенсація за випаровування не проводилась, тоді як пробіг 2 піддавався цій процедурі п'ять разів. Швидкість струшування для обох циклів була встановлена на 280 об/хв, робочий об'єм становив 3 мл, температура регулювалася при 37 ° C, DO при 30% і pH при 7,2
Висновок
Концентрація іонів Na + може бути використана як маркер для випаровування в культурах клітин із застосуванням GS-CHO. Використовуючи концентрацію іонів Na + для опосередкованого вимірювання втрат рідини, відносні втрати рідини через 15 днів вирощування періодичним способом скорочувались приблизно на 30% порівняно з культурами без корекції обсягу. Було показано, що втрата рідини збільшує кінцеву осмоляльність майже на 60%. Незважаючи на те, що кінетика росту дотримувалася подібної тенденції, відсутність корекції обсягу призвела до збільшення мінливості (CV> 15%) та більш раннього настання клітинної загибелі. Як підвищена мінливість, так і зміна культурного середовища в лунках без корекції обсягу в процесі культивування роблять вагомі аргументи для реалізації описаного методу.
Оскільки багато поширених біоаналізаторів здатні вимірювати концентрацію натрію, додаткові витрати для здійснення цієї процедури не потрібні. Крім того, інші електроліти можуть бути використані для визначення випаровування, якщо вимірювання іонів Na + неможливо.
Подяка
Ця робота була підтримана Британською науково-дослідною радою з питань інженерних та фізичних наук (EPSRC) Промисловим докторським навчальним центром (IDTC) з питань керівництва біопроцесом (EP/G034656/1). VW також хотів би подякувати Applikon Biotechnology за додаткову фінансову підтримку його студентства EngD.
Дотримання етичних норм
Конфлікт інтересів
Автори заявляють, що у них немає конфлікту інтересів.
- Метод Tracer для визначення надзвичайно низьких норм зносу поліетилену надвисокої молекулярної маси
- Простий спосіб інгібування корозії вуглецевої сталі розплавленою нітратною сіллю для
- Симптоми анемії Ознаки низького рівня еритроцитів
- Дослідження клітин раку молочної залози проливає нове світло на гомеопатію - цілісну первинну медичну допомогу
- 10 акторів, які майже померли через інтенсивний акторський спосіб