Прогнозування та маніпулювання інактивацією серцевих препаратів бактерією кишечника людини Eggerthella lenta +
Генрі Дж. Хайзер
1 Факультет мистецтв і наук (FAS) Центр системної біології, Гарвардський університет, Кембридж, Массачусетс, 02138
Девід Б. Гутенберг
1 Факультет мистецтв і наук (FAS) Центр системної біології, Гарвардський університет, Кембридж, Массачусетс, 02138
Келлі Чатмен
1 Факультет мистецтв і наук (FAS) Центр системної біології, Гарвардський університет, Кембридж, Массачусетс, 02138
Гопал Сірасані
2 Кафедра хімії та хімічної біології Гарвардського університету, Кембридж, Массачусетс 02138
Емілі П. Балскус
2 Кафедра хімії та хімічної біології Гарвардського університету, Кембридж, Массачусетс 02138
Пітер Дж. Тернбо
1 Факультет мистецтв і наук (FAS) Центр системної біології, Гарвардський університет, Кембридж, Массачусетс, 02138
Пов’язані дані
Анотація
Незважаючи на численні приклади впливу мікробіому шлунково-кишкового тракту людини на ефективність та токсичність лікарських засобів, часто існує неповне розуміння основних механізмів. Тут ми розбираємо інактивацію серцевого препарату дигоксину кишечником Actinobacterium Eggerthella lenta. Транскрипційне профілювання, порівняльна геноміка та аналізи на основі культури виявили оперон, що кодує цитохром, регульований дигоксином, інгібується аргініном, відсутній у неметаболізуючих штамах E. lenta, і передбачає інактивацію дигоксину мікробіомом кишечника людини. Фармакокінетичні дослідження з використанням гнотобіотичних мишей показали, що харчовий білок зменшує мікробний метаболізм дигоксину in vivo зі значними змінами концентрації лікарського засобу в сироватці та сечі. Ці результати підкреслюють важливість розгляду фармакології з точки зору як людського, так і мікробного геномів.
Основний текст
Люди є домом для великих і різноманітних мікробних спільнот, найпоширеніша з яких мешкає в шлунково-кишковому тракті. Недавні дослідження висвітлили клінічну важливість біотрансформацій, що каталізуються мікробіомом кишечника людини, включаючи зміни біодоступності, активності та токсичності терапевтичних препаратів (1, 2). Хоча> 40 препаратів метаболізується мікробіомом кишечника, мало що відомо про основні механізми. Ці знання є критично важливими, щоб забезпечити раціональний дизайн фармацевтичних або дієтичних втручань.
Інактивація серцевого препарату дигоксину забезпечує перспективну вихідну точку для розуміння мікробного метаболізму лікарських засобів. Дигоксин та інші серцеві глікозиди широко застосовуються протягом сотень років для лікування серцевої недостатності та аритмій. Терапевтичні ефекти досягаються опосередковано, коли інгібування Na +/K + АТФази в серцевих міоцитах підвищує внутрішньоклітинну концентрацію Са 2+ (3). Дігоксин має вузький терапевтичний діапазон (0,5–2,0 нг/мл) (3), і деякі пацієнти виділяють неактивний метаболіт дигоксину, дигідродігоксин, у якого лактонове кільце відновлюється (рис. S1A) (4). Ця модифікація порушує площинність кільця, що, як вважають, зміщує позиціонування в кишені зв'язування Na +/K + ATP-ази, що призводить до зниження спорідненості цілі (5). Одночасне застосування антибіотиків широкого спектру збільшує дигоксин у сироватці крові (4), а Eggerthella lenta зменшує дигоксин in vitro (6). До цієї роботи молекулярний механізм відновлення дигоксину та фактори, що змінюють інактивацію мікробного препарату in vivo, були невідомі.
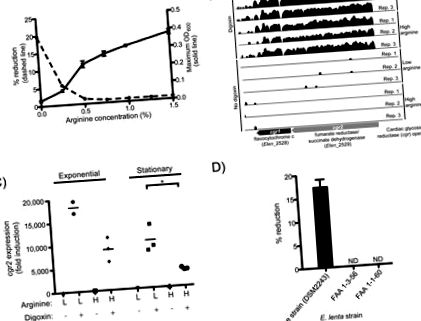
Ми підтвердили, що E. lenta DSM2243, тип штаму, зменшує дигоксин in vitro (7), і що аргінін пригнічує цю реакцію (рис. 1А). Зростання E. lenta DSM2243 стимулювався добавкою аргініну (рис. 1А, S2), що свідчить про використання шляху дигідролази аргініну для АТФ (8). Цитрулін (проміжний продукт до виробництва АТФ) стимулював ріст, тоді як орнітин (кінцевий продукт) - ні (рис. S2, S3).
(А) Аргінін стимулює ріст E. lenta DSM2243 in vitro, одночасно блокуючи зниження дигоксину. Максимум OD600 (суцільна лінія; значення є середнім значенням ± sem; n = 3) та ефективність зниження% дигоксину (пунктирна лінія; значення є середнім значенням; n = 2) через 48 годин росту. (B) Профілі RNA-Seq оперону серцевої глікозид-едуктази (cgr) показані з/без дигоксину під час експоненціального росту в середовищі, що містить низький/високий аргінін. Висота пропорційна натуральному журналу кількості однозначних зчитувань послідовності, відображених на кожній основі. (C) транскрипція cgr2, визначена за допомогою qRT-PCR. Зірочки позначають статистичну значимість за допомогою критерію t Стьюдента (P 100-кратний; рис. 1B, таблиці S2, S3). Ці два гени, звані тут опероном серцевої глікозид-едуктази (cgr) (мітки генів: cgr1 та cgr2), кодують білки, гомологічні бактеріальним цитохромам і, отже, потенційно здатні використовувати дигоксин як альтернативний акцептор електронів. Інкубація E. lenta з кількома серцевими глікозидами та їх відновленими формами показала, що cgr оперон в цілому реагує на сполуки з α, β-ненасиченим бутиролактоновим кільцем (рис. S7–9, таблиця S5).
Індукція дигоксину була збільшена в умовах низького рівня аргініну як під час експоненціальної, так і стаціонарної фази, порівняно з культурами, що зазнали високого рівня аргініну (рис. S10A, B). індукцію цгр дигоксином та залежні від фази росту дії аргініну підтверджені на незалежних зразках за допомогою qRT-ПЛР (рис. 1С, S7C, таблиця S4). На відміну від аргініну, орнітин не пригнічував експресію cgr2 (рис. S11). Ці результати узгоджуються з гіпотезою про те, що аргінін пригнічує експресію cgr оперону, тим самим інгібуючи відновлення дигоксину.
Далі ми протестували три штами E. lenta (DSM2243, FAA 1-3-56 та FAA 1-1-60) (9, 10) для відновлення дигоксину; тип штаму був єдиним штамом, здатним зменшувати дигоксин in vitro (рис. 1D). Порівняльна геноміка показала, що тип штаму майже не відрізнявся від інших двох штамів за допомогою загальних маркерних генів (рис. S12). Взаємне порівняння BLASTP усіх послідовностей, що кодують білок, з трьох повністю секвенсованих штамів E. lenta показало, що цей тип спільно використовував 79,4% та 90,5% свого протеома зі штамами FAA 1-3-56 та FAA 1-1-60 відповідно ( рис. S12). Оперон cgr був унікальним для штаму типу (таблиця S6); крім того, у двох нередукуючих штамів E. lenta бракувало трьох геномних локусів, які також регулювались за допомогою дигоксину, і передбачається, що вони кодують мембранні транспортери для поглинання малих молекул та глікозидів (рис. S13). Аргінін не суттєво знизив рівень експресії цих транспортерів (рис. S14).
Зараз з’являється розширена модель фармакокінетики дигоксину: колонізація окремими штамами E. lenta, мікробні взаємодії та дієта господаря діють разом на вплив ліків (рис. S19). Необхідні подальші дослідження у серцевих пацієнтів, щоб визначити, чи можуть швидкі оцінки біомаркерів на основі qPCR мікробіому кишечника керувати режимами дозування. Також може бути можливо надати дієтичні рекомендації або добавки, що запобігають мікробному метаболізму ліків. Більш широко, наші результати підкреслюють, що всеосяжний погляд на фармакологію включає структуру та діяльність наших резидентних мікробних спільнот, а також більш глибоке розуміння їх взаємодії між собою, середовищем існування господаря та харчовим середовищем шлунково-кишкового тракту.
Додатковий матеріал
Подяки
Богдан Будник та Суня Траугер для аналізу РХ/МС; Володимир Єлісєєв, Аліса Ліу та Рейчел Кармоді для досліджень на мишах; Клер Рірдон та Крістіан Дейлі за підтримку секвенування; Корін Моріс, Лоуренс Девід, Рейчел Даттон, Бен Вулф, Джулі Баттон, Марі Елліот, Ів Фаланга, Річард Лосік, Ендрю Мюррей та Бодо Стерн за корисні обговорення. Експерименти на мишах проводились за великої підтримки Гарвардського центру травних хвороб та ядер гнотобіотиків Університету Північної Кароліни. Цю роботу підтримали гранти Національного інституту охорони здоров’я (P50 GM068763) та Гарвардського центру травних захворювань (2P30DK034854-26). HJH підтримується Канадськими Інститутами Досліджень Здоров'я (MFE-112991). Дані RNA-Seq зберігаються в базі даних Gene Expression Omnibus (GEO) (приєднання> GSE43919).
- Вибачте тут вегани; s Як їжа м’яса зробила нас людським часом
- Ожиріння прискорює старіння печінки людини; Боротьба зі старінням!
- Росія захищає права людини та вибухи на Заході; подвійні стаднарди; Світові новини
- Введення жіночих комарів на дієтичні препарати людини може зменшити поширення хвороб - ScienceDaily
- Ожиріння та залежність Природа Поведінка людини