Профілактичні ефекти та механізми часнику на дисліпідемію та дисбіоз мікробіомів кишечника
Кей Чен
Кун Се
Чжуїн Лю
Ясусі Накасоне
Кодзуе Сакао
Пані Амзад Хоссейн
3 Сільськогосподарський факультет, Університет Рюкюса, Окінава, 903-0213, Японія
Де-Сін Хоу
4 Сільськогосподарський факультет Університету Кагосіми, Кагосіма 890-0065, Японія
Анотація
1. Вступ
Часник (Allium sativum L.) здавна використовується як у кулінарних, так і в лікувальних цілях багатьма культурами. Виходячи зі свіжої ваги, часник містить воду (62–68%), вуглеводи (26–30%), білки (1,5–2,1%), амінокислоти (1,0–0,5%), сполуки сірки (1,1–3,5%) та клітковина (1,5%). Вуглеводи - це найпоширеніший клас сполук, що містяться в цибулинах часнику, і на них припадає близько 77% сухої маси. Більшість вуглеводів у часнику складаються з розчинних у воді полімерів фруктози, які називаються фруктанами [1], що становить приблизно 65% сухої маси [2]. Фруктани часнику - це полімеризовані полісахариди з високою молекулярною масою, починаючи від l-цистеїнів (G-SAC), які гідролізуються та окислюються з отриманням сульфоксидів S-аліл-l-цистеїну (алліїну) під час зберігання [11]. Подрібнення, подрібнення чи жування часнику вивільняє алііназу, яка каталізує алліїн до аліцину та інших тіосульфатів [12]. Вважається, що алліцин відповідає за більшу частину фармакологічної активності подрібнених сирих зубчиків часнику [13]. Вважається, що ці ОСК є біоактивними принципами для численних переваг для здоров’я [14], особливо для захисних компонентів із широкою антимікробною активністю.
Кишкові мікроби відіграють важливу роль у підтримці здорового організму [15]. Доведено, що дієтичні добавки з рисовими висівками та темно-синіми бобами [16], поліфенолами дендробію [17] та прополісом [18] впливають на склад та активність мікробіоти кишечника [19]. Харчування з високим вмістом жиру (HFD) модулює склад мікробіому кишечника, зменшуючи поширеність певних бактерій, що захищають кишковий бар’єр, і збільшуючи поширеність умовно-патогенних мікроорганізмів, які можуть вивільняти вільні антигени, такі як ліпополісахариди. Цей дисбаланс може бути пов'язаний з вищою проникністю кишечника, що призводить до вищих рівнів ендотоксину та факторів запалення у плазмі крові та, зрештою, до розвитку метаболічних порушень [20,21].
Складні інгредієнти часнику, мабуть, мають парадоксальні результати щодо мікробіому кишечника. Експерименти з відокремленими сполуками показали, що фруктани працюють як пребіотики для мікробіому кишечника [22], тоді як OSC часнику, такі як аліцин, тіосульфінати та аджоен, діють як антибактеріальні засоби [23,24]. Тому необхідно з’ясувати вплив споживання цілого часнику в повсякденному житті на мікробіом кишечника. У цьому дослідженні ми використовували модель миші з нормальним харчуванням (НД) та ВЧС, щоб дослідити вплив та механізми цільного часнику на мікробіом кишечника. Декстрин використовували як позитивний контроль, оскільки декстрин є полісахаридом [25], подібним до фруктану, і може стимулювати ріст пробіотичних штамів, таких як Actinobacteria і Bacteroidetes [26], та зменшення кількості патогенних бактерій [27].
2. Матеріали та методи
2.1. Хімічні речовини та реактиви
Часник збирали з поля ґрунту в префектурі Аоморі, Японія. Після сушіння на гарячому повітрі (вміст вологи 60%) часник зберігали при -2 ° C протягом 10 місяців, а потім подрібнювали у вигляді подрібненого часнику сирого порошку (вміст вологи 4,8%). Кількості OSC та фруктану у часниковому порошку визначали за допомогою ВЕРХ або набору для аналізу фруктану (Biocon Ltd., Нагоя, Японія) відповідно (Додаток A, Таблиця A1).
Неперетравлюваний декстрин отримували із природного кукурудзяного крохмалю з 95% декстрину та 5% води. Олія сало отримували з фірми Sigma-Aldrich Japan (Токіо, Японія). Склад поживних речовин дієт наведено в Додатку А, таблиці А2. ND містив 21% білка, 6% жиру, 54% вуглеводів, 4% целюлози та приблизно 370 ккал/100 г калорій. HFD містив 21% білка, 40% жиру, 10% вуглеводів, 4% целюлози та приблизно 570 ккал/100 г калорій.
2.2. Модель миші
Експериментальний протокол на тваринах був складений відповідно до керівних принципів Комітету з догляду та використання тварин Університету Кагосіми (Дозвіл № A12005). Самці мишей C57BL/6N (віком 5 тижнів) від Japan SLC Inc. (Сідзуока, Японія) розміщувались окремо в клітках з підстилкою з деревної стружки під контрольованим освітленням (12-годинне світло/дні) та температурою (25 ° C), і вільний доступ до води та кормів. Масу тіла мишей зважували раз на тиждень. Після акліматизації протягом 7 днів (вік 6 тижнів) мишей випадковим чином поділяли на шість груп (n = 5) і годували ND, NDG (5% часнику в ND), NDD (4% декстрину в ND), HFD, HFDG (5% часнику в HFD) або HFDD (4% декстрину в HFD). Після 12 тижневого годування (віком 18 тижнів) мишей забивали після нічного голодування. Свіжий кал збирали на початку (вік 6 тижнів) і в кінці експерименту (вік 18 тижнів) для дослідження мікробіома кишечника, пов’язаного з різним віком або дієтою.
2.3. Вимірювання біохімічних показників сироватки крові
Сироватки крові отримували з очних яблук мишей і збирали їх у пробірку з коагулянтом (сепарабельні мікропробірки, FUCHIGAMI, 170720, Кіото, Японія) протягом 30 хв при кімнатній температурі для правильної коагуляції; їх збирали центрифугуванням при 3000 об/хв протягом 5 хв і зберігали при - 80 ° C до використання. Рівні глутаміно-оксалооцтової трансамінази (GOT), глутаміно-піровиноградної трансамінази (GPT), гамма-глутаміл-трансферази (GGT), загального холестерину (T-Cho), загального триацилгліцерину (TG), ліпопротеїдів високої щільності (HDL-c) ), а глюкозу вимірювали за допомогою автоматизованого аналізатора клінічної хімії (SPOTCHEM EZ SP-4430, Arkray, Кіото, Японія). Рівень ЛПНЩ (ліпопротеїдів низької щільності) розраховували за допомогою рівняння Фрідевальда (ЛПНЩ = T-Cho - HDL-c - TG/5) [28]. Концентрацію інсуліну в сироватці крові вимірювали за допомогою набору ELISA (Thermo Fisher Scientific Inc., Рокфорд, Іллінойс, США) відповідно до інструкцій виробника. Індекс оцінки гомеостатичної моделі на інсулінорезистентність (HOMA-IR) розраховували з функцією глюкози натще × інсуліну натще/405 [29].
2.4. Гістоморфологія
Тканину клубової кишки мишей розрізали за допомогою системи заморожування мікротомів (Ямато, Сайтама, Японія) відповідно до інструкцій виробника. Потім отриманий зріз (7 мкм) фарбували фарбуванням гематоксилін-еозином (H&E) і спостерігали під флуоресцентним мікроскопом (Keyence, Токіо, Японія).
2.5. Аналізи органічної кислоти цекалів
Сліду кишку та вміст сліпої кишки ізолювали та зважували. Кожну 0,3 г проби вмісту сліпої кишки переносили в 0,6 мл дистильованої води і витримували на льоду протягом 10 хв після додавання 0,09 мл 12% пероксидної кислоти. Надосадову рідину фільтрували після центрифугування з 15000 × g при 4 ° C протягом 10 хв, а потім використовували для аналізу органічної кислоти з використанням високоефективної рідинної хроматографії, що виключає іони, за допомогою насоса LC-10AD (Shimadzu, Кіото, Японія) та вимірювача електропровідності (Waters431, Кіото, Японія). Ідентифікація компонентів проводилася за допомогою модуля даних CBM-20A (Shimadzu, Кіото, Японія) [30].
2.6. Характеристика мікробіому кишечника шляхом секвенування генів 16S рРНК
Фекалії мишей збирали у мишей, розміщених у різних клітках у віці 6 та 18 тижнів, і зберігали при -80 ° C до використання. Геномну ДНК калу витягували за допомогою спінового набору Fast DNA для фекалій (MP BIOMEDICALS) згідно з інструкціями виробника та використовували для аналізу складу бактеріальних спільнот кишечника шляхом секвенування генів 16S рРНК, як описано в нашій попередній роботі [31].
2.7. Статистичний аналіз
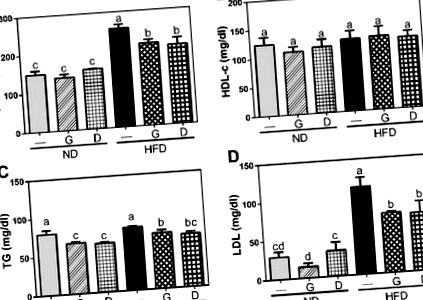
Результати були виражені як середнє значення ± SD або медіана та діапазон. Всі дані спочатку оцінювали за допомогою тесту Шапіро-Вілка для оцінки нормальності розподілу. Дані, що задовольняють нормальності, були додатково оцінені за допомогою тесту Левена на рівні дисперсії для перевірки рівності дисперсій між популяціями або рівнями факторів. Дані однакових дисперсій аналізували за допомогою одностороннього аналізу дисперсійного тесту (ANOVA), після чого проводили багаторазові тести Дункана зі статистичною програмою SPSS (версія 19.0, IBM Corp., Armonk, NY, США). Імовірність p Рисунок 1), хоча протягом 12-тижневого періоду втручання не було різниці у початковій масі тіла та щоденному споживанні їжі. Добавки часнику не мали суттєвого впливу на масу тіла як у групах ND, так і у HFD, тоді як добавки декстрином збільшували масу тіла в групі ND. Більше того, рівні GOT та GPT у сироватці крові були значно підвищені (p Рисунок 2) у групі HFD, і вони були значно знижені (p Рисунок 3). Більше того, концентрація інсуліну в сироватці крові також була збільшена у групі з ВЧС і зменшена за рахунок добавок часнику (p Рисунок 4). Хоча не було суттєвої різниці в рівні глюкози в сироватці між усіма групами, співвідношення HOMA-IR, показника резистентності до інсуліну, було суттєво підвищеним у групі HFD, а потім воно було зменшене за допомогою добавок часнику (p Рис. Декстрин як контроль полісахаридів виявив подібний ефект на ці маркери. Ці дані вказували на те, що добавки часнику послаблювали дисліпідемію, спричинену HFD.
Вплив добавок часнику на рівень ліпідних профілів у сироватці крові, включаючи загальний холестерин (T-Cho) (A), холестерин ліпопротеїнів високої щільності (HDL-c) (B), загальний триацилгліцерин (TG) (C.) та ліпопротеїдів низької щільності (ЛПНЩ) (D). Дані представляють середнє значення ± SD п'яти мишей для кожної групи. Колонки з різними літерами суттєво відрізняються (p Рисунок 5, HFD зменшив співвідношення висоти ворсин/глибини склепу порівняно з ND (p Рисунок 6 A). Для подальшого з'ясування впливу на концентрацію органічних кислот в цеці ми виміряли короткі -жирних жирних кислот (SCFA) та жирних кислот з розгалуженим ланцюгом (BCFA). Результати показали, що BCFA, включаючи ізо-масляну кислоту, були збільшені в групі HFD і зменшені за допомогою добавок часнику або декстрину. Оцтова кислота, пропіонова кислота, n-масляна кислота, бурштинова кислота, молочна кислота та мурашина кислота є SCFAs. З них концентрації бутиратної кислоти та ацетатної кислоти були підвищені в групі HFD та ослаблені добавками часнику або декстрину. Ці дані вказували на те, що добавки часнику можуть послаблюють як пошкодження морфології тонкого кишечника, спричинені ВЧР, так і вищі концентрації ізомасляної кислоти, н-бутиратної кислоти та ацетатної кислоти, викликані ВЧР.
Морфологія кінцевої клубової кишки (A) і відношення висоти ворсинок до глибини склепу (B). Значення представлені у вигляді середніх значень ± SD 16 гістоморфологічних точок кожної групи. Колонки з різними літерами суттєво відрізняються (p Рисунок 7 вказував, що добавка часнику збільшила значення Chao1 (A), спостережувані види (B), показник цілого дерева філогенетичного різноманіття (PD) (C) та значення Шеннона (D) з 6 до 12 тижнів як у групах ND, так і у HFD. Як контрольний полісахарид декстрин знижував усі ці чотири значення в групі HFD.
Вплив добавок часнику на мікробіом кишечника. Багатство мікробіому кишечника, оцінене за допомогою аналізів α-різноманітності, використовуючи значення Chao1A), спостережуваний видовий індекс (B), PD індекс цілого дерева (C.) та індекс Шеннона (D). Дані представляють медіану та діапазон значень десяти альфа-розріджень. Видовий склад мікробіомів кишечника оцінювали за допомогою аналізу β-різноманітності, використовуючи аналіз основних координат (PCoA) незважених матриць відстані UniFrac, який показано в PC1 проти PC2 (Е) та PC2 проти PC3 (F). Кожна крапка в (E) та (F) відображає початок (6 тижнів) або кінцеву точку (18 тижнів) експерименту для кожної групи (n = 8).
Крім того, ми використовували ділянки основного координатного аналізу (PCoA) (β-різноманітність: різноманіття середовищ існування) на основі незважених матриць відстані UniFrac, щоб дослідити схожість у структурі мікрофлори кишечника між різними групами. Відсоток мінливості набору даних, що пояснюється кожною основною координатою, відображається в заголовках осі (ПК1: 15,79%, ПК2: 11,60%, ПК3: 7,56%). PC1 і PC2 були двома головними компонентами координат. PC1 являє собою головний координатний компонент, який може якомога більше пояснити зміни даних; PC2 являє собою основний координатний компонент, на який припадає найбільша частка решти змін (і так далі для PC3). Ділянка PCoA вказувала на те, що структура мікробіоти кишечника в групі ND, очевидно, не змінювалася при старінні, але вона змінювалась HFD. Зміни в мікробній структурі також спостерігались як для добавок часнику, так і для декстрину, однак суттєвої кластеризації за анатомічним розташуванням не було. Дані свідчать про те, що механізми регуляції мікробіому кишечника за допомогою часнику та декстрину різні.
Тому ми додатково досліджували зміни окремих мікробних видів на рівні типу. Співвідношення p_Firmicutes/p_Bacteroidetes збільшувалося при старінні з 6 тижнів до 18 тижнів у групі ND, і воно ослаблювалось у групах NDG та NDD (рис. 8). Крім того, добавки часнику збільшували відносну чисельність f_Lachnospiraceae та зменшували відносну кількість g_Prevotella на рівні роду видів. Крім того, добавки декстрину збільшували відносну кількість g_Parabacteroides, g_Sutterella та f_Rikenellaceae (рис.9).
Модуляція мікробіома кишечника на рівні типу. Мікробіота кишечника характеризувалась секвенуванням гена 16S рРНК. (A) Відносна кількість бактерій на рівні типу. (B) Співвідношення p_Firmicutes до p_Bacteroidetes на основі їх відносної чисельності.
Модуляція мікробіома кишечника на рівні роду. Мікробіом кишечника характеризувався послідовністю генів 16S рРНК, і дані представляють відносну кількість кожного роду бактерій. p_, c_, o_, f_ та g_ представляють тип, клас, порядок, сім'ю та рід відповідно, а пробіл після літери означає невизначений. (A) Відносна кількість понад 1% бактерій на рівні роду. Зокрема, чотири види бактерій (f_Lachnospiraceae (B), g_Prevotella (C.), g_Akkermansia (D), f_ Streptococcaceae (Е)) регулювались добавками часнику.
4. Обговорення
У ряді досліджень було зазначено, що помірне вживання часнику покращує певну функцію шлунково-кишкового тракту та виявляє захисний ефект для захисту слизової оболонки проти активності Helicobacter pylori та розвитку виразок [38,39]. У цьому дослідженні глибина склепіння тонусної кишки значно поглибилася в групі HFD, і добавки часнику полегшили цю ситуацію, сприяючи відновленню клітин епітелію та швидкості дозрівання ентероцитів. Повідомляється, що добавки L-глутамату зменшують глибину крипти, поглибленої HFD, і підвищують швидкість дозрівання клітин та секреторну функцію епітеліальних клітин [40]. З іншого боку, надмірне вживання часнику може призвести до втрати епітеліальних клітин кишечника [41], що призведе до гальмування кишкового всмоктування глутамінової кислоти, сахарози та глюкози [42], що може бути причиною того, чому часник скорочує зріст ворсинок при звичайному харчуванні.
Щоб зрозуміти вплив та механізми екстракту цільного часнику на мікробіом кишечника, ми використали модель миші та порівняли дані з декстрином, позитивним полісахаридом. Для цього ми також використали чотири різні індекси для всебічного аналізу α-різноманітності мікробіома кишечника. Індекс Chao1 - це оцінювач багатства громади для оцінки кількості ОТУ (оперативних таксономічних одиниць) у вибірці. Індекс, що спостерігається, є кількісним індексом біологічного виду, який розраховується відповідно до кількості підтверджених ОТУ [43,44]. Ціле дерево PD - це індекс філогенетичного різноманіття, заснований на значеннях PD. Значення PD визначаються як мінімальна загальна довжина всіх філогенетичних гілок на філогенетичному дереві [45]. Індекс Шеннона є більш вичерпним поданням різноманітності, яке обчислюється за масштабованими ОТУ на основі рівності громади [46]. Результати показали, що кластер β-різноманітності мікробних спільнот у мишей з добавкою часнику або декстрину був згрупований в різних місцях, і добавка часнику може збільшити видове багатство і видову рівномірність мікробіома кишечника більше, ніж декстрин.
Ми також спостерігали різний вплив на деякі типові бактерії мікробіому кишечника від добавок часнику та декстрину, хоча обидва вони містять полісахариди. Рівень g_Parabacteroides, g_Sutterella та f_Rikenellaceae збільшувався за рахунок добавок декстрину. Кількість g_Parabacteroides збагачується збільшенням харчових волокон [61], і g_Parabacteroides можуть перетравлювати крохмаль, який був хімічно модифікований [62]. Повідомляється, що g_Parabacteroides та f_Rikenellaceae асоційовані з мишами з харчовою алергією [63,64]. g_Sutterella - це широко розповсюджені комменсали з адгезією до епітеліальних клітин кишечника та легкими прозапальними можливостями [65]. Ці зміни в мікробіомі кишечника, спричинені добавкою декстрину, були різними, ніж у часнику, і вони можуть бути зумовлені хімічними властивостями декстрину.
Підсумовуючи, додавання цільного часнику може послабити індуковану ВЧР дисліпідемію та порушення мікробіому кишечника (рис. А1). Дані показали, що цілий часник може бути потенційним пребіотиком, який здатний запобігати порушенню HFD порушення мікробіому кишечника.
- Доведені побічні ефекти та користь часнику ▷
- My Slimming World Adventure Домашнє занурення Часник і трава, Гоумос та помідори та базилік Майо
- Мілан-метформін - використання, побічні ефекти, взаємодії
- Внесення добрив N, тип ґрунту та сорти на ефективність використання N у tef Eragrostis tef (Zucc
- Світовий рецепт для схуднення Пряний суп з пастернаку з часниковим йогуртом - Mirror Online