Продукти трансформації карбамазепіну (CBZ) після озонування та оцінка їх токсичності з використанням Pseudomonas sp. Штам KSH-1 у водних матрицях
Кшітіс Двіведі
1 CSIR-Національний науково-дослідний інститут навколишнього середовища (NEERI), Неру Марг, Нагпур, 440020 Індія
2 Rashtrasant Tukadoji Maharaj Nagpur University (RTMNU), Нагпур, Індія
Ашвінкумар П. Рудрашетті
1 CSIR-Національний науково-дослідний інститут навколишнього середовища (NEERI), Неру Марг, Нагпур, 440020 Індія
2 Rashtrasant Tukadoji Maharaj Nagpur University (RTMNU), Нагпур, Індія
Тапан Чакрабарті
1 CSIR-Національний науково-дослідний інститут навколишнього середовища (NEERI), Неру Марг, Нагпур, 440020 Індія
Р. А. Панді
1 CSIR-Національний науково-дослідний інститут навколишнього середовища (NEERI), Неру Марг, Нагпур, 440020 Індія
Пов’язані дані
Анотація
Карбамазепін (CBZ) - це протиепілептичний та протисудомний препарат, який широко застосовується для лікування епілепсії та інших біполярних розладів. Озон як вдосконалений процес окислення широко використовується для деградації CBZ, що призводить до утворення продуктів перетворення (озонідів). Дане дослідження має на меті виділити та ідентифікувати потенційні мікроорганізми, здатні до деградації CBZ та продуктів його перетворення. Життєздатність клітин та цитотоксичність чистого CBZ та продуктів їх озонової трансформації оцінювали за допомогою клітин Pseudomonas sp. штам KSH-1 за допомогою аналізів життєздатності клітин. Метаболічну активність клітин оцінювали при різних концентраціях CBZ (
10–25 ppm, чистий CBZ) і сукупно для продуктів перетворення озону. Для чистого CBZ% життєздатності клітин зменшується із збільшенням концентрації CBZ, тоді як, у випадку позозонованих продуктів перетворення CBZ, життєздатність спочатку зменшується, а потім збільшується при впливі озону з максимальною життєздатністю клітин 97 ± 2,8%, оціненою протягом 2 годин пост-озоновані зразки.
Електронний додатковий матеріал
Інтернет-версія цієї статті (10.1007/s12088-018-0715-3) містить додаткові матеріали, доступні для авторизованих користувачів.
Вступ
В останні роки багато уваги було прикуто до активних фармацевтичних інгредієнтів (API) та фармацевтичних засобів та засобів особистої гігієни (PPCP) через їх поширеність у всьому світі, непокірний характер та екологічну токсичність [1, 2]. Карбамазепін (CBZ) (додатковий рис. S1) є найбільш часто використовуваними API для лікування епілепсії та інших біполярних розладів [3]. CBZ, будучи непокірливими, мають високу стійкість до звичайних процесів очищення води та стічних вод і повідомляються як антропогенний маркер, що вказує на забруднення водних екосистем [4, 5]. Завдяки стійкій природі та більш тривалим періодам напіврозпаду в навколишньому середовищі, CBZ знаходить свою присутність у кількох водоймах як у країнах, що розвиваються, так і в розвинених [6]. Це змусило суспільство вживати профілактичних заходів для деградації цієї сполуки лише у її точковому джерелі. Крім того, CBZ важко біодеградувати через свою структурну складність. Однак небагато дослідників повідомляли про біодеградацію CBZ за допомогою Pseudomonas sp. штам CBZ-4, виділений з активного мулу при дуже низьких температурах [7].
За останні кілька десятиліть багато досліджень було зосереджено на виробництві матеріалів з доданою вартістю та виробництві енергії з метою подолання світової енергетичної кризи в наступних поколіннях. У цьому контексті стічні води також використовуються як альтернативне джерело для виробництва енергії [8]. Розширені процеси окислення (АОП) широко використовувались як потенційні процеси очищення для видалення фармацевтичних препаратів із реальних та синтетичних матриць стічних вод [9, 10]. Озон був включений як потенційний АОП для виведення фармацевтичних препаратів, оскільки забезпечує більш чисту деградацію порівняно з іншими звичайними процесами обробки [11, 12]. Однак частковий розпад CBZ повідомляється через пряму/непряму атаку озону, що призводить до утворення продуктів трансформації (TP), які іноді виявляють вищу токсичність, ніж вихідна сполука [13, 14]. Отже, необхідно оцінити токсичність ТП, що утворюється після обробки, і порівняти її токсичність з вихідною сполукою до їх викиду у водні водойми [15].
Тому для оцінки токсичності з проб активного мулу виділено потенційний мікроорганізм, здатний до деградації CBZ та його TP. У цьому аспекті метою роботи було поділено на (а) збагачення та акліматизацію змішаної мікробної культури для скринінгу потенційних мікроорганізмів, здатних до деградації CBZ, у реакторі із завислим ростом (SGR) [16]; (b) виділення та ідентифікація потенційного мікробного штаму, здатного до деградації CBZ [7], та (c) оцінка цитотоксичності чистого CBZ та кумулятивного ефекту TP на ідентифікований штам бактерій за допомогою тестів на життєздатність клітин (аналіз MTT). Метаболічну активність клітин оцінювали шляхом перетворення МТТ (жовтого) у відновлені кристали формазону (фіолетового) за допомогою ферменту мітохондріальної редуктази, залежного від NAD (H).
Наскільки нам відомо, оцінка цитотоксичності CBZ та їх озонових TP на Pseudomonas sp. до сьогодні не повідомлялося. Тому в цьому дослідженні озон був включений як потенційний АОП для лікування CBZ з подальшим тестом на життєздатність клітин (аналіз МТТ) на Pseudomonas sp. штам KSH-1, виділений із змішаної культури мікробів, отриманої з активованого мулу звичайних очисних споруд (CETP). % Життєздатності клітин оцінювали як для чистого CBZ (при різному дозуванні), так і для зразків, оброблених озоном (збільшення часу експозиції). Крім того, було постульовано шлях розпаду CBZ при озонуванні та визначено основні продукти окислення/перетворення CBZ за допомогою аналізу LC – ESI – MS та LC – MS/MS. Результати, що відносяться до них, були представлені та обговорені в цій роботі.
Матеріали і методи
Хімічні речовини, реагенти та живильні середовища
CBZ (99% чистоти) та диметилсульфоксид (DMSO) були закуплені у Sigma-Aldrich (США). Метанол (ВЕРХ), ізопропанол (99% об./Об.), Мурашина кислота були аналітичного класу, придбані у Fisher Scientific (Індія). МТТ [3- (4,5-диметилтіазол-2-іл) -2,5-дифенілтетразолію бромід] був придбаний у Invitrogen, Thermo Fisher Scientific (Індія). Усі інші хімічні речовини, а саме. K2HPO4, KH2PO4, (NH4) 2SO4, MgSO4 · 7H2O, NaCl, NaOH, Na2HPO4, CH3COONa, NH4Cl, CaCl2 · 2H2O, FeSO4 · 7H2O, MnSO4 · H2O, ZnSO4 · H2O, CuCl2 і т.д. сорту реагенту. Поживний агар та поживний бульйон придбані у Himedia (Індія).
Синтетичні стічні води CBZ (SWW)
Основний розчин CBZ 100 мг/л готували шляхом розчинення чистого CBZ у воді Milli Q. Робочий розчин відомих концентрацій (10, 15, 20 і 25 мг/л) був підготовлений для досліджень цитотоксичності із застосуванням основного розчину CBZ. Експерименти з озонування проводились із використанням синтетичної води міцністю близько 25 мг/л CBZ.
Система реакторів AOP для експериментів з озоном
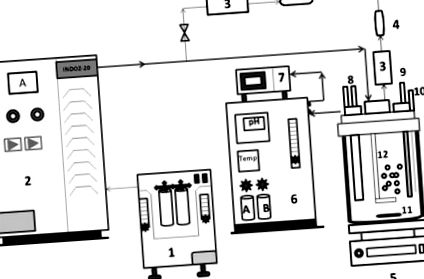
Реакторна система АОП складається з системи генерування озону та корпусу реактора з боросилікатного скла для однорідного змішування озону. Озон отримували методом коронного розряду (з повітряним охолодженням) із використанням генератора озону (модель INDOZ-20), Ozone Research & Applications India Pvt. ТОВ (ORAIPL), Нагпур. Дозування озону визначали шляхом вимірювання витрати газу на вході та виході з реактора за допомогою аналізатора озону BMT (виробник Німеччини). Непрореаговавший озон постійно контролювали на виході, щоб переконатися, що реакція відповідає швидкості реакції першого порядку. Всі експерименти по озонуванню проводили при кімнатній температурі шляхом безпосереднього розпилення озону в синтетичних стічних водах CBZ (напівзарядний режим) та при постійному перемішуванні для однорідного та ефективного розподілу озону [11]. Схеми реакторної системи АОП представлені на рис. 1 .
Принципова схема, що демонструє експериментальну установку для експериментів з озонування (1) Концентратор кисню, (2) система генерування озону (ORAIPL), (3) аналізатор озону BMT, Німеччина, (4) деструктор озону, (5) Магнітна мішалка, (6 ) Система панелі керування для реактора, (7) система збору даних, (8) вхід і вихід охолоджуючої води, (9) рН-електрод, (10) порт для відбору проб, (11) магнітна смужка для перемішування, (12) спаргер, (13) ) Головка, (14) Навколишнє середовище
Збагачувальні середовища та культура мікроорганізмів
Активний мул, що містить змішану мікробну культуру, був зібраний з аераційного резервуару діючої фармацевтичної промисловості, розташованого в південному регіоні Індії. Змішану мікрофлору збагачували у реакторі із завислим ростом (SGR) (колба об'ємом 2 л), використовуючи штучні стічні води, приготовані згідно з протоколом, згаданим Vasiliadou et al. [16] з невеликими змінами. Розмір засіву шламового розчину становив 10% від загального обсягу SGR. Всі макроелементи додавали в однаковому співвідношенні, однак у випадку мікроелементів H3BO3, Na2MoO4 · 2H2O та KI не додавали до SGR через осадження середовищ та побічну реакцію. Крім того, замість додавання дріжджового екстракту CH3COONa додавали до середовища протягом усього періоду запуску, щоб дозволити бактеріям адаптуватися до мінливих харчових потреб. 50% обсягу SGR замінено на свіжу штучну стічну воду, що містить CH3COONa (1,8 г/л, 527 мгC/L) як єдине джерело С.
Біодеградація CBZ в SGR
Після періоду акліматизації CBZ зменшився з 5 до 0,5 мг/л (
90% деградація, протягом 7 днів), в тому ж SGR, який використовується для акліматизації мікроорганізмів, що руйнують CBZ. Біодеградація CBZ була додатково підтверджена шляхом проведення додаткових експериментів із використанням свіжого SGR, але з використанням інокуляту акліматизованих мікроорганізмів та
Спостерігалось 80–90% біодеградації CBZ порівняно з початковими концентраціями CBZ.
Виділення та ідентифікація потенційних бактеріальних культур
Домінуючі бактеріальні культури, присутні в SGR, були виділені методом серійного розведення на конкретних пластинах середовища. Конкретні середовища, що використовуються для росту потенційних колоній, складаються з мінімальних середовищ (1 ×) (Склад: NH4Cl = 0,23 г/л, KH2PO4 = 4,5 г/л, Na2HPO4 = 4,5 г/л, MgSO4 · 7H2O = 0,2 г/л, CaCl2 · 2H2O = 0,02 г/л) з CBZ (5 мг/л) як єдиним джерелом С та 2% агару додавали для затвердіння. Носій піддавали автоклавуванню протягом 15 хв при 121 ° C і використовували для приготування специфічних пластин середовища.
Специфічні пластини середовища, що містять домінуючі колонії, були відібрані та прошаровані на свіжих специфічних пластинах середовища методом смугастої пластини (чотири способи прошаркування) для отримання чистих культур. Чисті культури характеризували морфологічними та біохімічними тестами. Паралельно проводили експерименти з зростання колб морфологічно різних колоній та вимірювали OD600. Для виділення та ідентифікації ДНК відібрано найбільш домінуючий та ефективний CBZ-деградуючий бактеріальний штам (KSH-1). Вирощену на ніч чисту бактеріальну культуру використовували для виділення ДНК. Біомасу центрифугували та лізували з використанням буферного розчину для лізису (400 мкл трис-ЕДТА, 50 мкл 10% додецилсульфату натрію (SDS), 50 мкл (20 мг/мл) протеїнази-К) і зберігали для інкубації при 37 ° С протягом 2 год. Після періоду інкубації додали рівний об’єм суміші PCI (фенол: хлороформ: ізоаміловий спирт, 25: 24: 1) і правильно перемішали. Лізат центрифугували і ДНК осаджували із застосуванням 90% етанолу. Обложену ДНК розчиняли в буфері Tris – EDTA (TE). Чистоту та кількісну оцінку виділеної ДНК визначали NanoDrop (ND-8000), Isogen Life Sciences.
Ланцюгова реакція полімерази (ПЛР) та секвенування генів 16S рРНК
Геномну ДНК виділили з культури, а ген 16РНК ампліфікували за допомогою універсальних праймерів 27F (5′-AGAGTTTGATCMTGGCTCAG-3 ′) та U1492R (5′-TACGGYTACCTTGTTACGACTT-3 ′). Суміш ПЛР/обсяг 100 мкл містила буфер Taq, полімеразу Taq, трифосфати нуклеозидів дезоксирибози (dNTP), 0,2 мкМ кожного праймера та екстраговану ДНК (50-100 нг). Ампліфікацію проводили за допомогою термоциклера (GeneAmp 2700, Applied Biosystems, США) з програмою ПЛР: початкова денатурація (95 ° C, 10 хв); 40 циклів температури відпалу (94 ° С, 1 хв, 52 ° С, 1 хв, 72 ° С, 1 хв); і остаточне розширення (72 ° C, 20 хв). Отриманий продукт ПЛР приблизно 1500 п.н. візуалізували за допомогою електрофорезу в агарозному гелі (додаткова фіг. S2) та очищали екстракцією гелю за допомогою гелевого елюючого набору (Sigma Life Sciences). Далі очищені продукти ПЛР секвенували за допомогою методу секвенування ДНК Сангерса. Файл FASTA з послідовністю передано в NCBI, і мікроорганізми були ідентифіковані за допомогою пошуку інструменту BLAST за допомогою стандартної бази даних NCBI.
Аналітичні методи
Загальні параметри
РН зразків до і після озонування негайно вимірювали за допомогою рН-метра (Cyberscan Eutech 510, виготовлений в США). УФ-сканування проводили за допомогою спектрофотометра UV-1800 (Shimadzu; спектральна смуга пропускання 1 нм), тоді як вміст загального органічного вуглецю (TOC) у зразках вимірювали за допомогою приладу Shimadzu TOC-L, оснащеного автосамплером ASI-V. Концентрацію CBZ у зразках до і після озонування визначали за допомогою ВЕРХ Уотерс (США), оснащеної детектором фотодіодів Waters 2998. Для відділення CBZ використовували високоміцний діоксид кремнію (HSS) С-18, (4,6 мм × 250 мм, 5 мкм, Уотерс, США). Зразки проводили в ізократичному режимі зі швидкістю потоку 1,5 мл/хв. Рухливу фазу готували змішуванням деіонізованої води Milli-Q та метанолу (v: v = 30:70) та 0,1% мурашиної кислоти. Об'єм впорскування кожного зразка становив 20 мкл, а температуру в колонні печі підтримували на рівні 25 ° C. Всі зразки перед аналізом фільтрували за допомогою шприцевих фільтрів 0,22 мкм.
LC – MS/MS аналіз
Основні продукти трансформації CBZ були ідентифіковані за допомогою системи UPLC-ESI – MS (Waters, США), оснащеної колонкою Thermo Accucore C-18 LC (100 мм × 3,0 мм, 2,6 мкм) та мас-спектрометром Waters UPLC-TQD (ESI– MS, APCI-MS, LC – MS/MS) з діапазоном мас 100–2000 Да. Однак кількісне визначення продуктів переробки/проміжних продуктів було неможливим через відсутність комерційних стандартів продуктів перетворення або проміжних продуктів.
Рухлива фаза, яка використовувалася для поділу TP, складалася з (A) ацетонітрилу та (B) 5 мМ NH4Ac. Градієнтний режим елюції застосовували таким чином: 0–3 хв, 20% A: 80% B; 3–6 хв, 40% A: 60% B; 6–8 хв, 70% A: 30% B; 8–10 хв, 80% A: 20% B; 10–12 хв, 20% А: 80% Б. Швидкість потоку підтримувалась постійною на рівні 0,35 мл/хв із швидкістю потоку 0,45 хв. ESI працював з такими параметрами: напруга розпилення 3,5 кВ, температура джерела 120 ° C, температура розчинення 350 ° C, режим сканування MS - SIR (вибраний іонний запис)/MRM (моніторинг множинних реакцій). Для збору мас-спектрів хроматограми отримували в режимі загального іонного струму (TIC) з діапазоном сканування m/z 50–350.
Аналіз росту бактерій та життєздатності клітин
Для дослідження кривої росту бактерій культурі бактерій дозволяли рости протягом ночі в мінімальному розчині середовища в струшуючому інкубаторі при 37 ° С, 120 об/хв. Вирощені за ніч бактеріальні клітини (з експоненціальної фази) використовувались як посівний матеріал для проведення колбових експериментів. Було проведено два різних набори експериментів з колбами, один з різними концентраціями CBZ, доданих до мінімальних середовищ для досягнення концентрацій CBZ (10 ppm, 15 ppm, 20 ppm, 25 ppm), а інший набір, що містив мінімальні середовища, але доповнений рівними обсягами зразки, оброблені озоном (початкові та післяозоновані протягом 10 хв, 30 хв, 60 хв і 120 хв). Всі колби автоклавували (121 ° С, 15 хв), інокулювали (100 мкл, вирощували протягом ночі) та інкубували при 37 ° С при безперервному струшуванні (120 об/хв). Зростання (OD600) культури бактерій вимірювали кожні 4 години з використанням УФ-видимого спектрофотометра.
Життєздатність бактеріальних клітин визначали за допомогою аналізу МТТ (додатковий рис. S3) [17]. Культури бактерій (950 мкл кожна) збирали в центрифужні пробірки (ємністю 1,5 мл) з інтервалом кожні 4 години з кожної експериментальної колби. МТТ (1,28 мг/мл, по 30 мкл кожний) та глюкозу (0,5%, 20 мкл кожен) додали в пробірки та інкубували при температурі 37 ° C протягом 1 години в темних умовах. Потім клітини збирали, центрифугували (при 10000 об/хв, 5 хв) і супернатант (що включає ріст середовища та розчин МТТ) декантували. Гранулу, що містить кристали формазану, остаточно суспендували в розчині диметилсульфоксиду (DMSO) (250 мкл) для розчинення кристалів та вимірювали абсорбцію (A550 нм), що відповідає кожній лунці, за допомогою зчитувача мікропланшетів Tecan infinite 200 PRO [18]. Всі експериментальні аналізи проводились у трьох примірниках (n = 3), і результати були представлені у вигляді% життєздатності клітин (середнє ± SD). Життєздатність клітини визначали за допомогою наступного рівняння:
Позитивний контроль на ПК (мінімальний носій із С-джерелом + 1% посівний матеріал); Контроль транспортного засобу VC (мінімальний носій + посівний матеріал, джерело С відсутній), Тестові зразки (мінімальний носій з різним CBZ як джерело С + + 1% посівного матеріалу кожен).
Результати
Продукти трансформації CBZ після обробки озоном
Запропонований шлях деградації CBZ після обробки озоном
- Уловлювання іонної ртуті з використанням різних адсорбентів - Ojedokun - 2019 - CLEAN; # 8211; Грунт, Повітря,
- Лікування токсичності марихуани
- Підстави для збільшення ваги для розлучення читачів HuffPost Розлучення дають своє життя HuffPost
- Точне чи хибне використання фена в пазухах вб’є Громадське мовлення від коронавірусу в Грузії
- Цільова генна терапія гломерулонефриту щурів з використанням імуноліпосом HVJ - Tomita - 2002 -