Пов’язує ожиріння, старіння та діабет
Ожиріння прискорює старіння жирової тканини - процес лише зараз починає виявлятися на молекулярному рівні. Експерименти на мишах дозволяють припустити, що ожиріння збільшує утворення активних форм кисню в жирових клітинах, скорочує теломери - і в кінцевому рахунку призводить до активації супресора пухлини p53, запалення та стимулювання інсулінорезистентності (сторінки 1082–1087).
Оскільки технологія покращила гігієну, забезпечення їжею та рівень життя в цілому, спостерігається зростання таких вікових захворювань, як серцево-судинні захворювання, рак, дегенеративні захворювання мозку та інших органів, а також порушення обміну речовин, такі як діабет. Вікові розлади набули поширення у всьому світі, замінивши інфекційні захворювання як основну причину смерті в розвинених країнах. З віком у багатьох людей розвивається метаболічний синдром, який характеризується центральним (вісцеральним) ожирінням, резистентністю до інсуліну, порушенням толерантності до глюкози або явним діабетом, гіпертонією, дисліпідемією та серцево-судинними ускладненнями.
Діабет також є визнаною причиною прискореного старіння, проте механізми, що пов'язують діабет і старіння, недостатньо вивчені. Робота від Minamino та ін. 1 у цьому номері Природна медицина пропонує розуміння того, як ожиріння впливає на старіння жирової тканини, впливаючи на запалення та гомеостаз глюкози.
Ожиріння є основною причиною інсулінорезистентності, яка переростає у діабет 2 типу, коли підшлункова залоза не здатна виробляти достатню кількість інсуліну. В останні роки з'явилися докази того, що запалення відіграє вирішальну роль у розвитку інсулінорезистентності, діабету та серцево-судинних захворювань, пов'язаних із ожирінням 2,3. Макрофаги проникають у жирову тканину при ожирінні, а рівень цитокінів підвищений і викликає інсулінорезистентність та діабет 2,3 .
Погіршення структури та функції органів під час старіння пов'язане з окислювальним стресом, генетичною нестабільністю та порушенням гомеостатичних шляхів 4. Багато досліджень щодо старіння вивчали теломери, які складаються з тандемних повторів послідовності TTAGGG та асоційованих білків і розташовані на кінцях 5 хромосом. Стовбурові клітини та ракові клітини можуть продовжувати ділитися, оскільки теломери підтримуються ферментом, званим теломеразою. На відміну від цього, у нормальних соматичних клітинах теломерні повтори втрачаються з кожним клітинним циклом, поки не буде досягнута «критична довжина». Скорочення теломер призводить до активації супресорів пухлини, зокрема p53, що індукує зупинку та старіння клітинного циклу.
Геномна шкода також може накопичуватися з часом від активних форм кисню (АФК). Діабет, серед інших вікових захворювань, пов'язаний з неможливістю детоксикації АФК 6. Подібним чином, укорочення теломер пов'язане з ожирінням, резистентністю до інсуліну, діабетом та ішемічною хворобою 7 .
Оскільки в старінні та ожирінні є схожість порушення метаболічної дисрегуляції, цілком ймовірно, що ці стани мають подібні клітинні шляхи. Щоб перевірити цю гіпотезу, Мінаміно та ін. 1 проаналізували жирову тканину мишей з ожирінням на наявність окисного стресу, старіння та запалення. Жирова тканина мишей агуті, які страждають генетичним ожирінням, мала вищий рівень АФК та пошкодження ДНК, ніж худих мишей, коли обидві групи сиділи на звичайній дієті протягом 20 тижнів 1. Жирова тканина мишей агуті показала особливості передчасного старіння, такі як вища експресія асоційованої із старінням β-галактозидази, p53 та інгібітора циклінозалежної кінази 1А (Cdkn1a).
Потім дослідники встановили, чи вікові зміни жирової тканини відповідають за резистентність до інсуліну 1. Жирова тканина мишей агуті також експресувала прозапальні цитокіни, які залучають макрофаги до жирової тканини, фактор некрозу пухлини та білок-хемоаттрактант моноцитів, що асоціюється з резистентністю до інсуліну. Адипонектин, який підсилює дію інсуліну, придушувався в жировій тканині від мишей агуті.
Мінаміно та ін. 1 припустив, що зв'язок між ожирінням та старінням та порушенням обміну речовин був p53. Вони виявили, що дефіцит р53 знижує запалення та покращує чутливість до інсуліну у мишей із ожирінням агуті, які регулярно харчуються, або у мишей дикого типу, що страждають ожирінням, на дієті з високим вмістом цукру та жиру порівняно з худими мишами дикого типу 1. Толерантність до глюкози покращилася, коли мишам без р53 у жировій тканині було проведено трансплантацію кісткового мозку від нормальних мишей, що вказує на ключову роль макрофагів у метаболізмі глюкози. Більше того, трансгенна надмірна експресія p53 та Cdkn1a в жировій тканині індуковане запалення та резистентність до інсуліну. Ці результати дозволяють припустити, що p53 походить від адипоцитів та макрофагів та сприяє старінню жирової тканини у ожирілих тварин.
Оскільки р53 активується у відповідь на укорочені теломери у старіючих клітинах, Minamino та ін. 1 досліджували, чи впливала довжина теломер на спричинене ожирінням запалення та резистентність до інсуліну. Миші, яким не вистачає теломерази (Терт) розвивають коротші теломери з наступними поколіннями і з часом стають безплідними до четвертого-шостого покоління (G4 – G6). Як і слід було очікувати, Мінаміно та ін. 1 виявив, що G4 Терт-дефіцитні миші мали підвищене пошкодження ДНК і високу експресію маркерів сесенсу (наприклад, асоційовану зі старінням β-галактозидазу, p53 та Cdkn1a) в жировій тканині. Автори також виявили велику кількість маркерів старіння та запалення в біопсіях жирової тканини у хворих на цукровий діабет порівняно з особами без діабету, що припускає, що жирова тканина асоціюється із старіючим фенотипом.
G4 Терт-дефіцитні миші демонстрували ознаки патологічного обміну речовин: вони були більш схильні до розвитку непереносимості глюкози та резистентності до інсуліну на дієті з високим вмістом жиру та цукру порівняно з мишами дикого типу, що відповідають віку, на подібній дієті 1. Макрофаги проникли в жирову тканину G4 Терт-дефіцитних мишей, і вони розвивали резистентність до інсуліну в печінці та, меншою мірою, в м’язах. Ці ефекти не залежали від маси тіла.
Хірургічне видалення жирової тканини призвело до поліпшення метаболізму глюкози в G4 Терт-дефіцитні миші, тоді як трансплантація G4 Терт-дефіцит жирової тканини у нормальних мишей викликав резистентність до інсуліну, що вказує на те, що старіння жирової тканини має значний вплив на дію інсуліну в жировій тканині та інших органах. Ця реакція ослабла, коли жирову тканину, дефіцитну як в теломеразі, так і в p53, пересаджували нормальним мишам, таким чином встановлюючи функціональний зв’язок між дисфункцією теломер та активацією p53.
Мінаміно та ін. Потім шукали зв’язок між окислювальним стресом та старінням та запаленням у жировій тканині людини. Первинні людські адипоцити, оброблені перекисом водню (H2O2), джерелом АФК, експресували високий рівень р53 та прозапальних цитокінів, фактор некрозу пухлини та моноцитарний хемоаттрактант білок-1, розкриваючи молекулярний механізм метаболічного ураження від окисного стресу.
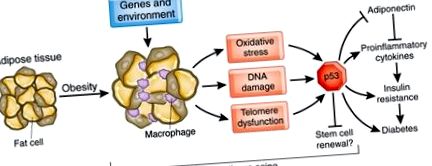
Ці дані дають нові уявлення про те, як ожиріння сприяє старінню жирової тканини та резистентності до інсуліну (рис. 1). Ожиріння, спричинене генетичними та екологічними факторами, наприклад, переїданням, стимулює вироблення АФК. Ці молекули, ймовірно, перевершують антиоксидантний захист жирової тканини, тим самим прискорюючи пошкодження ДНК та старіння. Опосередковане ожирінням старіння жирової тканини також пов'язане з укороченням теломер, що призводить до активації p53. Ці зміни викликають запальні реакції в жировій тканині та стимулюють вироблення цитокінів, що потім призводить до місцевої та системної резистентності до інсуліну (рис. 1).
У ожиріних станах жирова тканина піддається окисному стресу, що призводить до старіння, накопичення макрофагів, вироблення прозапальних цитокінів та пригнічення адипонектину. Активація супресора пухлини p53 є ключовою в процесі старіння, стимулює запалення і, можливо, послаблює здатність відновлення стовбурових клітин. Старіння жирової тканини індукує резистентність до інсуліну в жировій тканині, печінці та м’язах та опосередковує прогресування діабету.
Мінаміно та ін. Запропоновано модель, при якій старіння та запалення ініціюються в жировій тканині і згодом індукують резистентність до інсуліну в жировій тканині, печінці та м’язах (рис. 1). Однак вони не з'ясували терміни цих змін ожиріння. Жирова тканина спілкується через жирні кислоти та безліч циркулюючих факторів з мозком та іншими органами 8, проте дослідження було зосереджене виключно на прозапальних цитокінах та адипонектині. На відміну від зосередження уваги на жировій тканині, більш вірогідним сценарієм є те, що старіння відбувається з різною швидкістю в різних органах і має місцевий та віддалений вплив на запалення та чутливість до інсуліну. Інсулінорезистентність печінки є помітною при цукровому діабеті 2 типу та збільшує вироблення глюкози 9. Скелетні м’язи є головним органом, відповідальним за опосередковане інсуліном засвоєння глюкози, і це притупляється при старінні та ожирінні в результаті відносного зменшення м’язової маси 9. Старіння та ожиріння можуть порушити вироблення інсуліну підшлунковою залозою 10. Крім того, старіння пов’язане з окислювальним ураженням мозку і може потенційно погіршити секрецію та чутливість інсуліну 11 .
Ще одне відкрите питання полягає в тому, чи неможливо погіршити старіння жирової тканини, обумовлене ожирінням, дієтами та іншими методами лікування. Обмеження калорій зменшує старіння та покращує гомеостаз глюкози 12. Можливо, лікування адипонектином може зменшити окисне пошкодження та запалення в жировій тканині, як це було показано в печінці та судинах 8. Зниження активності p53 є логічною стратегією для уповільнення старіння та запалення та покращення дії інсуліну, але чи можуть жирова тканина та інші органи бути спеціально націлені? Чи можуть антиоксиданти покращити старіння клітин, зменшуючи таким чином запалення та підвищуючи чутливість до інсуліну? Нарешті, було б цікаво вивчити, чи опосередковує супресор пухлини р53 ліпідні відхилення та серцево-судинну захворюваність, пов’язану з ожирінням. Робота Мінаміно та ін. 1 - це важливий крок до відповіді на ці запитання.
Список літератури
Мінаміно, Т. та ін. Nat Med. 15, 1082–1087 (2009).
Готаміслігіл, Г.С. Природа 444, 860–867 (2006).
Xu, H. та співавт. J. Clin. Інвестуйте. 112, 1821–1830 (2003).
Рассел, С. & Кан, К.Р. Нат. Преподобний Мол. Клітинка. Біол. 8, 681–691 (2007)
Ден, Ю. та ін. Нат. Преподобний Рак 8, 450–458 (2008).
Валько, М. та ін. Міжнародний Дж. Біохім. Клітинна біол. 39, 44–84 (2007).
- Грелін, ожиріння та діабет Огляди природи Ендокринологія
- Fgr-кіназа необхідна для прозапальної активації макрофагів під час ожиріння, спричиненого дієтою
- Втручання при цукровому діабеті та візити додому сприяють зниженню ваги матерів із надмірною вагою та ожирінням
- Ефективність загальнолюдських програм профілактики діабету та ожиріння Огляд систематичних
- Діабет природною медициною