Поведінкова та фармакологічна характеристика смачного чергування дієти у мишей
Кетрін Ф. Мур
лабораторія наркологічних розладів, кафедри фармакології та експериментальної терапії та психіатрії, Медична школа Бостонського університету, Бостон, Массачусетс, США
b Вища програма з нейронауки, Медичний факультет Бостонського університету, Бостон, Массачусетс, США
Габріель С. Шлейн
лабораторія наркологічних розладів, кафедри фармакології та експериментальної терапії та психіатрії, Медична школа Бостонського університету, Бостон, Массачусетс, США
Саманта Манчіно
лабораторія наркологічних розладів, кафедри фармакології та експериментальної терапії та психіатрії, Медична школа Бостонського університету, Бостон, Массачусетс, США
Валентина Сабіно
лабораторія наркологічних розладів, кафедри фармакології та експериментальної терапії та психіатрії, Медична школа Бостонського університету, Бостон, Массачусетс, США
П'єтро Бавовна
лабораторія наркологічних розладів, кафедри фармакології та експериментальної терапії та психіатрії, Медична школа Бостонського університету, Бостон, Массачусетс, США
Анотація
1. Вступ
Дезадаптивна харчова поведінка зазвичай спостерігається при деяких формах ожиріння та деяких харчових розладах, таких як розлад переїдання (BED), а також нещодавно запропонована харчова залежність (American Psychiatric Association, 2013; Davis, 2013; de Zwaan, 2001; Gearhardt et al., 2009; Moore et al., 2017c; Schulte et al., 2015). Основним припущенням, що сприяє зростанню ожиріння та розладів харчової поведінки, є висока підсилююча ефективність смачної їжі (тобто їжі, багатої цукром та/або жирами), яка відповідає за збільшення споживання (Avena and Gold, 2011; Berthoud, 2012; Gearhardt et al., 2011; Moore et al., 2017b; Morris et al., 2015). Крім того, люди часто вдаються до дієт або обмежують дієтичне харчування низькокалорійною, «безпечною» їжею, яка в основному менш смачна, ніж висококалорійна їжа, і утримуються від «забороненої» їжі з високим вмістом калорій та високою смаковістю (Хофманн та ін., 2014; Mela, 2001). Зрештою, ті, хто діє або утримується від смачної їжі, повернеться до їжі з високим смаком (Pankevich et al., 2010). Як результат, історія дієт включає повторювані, дискретні чергування споживання «безпечної» їжі з дуже смачними продуктами, багатими жиром та/або цукром (Laessle et al., 1989; Mela, 2001; Polivy and Herman, 1985) . Таким чином, історія дієт визнана основним фактором ризику розвитку ожиріння, а також розладів харчування (Dulloo and Montani, 2015; Lowe et al., 2013).
Раніше наша лабораторія використовувала експериментальну парадигму для імітації як надмірного споживання, так і дієти, шляхом почергового доступу до дуже смачної дієти у щурів (Blasio et al., 2014a; Dore et al., 2014). У цій моделі протягом 3-денних циклів тварини отримують поперемінний доступ до контрольної дієти чау (2 дні) та дієти з високим вмістом сахарози (1 день) (Blasio et al., 2014a; Dore et al., 2014 ). Ця та інші моделі смачного дієтичного катання на щурах призвели до декількох зрушень у розумінні психо-поведінкових та нейрофармакологічних механізмів невпорядкованого харчування. Однак у мишей перевірка поведінкових моделей чергування дієт менш розвинена. Охарактеризовані, клінічно значущі поведінкові парадигми можуть поєднуватися з численними та легкодоступними генетичними технологіями, доступними для мишей (наприклад, нокаут-моделі, лінії Cre-рекомбінази, трансгенні лінії). Таким чином, першою метою цього дослідження було перевірити достовірність моделі моделі переривчастого доступу на велосипеді до смачної їжі у мишей.
Кілька нейромедіаторних систем були визначені як фармакотерапевтичні мішені для ожиріння та порушення харчування, включаючи опіоїдні, канабіноїдні-1 (CB1) та сигма-1 (Sig-1) рецепторні системи. У моделях невпорядкованого харчування у щурів антагонізм вищезазначених рецепторів здатний зменшити надмірне споживання їжі (Blasio et al., 2014b; Cottone et al., 2012; Dore et al., 2014). Таким чином, другорядною метою цього дослідження була оцінка конвергентної валідності моделі чергування дієти у мишей шляхом оцінки ефектів попередньої обробки налтрексоном, антагоністом опіоїдних рецепторів, SR141716A, антагоністом/зворотним агоністом рецептора CB1 та BD-1063, антагоніст рецептора Sig-1 при вживанні смачної їжі.
2. Матеріали та методи
2.1 Предмети
Самці мишей C57Bl/6J (N = 73) (віком 7 тижнів після прибуття, лабораторія Джексона) вагою 22–29 г, одиноко розміщувались у пластикових клітинах із дротовим покриттям (16,76 см × 27,94 см × 12 32 см) на 12-годинний цикл зворотного світла (вимкнення о 10:00), у затвердженому AAALAC вологості (60%) та помірному контролі (22 ° C). Миші постійно мали доступ до їжі та води, якщо не вказано інше. Усі експериментальні протоколи, використані в цьому дослідженні, відповідали Керівництву Національного інституту охорони здоров’я щодо догляду та використання лабораторних тварин та Принципам лабораторного догляду за тваринами та були схвалені Інституційним комітетом з догляду та використання тварин Бостонського університету.
2.2 Харчування
Чау-чау на основі кукурудзи (Teklad Global Diet 2918 (44,2% вуглеводів, 6,2% жиру, 18,6% білка, енергія, що піддається метаболізму 3,1 кал/г; Харлан, штат Індіанаполіс, Індонезія) використовували як контрольну дієту. Високо смачний і повноцінний шоколад, шоколад -ароматизована дієта на основі AIN-76A з високим вмістом сахарози, порівнянна за макроелементами та щільністю енергії з дієтою чау (Формула 5TUL: 66,7% вуглеводів, 12,7% жиру, 20,6% білка, енергія, що піддається метаболізму 3,44 кал/г; TestDiet, Річмонд, IN), використовували як експериментальну дієту.
2.3 Смачний дієтичний велосипед
2.4 Наркотики
Антагоніст опіоїдних рецепторів налтрексон [(5a) -17- (циклопропілметил) -4,5-епокси-3,14-дигідроксиморфінан-6-он гідрохлорид] був солюбілізований безпосередньо перед обробкою в ізотонічному сольовому розчині (0,9%) (Cole et al., 2000) та вводять внутрішньочеревно (0,1 мг/кг, 10 мг/кг, 30 хв попередньої обробки). Обрані дози та час попередньої обробки базувалися на попередній літературі (Escher and Mittleman, 2006; Moslehi et al., 2014; Stafford et al., 2015).
Антагоніст/зворотний агоніст рецептора CB1 SR141716A [римонабант або 5- (4-хлорфеніл) -1- (2,4-дихлор-феніл) -4-метил-N- (піперидин-1-іл) -1Н-піразол-3 -карбоксамід гідрохлорид] розчиняли безпосередньо перед лікуванням у суміші фізіологічного розчину: етанол: кремофор 18: 1: 1, як було визначено раніше (Dore et al., 2014), і вводили внутрішньочеревно (0, 3 мг/кг, 10 мг/кг, 30 хв попередньої обробки). Обрані дози та час попередньої обробки базувалися на попередній літературі (Dol-Gleizes et al., 2009; Duarte et al., 2004; Ward et al., 2007; Wiley et al., 2005).
Антагоніст рецептора Sig-1 BD-1063 × 2HBr сіль (1- [2- (3,4-дихлорфеніл) етил] -4-метилпіперазиндигідробромід]) була солюбілізована безпосередньо перед обробкою в ізотонічному сольовому розчині (0,9%) (Kotagale та ін., 2013) та вводять внутрішньочеревно (0, 10 мг/кг, 30 мг/кг, 15 хв попередньої обробки). Обрані дози та час попередньої обробки базувалися на попередній літературі (Brammer et al., 2006; Liu et al., 2005; Liu and Matsumoto, 2008; Nguyen et al., 2014).
2.5 Вплив фармакологічного лікування на надмірне вживання смачної їжі
В окремій групі мишей, що мали в анамнезі переривчасту смачну парадигму доступу до дієти, налтрексон, SR141716A та BD-1063 вводили в межах об'єкта латиноамериканського квадрата (N = 24 на групу). Після встановлення стабільного прийому їжі в першу годину лікування лікарськими препаратами відбувалося з інтервалом не менше 3 днів для доз одного і того ж препарату та не менше 5 днів між різними препаратами. Після введення ліків та періоду попередньої обробки, коли їжу не дозволяли, мишам надавали доступ до попередньо зваженої кількості чау-чау або смачної дієти. Через 1 годину споживання їжі вимірювали знову. Вагу тіла реєстрували під час введення препарату та через 24 години для оцінки впливу препарату на масу тіла.
2.6 Статистичний аналіз
3.2 Вплив чергування дієти на ескалацію споживання смачної їжі у мишей чау/смачних
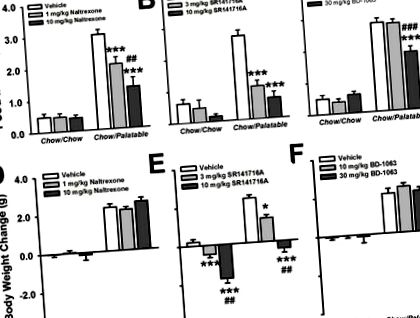
Миші чау/смачні ескалатори споживали їжу протягом першої години відновленого доступу протягом 10 послідовних циклів [Група циклів × дієти: F (9,207) = 7,78, с Рисунок 2]. З першого введення смачної дієти миші чау/смачні їжі споживали більше їжі, ніж миші чау/чау протягом першої години доступу [t (23) = −2,72, p Рисунок 3A]. Зменшення споживаного налтрексоном смаку їжі залежало від дози; оскільки доза 10 мг/кг додатково зменшує споживання порівняно з дозою 1 мг/кг. Налтрексон не впливав на стандартне споживання чау у мишей чау/чау.
3.4 Вплив SR141716A на надходження їжі та збільшення маси тіла
Попередня обробка SR141716A значно зменшила споживання їжі у мишей Chow/Palatable протягом першої години [Дієта × Доза: F (2,44) = 11,66, p Рисунок 3B]. Крім того, миші чау/смачні, оброблені дозою 3 мг/кг і 10 мг/кг, споживали однакову кількість їжі, як миші чау/чау в умовах транспортного засобу, що вказує на повну блокаду надмірного вживання їжі. Обидві дози SR141716A зменшують смачне споживання їжі однаково ефективно у мишей Chow/Palatable. Лікування SR141716A не впливало на споживання чау у мишей чау/чау.
3.5 Вплив BD-1063 на споживання їжі та збільшення маси тіла
Попередня обробка BD-1063 суттєво зменшила смачне споживання їжі у мишей Chow/Palatable під час першої години доступу [Група доз × дієти: F (2,44) = 18,41, p Рисунок 3C]. Хоча попередня обробка 10 мг/кг BD-1063 не суттєво зменшила смачне споживання їжі, попередня обробка 30 мг/кг призвела до значного зменшення споживання порівняно з умовами транспортного засобу (p Рисунок 3F Доза × Дієта: F (2,44) = 0,22, нс].
4. Обговорення
Адаптація годівлі протягом фаз супроводжувалася подібними коливальними характеристиками зміни маси тіла та ефективності харчування. Примітно, що протягом перших тижнів дієтичного велосипедного руху сукупна маса тіла та ефективність годівлі мишей Chow/Palatable були значно вищими, ніж контролі Chow/Chow. Однак ці відмінності повільно зменшувались з часом, так що дві експериментальні групи не відрізнялись за сукупною масою тіла та ефективністю годування, починаючи з 7 та 4 тижня відповідно.
Незважаючи на те, що результати, наведені тут із використанням сучасної моделі миші на зміну дієти, добре відтворюють попередні спостереження на моделях щурів, також важливо підкреслити деякі важливі відмінності між двома видами. Дійсно, хоча було показано, що зміни у споживанні їжі, вазі тіла та ефективності харчування у щурів розвиваються повільно і поступово протягом декількох тижнів чергування дієт (Blasio et al., 2014a; Dore et al., 2014), тут у мишей ми спостерігали, що зміни у споживанні їжі, вазі тіла та ефективності харчування у миші були стійкими з перших переходів у дієту (або чау на смачну, або смачну на чау). Ці результати свідчать про те, що поведінкові результати у відповідь на зміни смакових якостей їжі розвиваються більш енергійно та швидше у мишей, ніж у щурів. Крім того, ми спостерігали, що загальне кумулятивне споживання їжі вище у мишей Chow/Palatable з початку дієтичного велосипедного руху. Як правило, ніяких відмінностей у кумулятивному споживанні не спостерігається через гіперфагію смачної дієти, яку перекриває гіпофагія дієти чау (Dore et al., 2014).
Налтрексон, антагоніст опіоїдних рецепторів, вибірково і залежно від дози зменшував смачне споживання дієти у мишей Chow/Palatable, не впливаючи на масу тіла жодної групи. Ці результати узгоджуються з попередніми спостереженнями, які показують, що попередня обробка налтрексоном залежно від дози зменшує запої у щурів (Apfelbaum and Mandenoff, 1981; Blasio et al., 2014b). Ці ефекти, як правило, (Apfelbaum and Mandenoff, 1981; Rao et al., 2008), хоча і не завжди (Blasio et al., 2014b), є селективними для дуже смачних дієт, і, як вважають, налтрексон надає свій ефект за рахунок зменшення гедонічних властивостей їжі (Giuliano and Cottone, 2015; Kelley et al., 2002; Le Merrer et al., 2009; Taha, 2010). Налтрексон та інші антагоністи опіоїдних рецепторів досліджувались у клінічних популяціях, маючи багатообіцяючий вплив на зменшення споживання їжі та гедонічні реакції на смачну їжу (de Zwaan and Mitchell, 1992; Ziauddeen et al., 2013). В даний час налтрексон є затвердженим фармакотерапевтичним засобом для ожиріння, що застосовується у поєднанні з бупропіоном, інгібітором зворотного захоплення норадреналіну/дофаміну (Narayanaswami and Dwoskin, 2017). Препарати муо-опіоїдних рецепторів широко вивчались для їх модуляції гедонічних властивостей множинного зловживання наркотиками як у людей (Gianoulakis, 2004; Schmitz et al., 2001; Volpicelli et al., 1992), так і у тварин (Giuliano et al., 2013; Moore and Lynch, 2015; Sabino et al., 2007).
SR141716A, антагоніст/зворотний агоніст рецептора CB1, також вибірково блокував надмірне вживання смачної їжі у мишей Chow/Palatable; хоча маса тіла залежно від дози знижувалась як у мишей чау/чау, так і у чау/смачних мишей. Ці спостереження узгоджуються з приємними моделями дієтичного їзди на велосипеді у щурів (Dore et al., 2014), де лікування SR141716A також зменшило надмірне вживання їжі протягом першої години оновленого доступу до смачної їжі та зменшило збільшення маси тіла. SR141716A досліджували щодо його ефекту проти ожиріння (Christensen et al., 2007), хоча він був вилучений з ринку за серйозні психіатричні побічні ефекти, включаючи підвищену тривожність та пригнічений настрій, ефекти, які були повторені на моделях невпорядкованого харчування у щурів. (Blasio et al., 2013; Blasio et al., 2014a). Антагоністи CB1/зворотні агоністи, включаючи SR141716A, також досліджуються щодо їх терапевтичного потенціалу при лікуванні інших форм залежності (Henderson-Redmond et al., 2016; Le Foll and Goldberg, 2005), оскільки було показано, що вони модулюють різноманітність поведінки, спричиненої наркотиками, що викликають залежність, такими як кокаїн (Marinho et al., 2015; Mereu et al., 2015), етанол (Economidou et al., 2006) та нікотин (Cohen et al., 2005; Le Foll and Goldberg, 2004).
Попередня обробка антагоністом рецептора Sig-1 BD-1063 також вибірково зменшила надмірне вживання їжі групи дієти чау/смаку при найвищій випробуваній дозі. Наші результати узгоджуються з попереднім спостереженням, що попередня обробка BD-1063 спричинила селективне, залежне від дози зменшення смачного споживання їжі у п’ячих щурів (Cottone et al., 2012). Хоча ще не перевірений на людях, антагонізм рецепторів Sig-1 є перспективною терапевтичною мішенню для компульсивного прийому їжі (Cottone et al., 2012), а також алкоголю (Sabino and Cottone, 2016; Sabino et al., 2011; Sabino et al. ., 2009a; Sabino et al., 2009b; Valenza et al., 2016) та споживання наркотиків (Hiranita et al., 2010; Nguyen et al., 2005; Sabino et al., 2017; Takahashi et al., 2000).
Вплив фармакологічних методів лікування налтрексоном, SR171416A та BD-1063 на надмірне вживання смачної їжі у цій моделі миші на смачному велосипедному дзеркалі, що спостерігається на споріднених моделях невпорядкованого харчування щурів (Blasio et al., 2014b; Cottone et al. ., 2012; Dore et al., 2014). Представлені тут експерименти оцінювали гостру реакцію на лікування препаратами, і необхідні додаткові дослідження щодо ефектів хронічного введення для подальшого вивчення терапевтичного потенціалу цих препаратів у лікуванні невпорядкованої харчової поведінки. Результати цього дослідження свідчать про конвергентну валідність на моделях мишей та щурів, підтверджує корисність цієї парадигми у мишей для подальшого вивчення фармакологічних та нейробіологічних механізмів гіперфагії та ожиріння.
5. Висновки
Підводячи підсумок, наші експерименти дають докази нової моделі смачного чергування дієти на мишах, яка демонструє сильне обличчя та збіжність. Доопрацювання доклінічного репертуару тварин представляє важливий аспект імітації складності невпорядкованого харчування, а також надання ефективних інструментів для скринінгу нових фармакологічних цілей (Moore et al., 2017a).
- Bifidobacterium pseudocatenulatum послаблює поведінкові зміни у мишей, пов’язані з ожирінням - Кишечник
- Кетогенна дієта з високим вмістом жиру викликає у мишей резистентність до печінки, незважаючи на збільшення енергії
- Вплив проти ожиріння двох лактобактерій та двох біфідобактерій на мишей ICR, що харчуються дієтою з високим вмістом жиру -
- Поведінкові консультації для сприяння здоровому харчуванню та фізичній активності при серцево-судинних захворюваннях
- Дієта КАБАЛА; Дослідження здоров’я - Повний текст