Потенційний сприятливий вплив бутирату при кишкових та позакишкових захворюваннях
Листування: Роберто Берні Канані, доктор медичних наук, доктор філософії, кафедра педіатрії, Неаполітанський університет “Федеріко II”, Via S Pansini 5, Неаполь 80131, Італія. ti.aninu@inreb
Телефон: + 39-81-746286 Факс: + 39-81-51278
Анотація
Багаторазовий сприятливий вплив на здоров’я людини коротколанцюгового бутирату жирних кислот, синтезованого з непоглинених вуглеводів мікробіотою товстої кишки, добре задокументовано. На кишковому рівні бутират відіграє регулюючу роль у трансепітеліальній рідині, покращує запалення слизової та окислювальний статус, підсилює захисний бар’єр епітелію та модулює вісцеральну чутливість та перистальтику кишечника. Крім того, все більша кількість досліджень наголошує на ролі бутирату в профілактиці та інгібуванні колоректального раку. На позакишковому рівні бутират надає потенційно корисний вплив на багато станів, включаючи гемоглобінопатії, генетичні метаболічні захворювання, гіперхолестеринемію, резистентність до інсуліну та ішемічний інсульт. Механізми дії бутирату різні; багато з них пов'язані з його потужним регуляторним впливом на експресію генів. Ці дані свідчать про широкий спектр позитивних ефектів, які надає бутират, з високим потенціалом для терапевтичного використання в людській медицині.
ВСТУП
Таблиця 1
Основні ефекти бутирату, потенційно корисні в медицині
| Кишковий рівень | Позакишковий рівень |
| Поглинання іонів | Чутливість до інсуліну |
| Розмноження клітин | Синтез холестерину |
| Клітинна диференціація | Витрати енергії |
| Функція кишкового бар’єру | Поглинач аміаку |
| Імунна регуляція | Стимуляція β-окислення дуже довголанцюгових жирних кислот та проліферація пероксисом |
| Окислювальний стрес | Функція CFTR |
| Перистальтика кишечника | Нейрогенез |
| Вісцеральне сприйняття та ректальна відповідність | Виробництво HbF |
CFTR: трансмембранний регулятор провідності муковісцидозу; HbF: Бутират для підвищення гемоглобіну плода.
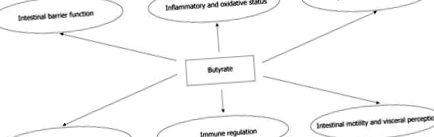
Множинні ефекти бутирату на кишковому рівні.
ЕФЕКТИ БУТИРАТУ НА КИШКОВОМУ РІВНІ
Вплив на трансепітеліальний транспорт іонів
Вплив на ріст та диференціацію клітин
Вплив на запальний та окислювальний статус
Більшість клінічних досліджень, що аналізують вплив бутирату на запальний статус, зосереджувались на пацієнтах з UC. Hallert та співавт. [60] доручили 22 пацієнтам із спокійним UC додавати до свого щоденного раціону 60 г вівсяних висівок (що відповідає 20 г харчових волокон). Чотири тижні цього лікування призвели до значного збільшення концентрації бутирату в калі та до значного поліпшення абдомінальних симптомів. У подвійному сліпому, плацебо-контрольованому багатоцентровому дослідженні Vernia та співавт. [61] лікували 51 пацієнта з активним дистальним UC ректальними клізмами, що містять або 5-аміносаліцилову кислоту (5-ASA), або 5-ASA плюс бутират натрію (80 ммоль/л, два рази на день). Комбіноване лікування місцевим 5-АСК плюс бутират натрію значно покращило показник активності захворювання більше, ніж лише 5-АСК. Ці та інші втручальні дослідження [62-64] припускають, що введення в дію бутирату в просвіт або стимулювання вироблення просвіту бутирату при попаданні в організм харчових волокон призводить до полегшення запалення та симптомів у хворих на УК.
Численні дослідження повідомляють, що метаболізм бутирату порушується у слизовій оболонці кишечника хворих на ВЗК. Останні дані показують, що дефіцит бутирату виникає внаслідок зменшення поглинання бутиратів запаленою слизовою через зниження регуляції MCT1. Одночасна індукція транспортера глюкози GLUT1 свідчить про те, що запалення може спричинити метаболічний перехід від бутирату до окислення глюкози. Очікується, що дефіцит транспорту бутирату матиме клінічні наслідки. Зокрема, зменшення внутрішньоклітинної доступності бутирату в колоноцитах може зменшити його захисний ефект щодо раку у хворих на ВЗК [65].
Обмежені дані доклінічних досліджень показують, що окислювальний стрес на слизовій оболонці товстої кишки може модулюватися бутиратом. Окислювальний стрес бере участь як у запаленні [66], так і в процесі ініціювання та прогресування канцерогенезу [67]. Під час окисного стресу виникає дисбаланс між утворенням активних форм кисню (АФК) та антиоксидантними захисними механізмами, що призводить до каскаду реакцій, в результаті яких ліпіди, білки та/або ДНК можуть пошкоджуватися. У здорових людей було продемонстровано, що місцеве введення бутирату у фізіологічних концентраціях збільшувало антиоксидант GSH і, можливо, зменшувало продукцію АФК, на що вказує зменшення виробництва сечової кислоти [68]. Оскільки товста кишка людини постійно зазнає дії різноманітних токсичних подразників, посилене вироблення бутирату в товстій кишці може призвести до посиленої стійкості проти токсичних подразників, що покращує бар’єрну функцію. Це може бути актуальним для лікування шлунково-кишкових розладів, таких як постінфекційний синдром подразненого кишечника (СРК), мікроскопічний коліт, ВЗК та диверсійний коліт.
Вплив на неспецифічні захисні механізми кишечника
Основними компонентами неспецифічних захисних механізмів кишкового бар’єру є слизовий шар, що покриває епітелій, вироблення антимікробних пептидів та щільні з’єднання, які захищають слизову оболонку шлунково-кишкового тракту від патогенних мікроорганізмів. Докази свідчать про роль бутирата у посиленні оборонного бар'єру товстої кишки. Бутират стимулює вироблення муцину MUC2 у клітинній лінії колоноцитів людини (LS174T). Підвищена експресія гена MUC2 та індукція синтезу муцину можуть впливати на слизовий шар, що призводить до посиленого захисту від просвічуючих агентів [69,70].
У поєднанні з іншими компонентами вродженої імунної системи антимікробні пептиди (АМФ) формують першу лінію захисту від інфекцій. Два основних класи АМФ, виявлені у людей, - це дефензини та кателіцидини. Хоча кишечник експресує численні дефенсини, LL-37 - єдиний пептид, що походить від кателіцидину, експресований у людей. Кілька досліджень продемонстрували вплив бутирату на експресію гена LL-37 і запропонували, що молекулярний механізм може бути пов'язаний із збільшенням ацетилювання гістону та сигналізації кінази, що активується мітогеном (MAP) [71-75]. Застосування інгібіторів HDAC, таких як бутират, для посилення експресії гена LL-37 може стати новим підходом для зміцнення вродженого імунітету для лікування або попередження кишкових інфекцій.
Бутират також регулює захисний бар'єр товстої кишки завдяки своєму впливу на проникність кишечника, що залежить від його концентрації. При низьких концентраціях бутират індукує залежне від концентрації оборотне зниження проникності на моделях клітинних клітинних ліній [76,77]. Вплив бутирату на проникність епітелію кишечника включає складання щільних з’єднань за допомогою АМФ-активованої протеїнкінази (АМФК) [78].
Вплив на вісцеральне сприйняття та перистальтику кишечника
Мало відомо про екологічну та харчову регуляцію кишкової нервової системи (ENS), яка контролює моторику шлунково-кишкового тракту. Бутират регулює гомеостаз слизової оболонки товстої кишки і може модулювати збудливість нейронів. Сорет та співавт. [79] досліджували вплив бутирату на ЕНС та рухливість товстої кишки та показали, in vivo та in vitro, що бутират значно збільшує частку холіну ацетилтрансферази (ChAT), але не синтази оксиду азоту (nNOS), імунореактивної міентеральної нейрони. Бутират підвищує холінергічну опосередковану реакцію скорочення кругової мускулатури товстої кишки ex vivo. Автори припускають, що бутират можна використовувати разом з підходами до харчування для лікування різних порушень моторики шлунково-кишкового тракту, пов'язаних із гальмуванням транзиту товстої кишки.
ЕФЕКТИ НА ВИНІШНОМУ РІВНІ
Гемоглобінопатії
Клінічні випробування на пацієнтах із серповидно-клітинною хворобою та β-таласемією підтвердили здатність бутирату збільшувати вироблення фетального гемоглобіну (HbF) [86-89]. Бутират є індуктором HbF через епігенетичну регуляцію експресії гена фетального глобіну за допомогою інгібування HDAC, що призводить до глобальної гіперацетилювання гістонів, включаючи нуклеосоми на промоторах γ-глобіну [90]. Інші експерименти показали, що бутират може спричинити швидке збільшення асоціації мРНК γ-глобіну з рибосомами [91]. Інші автори продемонстрували активацію р38 мітоген-активованих протеїнкіназ (MAPK) та циклічних нуклеотидних сигнальних шляхів у поєднанні з індукцією бутирату HbF [92]. У сукупності ці дослідження дозволяють припустити, що глобальна гіперацетиляція гістонів, індукована інгібуванням HDAC, не є унікальним механізмом, що лежить в основі бутиратної стимуляції HbF.
Генетичні метаболічні захворювання
Фенілбутират натрію 4 (4-PBA) був схвалений Управлінням з контролю за продуктами та ліками (FDA) для використання у пацієнтів з дефіцитом ферменту циклу сечовини, в якому він діє як поглинач аміаку. Дійсно, 4-PBA окислюється до фенілацетату, який зв'язується з глутаміном і визначає виведення із сечею. У пацієнтів з дефіцитом орнітину транскарбамілази використання 4-PBA дозволяє поліпшити метаболічний контроль та збільшити споживання природних білків у раціоні [93].
Також вивчалось можливе використання бутирату для лікування Х-зчепленої адренолейкодистрофії (X-ALD), розладу пероксисом, що характеризується зміною метаболізму та накопиченням дуже довголанцюгових жирних кислот. Фенілбутират натрію 4, in vitro на фібробластах у пацієнтів з X-ALD та in vivo у нокаутованих мишей X-ALD, збільшує β-окислення дуже довгих ланцюгів жирних кислот та проліферацію пероксисом [94].
Гіперхолестеринемія
За нормальних ліпідемічних умов печінка є найважливішим місцем біосинтезу холестерину, за яким слідує кишечник. Біосинтез у печінці та кишечнику становить приблизно 15% та 10% відповідно від загальної кількості біосинтезу холестерину щодня [95,96]. При гіперхолестеринемії, коли біосинтез холестерину в більшості органів пригнічується голодуванням, кишечник стає головним місцем біосинтезу холестерину, і його внесок може зрости до 50%. Важливо зазначити, що останні дані свідчать про те, що глобальний ефект бутирату полягає у зниженні рівня експресії дев’яти ключових генів, що беруть участь у біосинтезі холестерину в кишечнику, потенційно інгібуючи цей шлях [97].
Ожиріння та резистентність до інсуліну
Дієтичні добавки з бутиратом можуть запобігти та лікувати ожиріння, спричинене дієтою, та резистентність до інсуліну у моделей мишей. Після 5-тижневого лікування бутиратом миші з ожирінням втратили 10,2% від початкової маси тіла. Відповідно до зміни маси тіла вміст жиру зменшився на 10%. Крім того, глюкоза натще зменшилась на 30%, резистентність до інсуліну зменшилась на 50%, а толерантність до інтраперитонеального інсуліну значно покращилася за допомогою бутирату. Механізм дії бутирату пов'язаний із стимулюванням витрат енергії та індукцією функції мітохондрій. Як молекулярний механізм бутирату пропонується стимулювати активність коактиватора (PGC-1α), що активується проліфератором пероксисоми (PPG). Активація AMPK та інгібування деацетилаз гістону можуть сприяти регуляції PGC-1α. Ці дані свідчать про те, що бутират може мати потенційне застосування в профілактиці та лікуванні метаболічного синдрому у людей [98].
Ішемічний інсульт
ПРОБЛЕМИ, ПОВ'ЯЗАНІ З КЛІНІЧНИМ ВИКОРИСТАННЯМ БУТИРАТУ
Таблиця 2
Можливі терапевтичні показання бутирату в гастроентерології
- PLOS ONE Ефекти прямої ренінової блокади на нирки; Системна гемодинаміка та активність РААС, в
- Непротеїнова добавка калорій покращує дотримання дієти з низьким вмістом білка та корисні вправи
- Хвороби плеври Бостонський медичний центр
- Сіль у хлібі в Європі - потенційні переваги зменшення - Quilez - 2012 - Відгуки про харчування - Wiley
- Неінфекційні хвороби Гіпертонія