Постінфарктна дієта з високим вмістом жиру посилює функцію мітохондрій і не посилює дисфункцію лівого шлуночка
Анотація
жирні кислоти (ФК) є домінуючим джерелом енергії для серця дорослих ссавців, а також використовуються для біосинтезу мембран, генерування ліпідних сигнальних молекул, посттрансляційної модифікації білка та регуляції транскрипції (43). Хронічний вплив FA може призвести до дисбалансу між поглинанням та використанням FA, що потенційно може спричинити цитотоксичні механізми, що призводить до дисфункції клітин або смерті, явища, відомого як ліпотоксичність. Широкі клінічні дослідження та дослідження на тваринах показали, що надмірне накопичення ліпідів у нежирній тканині через посилену циркулюючу ФА може відігравати важливу роль у патофізіологічних станах, таких як серцева недостатність, ожиріння, резистентність до інсуліну та діабет (15, 43, 58).
Посилене накопичення ліпідів міокарда, схоже, пов'язане з порушенням скорочувальної функції міокарда. Однак вплив посиленого накопичення ліпідів та збільшення виробництва кераміду на функцію мітохондрій та їх супутній вплив на функцію шлуночків при патофізіологічних станах, таких як серцева недостатність, системно не оцінювались. Це дослідження було розроблене для перевірки гіпотези про те, що прогресування серцевої недостатності посилюється підвищеним рівнем ліпідів міокарда та пов'язаним з цим керамідом інгібуванням інгібування окисного фосфорилювання мітохондрій (зокрема, шляхом інгібування активності комплексу III). Ми перевірили свою гіпотезу на щурах, які харчувалися дієтою з високим вмістом насичених жирів після операції перев’язки коронарних артерій, щоб викликати серцеву недостатність.
Дизайн дослідження та індукції інфаркту міокарда.
Це дослідження було проведено відповідно до Посібник з догляду та використання лабораторних тварин, опублікована Національним інститутом охорони здоров’я (Публікація NIH № 85-23, переглянута 1996 р.) та схвалена Інституційним комітетом з догляду та використання тварин при Університеті Case Western Reserve Тварин утримували у зворотному режимі 12-годинного: 12-годинного циклу світло-темнота (тобто вимкнення світла о 6:00 ранку), а всі процедури та збирання тканин проводили натщесерцем між 3 і 6 год у темну фазу циклу.
На початковому етапі цього дослідження щурів годували нормальним чау (10% калорій з жиру, 20% з білка та 70% з вуглеводів) або дієтою з високим вмістом насичених жирів [60% з жирів (25% пальмітину, 33% стеаринової та 33% олеїнової кислот), 20% калорій з білка та 20% калорій з вуглеводів; Дієти дослідження] протягом 2 тижнів. Для індукції серцевої недостатності щурів знеболювали ізофлураном (1,5–2,0%), інтубували та провітрювали. Серцева недостатність була індукована лігуванням лівої головної коронарної артерії, як описано раніше (1). Як повідомляється в результатах, спостерігалася така помітна та значна хірургічна смертність у щурів, які отримували дієту з високим вмістом насичених жирів перед операцією лігування, що згодом дизайн дослідження був змінений таким чином, що всі щури залишались на нормальній дієті перед операцією лігування. Після індукції серцевої недостатності шляхом перев’язки коронарних артерій щурів випадковим чином розподіляли до будь-якої групи серцевої недостатності, яку годували нормальним харчуванням (СН)., n = 8) або група серцевої недостатності, яка харчувалася дієтою з високим вмістом насичених жирів (СН + СБ, n = 7) протягом 8 тижнів. Підроблені тварини (бутафорські; n = 8) годували нормальним харчуванням.
Ехокардіографія.
Функцію ЛШ оцінювали за допомогою ехокардіографії перед перев’язуванням коронарних артерій та 8 тижнів після перев’язки коронарних артерій за допомогою системи Sequoia C256 (Siemens Medical) з 15-МГц лінійним перетворювачем, як описано раніше (36). Коротко, щурам знеболювали 1,5–2,0% ізофлурану за допомогою маски, голили грудну клітку, тварину розташовували в лежачому положенні на грільній подушці та ставили електроди для кінцівок ЕКГ. Двовимірні (2D), 2D-керовані М-режими та доплерівські ехокардіографічні дослідження аортальних та трансмітральних потоків проводили через парастернальні та укорочені верхівкові вікна. Кінцеві діастолічні та кінцеві систолічні розміри вимірювали за допомогою програмного забезпечення, розташованого на ультрасонографі. Індекс працездатності міокарда та відсоток дробового вкорочення розраховували, як описано раніше (36).
Гемодинамічні вимірювання.
Через вісім тижнів після перев'язки коронарних артерій була проведена термінальна хірургічна процедура для оцінки тиску та скорочувальних властивостей ЛШ. Щурів знеболювали (1,5–2,0% ізофлурану), інтубували та провітрювали. Катетер датчика тиску мікротипу (3,5 Fr, Millar Instruments) вводили через праву сонну артерію в ЛШ. Вимірювання частоти серцевих скорочень, пікового систолічного тиску ЛШ та пікової швидкості підвищення та падіння тиску ЛШ (± dP/dт) були записані протягом 30-ти років за допомогою Digi-Med Heart Performance Analyzer-τ.
Підготовка мітохондрій.
Після канюляції ЛШ проби крові відбирали з нижньої порожнистої вени. ЛШ, правий шлуночок та рубцева маса були отримані за допомогою гравіметричних вимірювань. Зразок тканини міокарда (~ 100 мг) збирали і негайно швидко заморожували. Рубець і залишок ЛШ поміщали в KME (100 мМ KCl, 50 мМ MOPS, внутрішня сіль і 0,5 мМ EGTA). Серцеві підсарколеммальні (SSM) та міжфібрилярні (IFM) мітохондрії були виділені за методикою Palmer et al. (38) за винятком того, що модифікований буфер Чаппелла-Перрі (що містить 100 мМ KCl, 50 мМ MOPS, 1 мМ EGTA, 5 мМ MgSO4 · 7H2O та 1 мМ АТФ, рН 7,4 при 4 ° C) був використаний для виділення обох мітохондріальних популяцій. IFM збирали після обробки шкірних волокон 5 мг/г вологої маси трипсину протягом 10 хв при 4 ° C (35). Концентрацію білка в мітохондріях визначали методом Лоурі, використовуючи бичачий сироватковий альбумін як стандарт.
Мітохондріальне окисне фосфорилювання.
Мітохондріальна активність комплексу ETC.
Зразки SSM та IFM (10 мг холату/1 мг мітохондріального білка) змішували в 1 мл буфера [75 мМ манітолу, 220 мМ сахарози, 2 мМ ЕДТА та 5 мМ MOPS (pH 7,4)] з коктейлем інгібітора протеази ссавців (1 мкл/1 мл буфера) і витримували на льоду. Аналізи проводили в день підготовки.
Виявлення утворення H2O2.
Продукти метаболізму плазми та тканин.
Вміст C16-кераміду в ЛШ вимірювали методом капілярної газової хроматографії з детектором полум’яної іонізації, використовуючи C17-керамід як внутрішній стандарт, як описано раніше (51). Вміст тканинного вмісту TG вимірювали в гомогенатних екстрактах за допомогою методу ферментативного спектрофотометра (Wako Chemicals, Richmond, VA). Вільні жирні кислоти у плазмі та TG вимірювали за допомогою комерційно доступного ферментативного спектрофотометричного набору (39). Концентрацію інсуліну та лептину в плазмі крові аналізували за допомогою імуноферментного аналізу ELISA (ALPCO Diagnostics, Salem, NH).
Електронна мікроскопія.
Свіжоізольовані SSM та IFM були підготовлені для просвічувальної електронної мікроскопії, як описано раніше (16).
Статистичний аналіз.
Відмінності між групами фіктивних, СН та СН + СБ визначали за допомогою одностороннього дисперсійного аналізу, за яким слідував Бонферроні т-тести для кількох порівнянь. Дані виражаються як групові середні значення ± SE. Для всього статистичного аналізу значення було прийнято при P 2 -аналіз). З огляду на значно вищий рівень смертності у тварин, які харчувались насиченою жировою дієтою перед перев'язкою коронарних артерій, порівняно з тими, хто харчувався нормальною дієтою, групу, яка годувала високонасиченою жировою дієтою до перев'язки коронарних артерій, згодом було вилучено з дослідження через потенційне "упередження вижилих" у цій групі тварин.
Маса тіла та серця.
Харчування з високим вмістом насичених жирів, розпочате відразу після перев’язки коронарних артерій, збільшило масу тіла порівняно з фіктивними та СН (табл. 1). Загальна маса LV (маса LV + маса рубцевої тканини) була збільшена у HF + Sat порівняно з фіктивним; однак при нормалізації до маси тіла (загальної маси ЛШ/маси тіла) відмінностей між групами не було. Середня маса рубцевої тканини не відрізнялася між двома лігованими групами (HF і HF + Sat).
Таблиця 1. Маса тіла та серця у фіктивних, СН та СН + Сб 8 тижнів після операції перев’язки коронарних артерій
Значення є середніми ± SE. Підроблені, підставні тварини (n = 8); СН, група серцевої недостатності, яка харчується нормальним харчуванням (n = 8); HF + Sat; група серцевої недостатності, що харчувалася дієтою з високим вмістом насичених жирів (n = 7); ЛШ, лівий шлуночок.
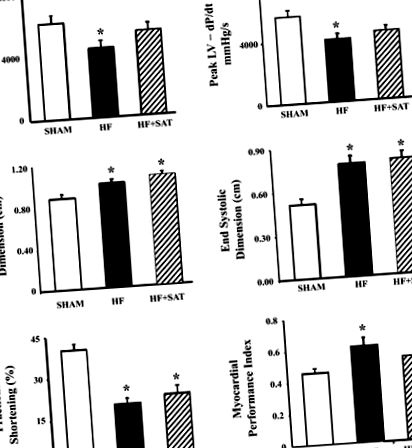
Рис. 1.Гемодинаміка лівого шлуночка (ЛШ) та ехокардіографічні вимірювання в групі, яку оперували фальшиво; n = 8), група серцевої недостатності, яка харчується нормальним харчуванням (СН; n = 8), а група серцевої недостатності харчувалася дієтою з високим вмістом насичених жирів (СН + СБ; n = 7). Пікова швидкість підйому та падіння тиску НН (± dP/dт) вимірювання отримували з датчика тиску Міллара. Ехокардіографічні вимірювання, включаючи кінцеві діастолічні та кінцеві систолічні розміри, відсоткове дробове вкорочення та показник ефективності міокарда, були отримані з парастернальних довгих та короткоосних оглядів. Значення є середніми ± SE. *P
Метаболічні субстрати: вільні жирні кислоти, TG, керамід, лептин та інсулін.
Безжирні жирні кислоти без плазми не змінювалися внаслідок серцевої недостатності або годування з високим вмістом жиру (табл. 2). TG плазми (табл. 2) та TG тканини міокарда (рис. 2) були збільшені у HF + Sat у порівнянні з фіктивними та HF. Подібним чином вміст C16-кераміду в тканині міокарда був підвищений у HF + Sat порівняно з фіктивним та HF (рис. 2). Вміст C16-кераміду також вимірювали в SSM та IFM; однак у 33% зразків SSM та 84% зразків IFM вміст кераміду був нижче рівня виявлення за допомогою газової хроматографії. Лептин у плазмі крові був підвищений у HF + Sat порівняно з підробленим та HF (таблиця 2). Рівні інсуліну в плазмі не відрізнялися (табл. 2).
Рис.2.Вміст тригліцеридів тканини міокарда та вміст C16-кераміду в тканинах у підробленому, HF та HF + Sat. Значення є середніми ± SE. *P
Таблиця 2. Без жирних кислот у плазмі, тригліцеридів, лептину та інсуліну в підробленому, HF та HF + Sat 8 тижнів після операції перев’язки коронарних артерій
Значення є середніми ± SE.
* P † P
Рис.3.Морфологічне порівняння підсарколеммальних (SSM) та інтерфібрилярних (IFM) мітохондрій у підставних, HF та HF + Sat за допомогою електронної мікроскопії. Лінія масштабу, вгорі ліворуч, що стосується всіх мікрофотографій, дорівнює 1 мкм.
Окисне фосфорилювання.
Вихід білка в SSM та IFM не змінювався внаслідок серцевої недостатності або годування з високим вмістом насичених жирів (табл. 3). Відновлення мітохондрій під час протоколу ізоляції також не відрізнялося між групами. Дихання стану 3 не було змінене серцевою недостатністю з використанням глутамату, DHQ або TMPD-аскорбату в якості дихальних субстратів. Однак із використанням глутамату та DHQ він був підвищений в обох мітохондріальних популяціях HF + Sat (таблиця 3).
Таблиця 3. Вихід білка та швидкість окисного фосфорилювання мітохондрій у SSM та IFM Sham, HF та HF + Sat 8 тижнів після операції перев’язки коронарних артерій
Значення є середніми ± SE. Частота дихання виражається як nAO · хв -1 мкг -1. SSM та IFM, підсарколеммальні та міжфібрилярні мітохондрії відповідно; DHQ, дурогідрохінон; TMPD, N,N,N′,N′ -Тетраметил-стор-фенілендіамін.
Таблиця 4. Комплекс електронно-транспортного ланцюга та активність мітохондріальних ферментів у SSM та IFM підроблених, HF та HF + Sat 8 тижнів після операції перев’язки коронарних артерій
Значення є середніми ± SE. Комплекс електронно-транспортного ланцюга та активність ферментів виражаються у нмоль · хв -1-1 мг мітохондріального білка -1, за винятком комплексу IV, який виражається як константа швидкості першого порядку (k, 1 · хв -1 мкг білка -1). Q, кофермент Q.
* P † P ‡ P = 0,058 проти фіктивного та ВЧ.
Активність цитрат-синтази була підвищена в SSM у HF + Sat порівняно з HF (таблиця 4). Підвищена активність не була зумовлена збільшенням вмісту білка в мітохондріях і не призвела до більшого збільшення дихання стану 3 (щодо IFM), а може просто відображати диференційні реакції SSM та IFM у хворих станах, як повідомлялося раніше (30) . Аконітаза була підвищена у HF + Sat у порівнянні з підробленою та HF у SSM та у HF + Sat у порівнянні з HF у IFM (Таблиця 4). Втрата або зменшення активності аконітази мітохондрій є внутрішньоклітинним показником окислювального ураження. Таким чином, підвищена активність актинізи в наших SSM та IFM свідчить про підвищену антиоксидантну здатність, що узгоджується з відсутністю збільшення виробництва H2O2 (див. Нижче).
Виробництво H2O2.
Продукція H2O2 у присутності ротенону не змінилася в SSM (673 ± 98, 677 ± 118 і 817 ± 76 пмоль · мг білка -1-1 30 хв -1) або IFM (658 ± 102, 719 ± 190, і 735 ± 55) фіктивного, HF та HF + Sat відповідно. Максимальне вироблення H2O2 у присутності антиміцину А не змінювалося внаслідок серцевої недостатності або годування з високим вмістом насичених жирів. Інгібування максимальної продукції H2O2 стигмателліном було однаковим у всіх групах.
Основний висновок цього дослідження полягає в тому, що вживання дієти з високим вмістом насичених жирів на моделі серцевої недостатності, спричиненої перев’язкою коронарних артерій, посилює окисне фосфорилювання мітохондрій та активність комплексу ETC. Крім того, вживання дієти з високим вмістом насичених жирів не вплинуло негативно на скорочувальну функцію ЛШ або прогресування ремоделювання ЛШ. Незважаючи на підвищення рівня кераміду міокарда, не було доказів ліпотоксичного ефекту ні на скорочувальну, ні на мітохондріальну функцію.
Іншим потенційним поясненням відсутності ліпотоксичності у цьому дослідженні є антиліполітична дія лептину. Існує припущення, що основна фізіологічна роль лептину полягає у запобіганні накопиченню FA у нежирних тканинах, таких як скелетні м’язи, печінка, підшлункова залоза та серце (52). У мишей з важкою ліпотоксичною кардіоміопатією, індукованою трансгенним шляхом кардіоміоцитоспецифічної надмірної експресії ацил-КоА-синтази, підвищення рівня лептину в плазмі повністю запобігало розширеній кардіоміопатії, підвищенню запасів ТГ міокарда та гіпертрофії кардіоміоцитів (27). Подібним чином, під час ожиріння, спричиненого дієтою, гіперлептинемія захищала неадипоцити від стеатозу та ліпотоксичності (28). Однак важливо зазначити, що рівні лептину в плазмі, про які повідомляється в цих дослідженнях, набагато перевищують рівні, зареєстровані в нашій групі HF + Sat. Таким чином, відсутність ліпотоксичності у нашій групі серцевої недостатності, яка харчується дієтою з високим вмістом насичених жирів, може частково пояснюватися підвищенням рівня лептину в плазмі крові, який може діяти кардіопротективно.
Склад ФА також може відігравати певну роль у функціонуванні мітохондрій через диференційований вплив насичених та ненасичених жирів. Попередні дослідження, проведені in vitro, чітко показали, що довголанцюгові насичені ФА беруть участь у ліпотоксичних шляхах, що ведуть до кардіоміопатії, тоді як моно- та поліненасичені ФА - ні (32, 46). У цих дослідженнях було показано, що насичений довголанцюговий пальмітат FA викликає апоптоз, цитохром c вивільнення, активація каспази та сходи ДНК - усі маркери клітинної загибелі. Однак насичені ФА також стимулюють окислення мітохондрій у щурів, тоді як мононенасичені ФА не мали ефекту (14). Подібним чином, ненасичені ФА пов'язані з більшим ліпопероксидуванням (8), роз'єднанням мітохондрій та утворенням активних форм кисню (7) у порівнянні з насиченим ФА. Таким чином, необхідні подальші дослідження для з'ясування механізмів, відповідальних за ці диференціальні ефекти насичених і ненасичених ФА, особливо щодо їх впливу на мітохондріальне дихання та діяльність комплексу ETC.
Підводячи підсумок, незважаючи на попередні припущення про прямий зв’язок між ліпотоксичними проміжними сполуками та скорочувальною дисфункцією ЛШ, наші результати чітко показують, що годування з високим вмістом насичених жирів після перев’язки коронарних артерій не посилювало дисфункції та реконструкції ЛШ на момент обстеження. Крім того, введення дієти з високим вмістом насичених жирів у моделі серцево-судинної недостатності, спричиненої лігуванням, посилювало окисне фосфорилювання мітохондрій та активність комплексу ETC. Відсутність ліпотоксичного ефекту, що збігається з підвищенням рівня кераміду міокарда, було несподіваним результатом цього дослідження, що вимагає подальшого дослідження. У майбутніх дослідженнях також слід вивчити, чи спостерігаються ефекти високонасиченого жиру на скорочувальну функцію мітокарда та мітохондрії в умовах контролю, а не унікальні для моделей травм, таких як серцево-судинна недостатність, спричинена перев’язками, або на пізніх стадіях прогресування серцевої недостатності.
Цю роботу підтримали Американська асоціація серця - Національний офіс, Грант розвитку вчених 0535361N (депутату Чендлеру) та Національний грант Інституту серця, легенів та крові HL-081857 (депутату Чендлеру) та PO1-HL-074237 (CL Hoppel ).
СНОПКИ
Витрати на публікацію цієї статті були частково сплачені за рахунок оплати сторінок. Тому стаття має бути позначена цим «реклама”Відповідно до 18 U.S.C. Розділ 1734 виключно для зазначення цього факту.
Ми вдячні доктору Бернарду Тандлеру зі Стоматологічної школи університету Кейс Вестерн Резерв за редакційну допомогу та Рейчел Флойд з Дослідницького центру ветеранських справ Луїса Стокса за допомогу в підготовці рисунку електронної мікроскопії. Автори також дякують Хейзел Хуанг за допомогу в проведенні біохімічного аналізу.
- Відсутність FFAR1GPR40 не захищає мишей від цукрового діабету, викликаного дієтою
- Чи є мальтодекстрин кето і чи містять вуглеводи, ось чому його слід уникати на дієті кето; Ліворуч
- Як дієта з високим вмістом жиру сприяє раку підшлункової залози Блог журналів AGA
- Як корпоративний контроль нашої дієти зробив Великобританію вразливою для Covid-19 Left Foot Forward
- Як дієта може допомогти вилікувати прищі Що говорить Аюрведа