Поняття пам’яті скелетних м’язів: Докази досліджень на тваринах та людях
Тім Снайдерс
1 Кафедра біології людини Школи харчування та трансляційних досліджень метаболізму NUTRIM, Маастрихтський університет, Маастрихт, Нідерланди,
Торбен Aussieker
1 Кафедра біології людини Школи харчування та трансляційних досліджень метаболізму NUTRIM, Маастрихтський університет, Маастрихт, Нідерланди,
Енді Холверда
1 Кафедра біології людини Школи харчування та трансляційних досліджень метаболізму NUTRIM, Маастрихтський університет, Маастрихт, Нідерланди,
Джанні Паризе
2 Кафедра кінезіології, медичної фізики та прикладних радіаційних наук, Університет Макмастера, Гамільтон, Канада,
Люк Дж. К. ван Лун
1 Відділ біології людини Школи харчування та трансляційних досліджень метаболізму NUTRIM, Маастрихтський університет, Маастрихт, Нідерланди,
Пов’язані дані
Анотація
1. ВСТУП
2. ПОТОЧНІ ДОКАЗИ З ВИВЧЕННЯ ТВАРИН
ТАБЛИЦЯ 1
Зміни міоядерного вмісту та апоптозу у відповідь на різні моделі атрофії м’язів у гризунів
механічне розвантаження/блокування нервового імпульсу
механічне розвантаження/блокування нервового імпульсу
У цій таблиці наведено огляд досліджень, які оцінювали зміну міоядерного вмісту та присутності (міо) ядерного апоптозу у відповідь на різні моделі атрофії м’язів у тварин. Дослідження організовуються за допомогою аналітичної техніки для оцінки вмісту (міо) ядер, апоптозу або того й іншого. EDL, розгинач великого пальця м’яза; FHL, flexor hallucis longis; Золь, підошва м’яз; План, подошвенний м’яз; ТА, великогомілковий м’яз передньої м’язи; Гази, шлунково-м’язовий м’яз; Grac, м'яз грацилісу.
2.1. Потенційна зміна парадигми
2.2. М’язова пам’ять за міоядерною постійністю
2.3. Обмеження моделей тварин
30%) у плантаріальному м’язі після перших 8 тижнів вправ. Протягом наступних 12 тижнів детренінгу як розмір м’язових волокон, так і вміст міоядерних речовин повернулися до початкового рівня. 40 Міоядерний вміст оцінювали як на одиничних м’язових волокнах, так і на поперечних перерізах м’язів, в яких клітини м’язових супутників виключали із кількості міоядерних клітин. На жаль, в це дослідження не було включено остаточну «перекваліфікацію», а також вимірювання апоптозу. 40 Чи можна пояснити ці суперечливі висновки щодо втрати міоядерного вмісту під час детренінгу моделлю, що застосовується для індукції гіпертрофії м’язових волокон та нарощування міоядер, або будь-якими іншими різницями, пов’язаними з дослідженнями, залишається подальшим встановленням.
Незважаючи на ці розбіжності щодо парадигми м'язової пам'яті у більш фізіологічній ситуації гіпертрофії та атрофії м'язових волокон, кінцевою метою було перевести спостереження за м'язовою пам'яттю в ситуацію in vivo у людини. Таким чином, критично важливо, щоб ці та інші результати обговорювались у світлі спостережень, зроблених в експериментальних випробуваннях, проведених на людях.
3. ДОКАЗИ З ЛЮДИНИ
20%) протягом 7 днів після повного заспокоєння. 83 Загальну відсутність консенсусу між дослідженнями можна пояснити частково різницею в серйозності застосованої моделі фізичної неактивності (наприклад, абсолютність, тривалість), що призводить до різниці в спостережуваній атрофії м'язів. Крім того, вміст міоядерних речовин в дослідженнях на людях майже виключно оцінюється за допомогою поперечних перерізів м’язів, які можуть мати, як обговорювалося раніше, обмежену здатність точно виявляти незначні зміни міоядерного вмісту з часом. Однак дослідження, проведені в нашій лабораторії 76, 77, 78, 83, а також інших 80, 81, 82, здається, свідчать про те, що міонуклеуси не втрачаються у великих кількостях після атрофії м'язових волокон, спричиненої короткочасною фізичною бездіяльністю.
3.1. Співвідношення розміру м’язової клітковини до міоядерного числа у людини
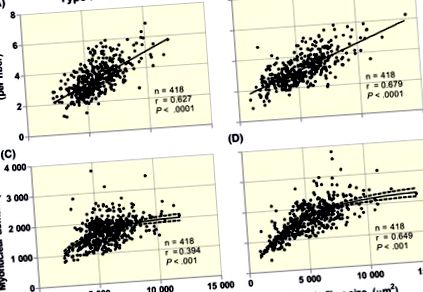
Кореляційний аналіз між розмірами м’язових волокон типу I та II та кількістю міоядер у волокні (A та B; лінійне співвідношення) та розміром міоядерного домену (C та D; логарифмічне співвідношення) у зразках черезшкірної біопсії, взяті з vastus lateralis здорових дорослих дорослих чоловіки (n = 330) та жінки (n = 88). Всі зразки відбирали у суб'єктів, які перебувають у стані спокою після нічного голодування. Розмір м’язових волокон та міоядерний вміст визначали за допомогою імунофлуоресцентної мікроскопії поперечних зрізів м’язів. Фарбування включало антитіла до ламініну (клітинна межа), MHCI (м’язові волокна типу I), Dapi (ядра), Pax7 або NCAM (супутникові клітини). Клітина Dapi + вважалася міонуклеусом, коли щонайменше 50% фарбування було присутнім у м’язовому волокні, виявленому за допомогою фарбування ламініном. М’язові клітини-супутники ідентифікували за допомогою фарбування Pax7 або NCAM і виключали з міоядерних показників. Для достовірної оцінки міоядерного вмісту було включено принаймні 100 м’язових волокон типу I та 100 типу II на кожного суб’єкта
3.2. Довготривала міоядерна стійкість у людини
У теоретичних рамках м’язової пам’яті передбачається, що міонуклеуси зберігаються протягом тривалого періоду часу, а може навіть необмежено довго. Згодом це може представляти біологічну перевагу, коли потрібно відновити базовий розмір м’язових волокон після періоду втрати м’язової маси, спричиненого невикористанням. Перехресні дослідження на людях надають додаткові докази, які потенційно заперечують думку про невизначену міоядерну ретенцію протягом усього життя. Наприклад, ми показали, що розміри м’язових волокон типу I та II, а також вміст міоядерних речовин істотно нижчі у сильно атрофованих м’язів хворих, які постраждали від спинного мозку
ТАБЛИЦЯ 2
Вплив віку на характеристики м’язових волокон у людини
- Тренування на біговій доріжці втрачає жир і формує м’язи
- Навіщо їсти рослини ЗДОРОВ'Я; БУДІТЬ ТВАРИНА стійкість та освіта Індія
- Ланцюги тваринних продуктів харчування на трофічних рівнях - RSPB
- Дієта для ідеального нарощування м’язової маси 3400 калорій пісного об’ємного харчування Стратегія втрати жиру
- Чому мене не лякають штучні підсолоджувачі, що руйнують м’язи