Програми перинатального харчування на довгострокову нейроімунну функцію: механізми та наслідки
Анотація
Харчове середовище на початку життя може впливати на кілька аспектів фізіології, включаючи схильність до ожиріння. Зараз є докази, що перинатальна дієта може також самостійно впливати на розвиток нашої вродженої імунної системи. Цей огляд стосуватиметься трьох необов’язково виключних механізмів, за допомогою яких перинатальне харчування може довгостроково програмувати нейроімунні функції: шляхом схильності людини до ожиріння, шляхом зміни мікробіоти кишечника та індукції епігенетичних модифікацій, які змінюють транскрипцію генів протягом усього життя.
Вплив перинатальної дієти на розвиток імунної системи
Імунна система новонародженої тварини відносно наївна, і вплив зовнішнього середовища необхідний, щоб вона могла набути повноцінної роботи. Ранній вплив патогенних мікроорганізмів виробляє адаптивний (Флажник та Касахара, 2010) та вроджений (Galic та ін., 2009; Спенсер та ін., 2011) імунітет, який полегшить відповідні реакції на додаткові патогени протягом усього життя. Однак зараз є докази того, що дієта раннього віку життя також має вирішальне значення при програмуванні довгострокової імунної функції.
Конкретні поживні речовини в перинатальній дієті впливають на розвиток імунної системи
Перинатальна дієта впливає на розвиток імунної системи через мікробіоти кишечника
Одним із механізмів, за допомогою якого певні поживні речовини в ранній дієті можуть впливати на імунну систему дорослих, є вплив на розвиток, різноманітність та функцію мікробіоти кишечника. У людей в шлунково-кишковому тракті мешкає понад 100 трильйонів бактерій, що складаються з понад 1000 видів (Qin et al., 2010). Він також містить численні віруси, археї, паразити та гриби, які разом складають мікробіоти кишечника (Ashida et al., 2012). Ця мікробіота існує у симбіотичному взаємозв’язку з господарями людини і може впливати на бар’єрну функцію, трофічні ефекти, метаболізм та розвиток адаптаційної та вродженої імунної системи (Matamoros et al., 2013).
На мікробіом кишечника дорослої людини можуть впливати довгострокові зміни факторів навколишнього середовища. Хільдебрандт та його колеги показали, що годування з високим вмістом жиру (HFD) може впливати на зміну складу мікробіоти кишечника у бік збільшення кількості Firmicutes та протеобактерій та зменшення кількості Bacteroidetes phyla у самок мишей (Hildebrandt et al., 2009). Хоча ці зміни не залежали від ожиріння, інші групи продемонстрували, що дієта з високим вмістом жиру і високим вмістом цукру спонукає до збільшення ожиріння, і цей фенотип може передаватися спочатку нежирним (нормальним раціоном) тваринам шляхом трансплантації мікробіоти (Turnbaugh et al., 2008). Більшість доказів, однак, свідчать про те, що флора кишечника дорослої людини є дуже стабільною, і короткочасний вплив навколишнього середовища в зрілому віці має обмежений ефект (Wu et al., 2011). Немовля, навпаки, не народжується з усталеним мікробіомом кишечника. Швидше за все, кишечник колонізується з бактерій у навколишньому середовищі в перші години до днів життя, і мікробіом набуває різноманітності і стає стабільним і схожим на дорослих приблизно до 3-річного віку (Mackie et al., 1999; Palmer et al., 2007). Зокрема, дієта людини під час ранньої фази колонізації може бути надзвичайно важливою для визначення подальшого складу мікробіоти кишечника.
Перинатальна дієта впливає на розвиток імунної системи шляхом епігенетичних модифікацій
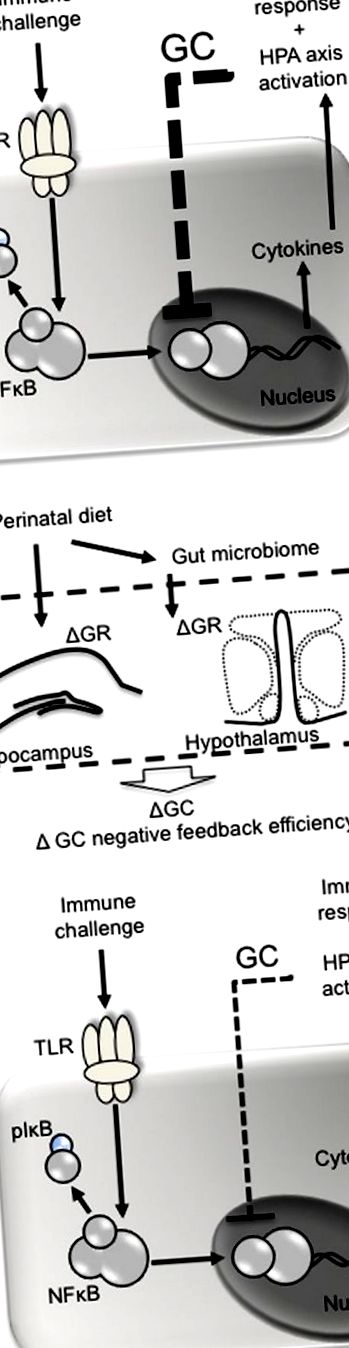
Перинатальна дієта може впливати на негативні відгуки глюкокортикоїдів після імунної проблеми. (A) Такі патогени, як ліпополісахарид, діють на платоподібні рецептори (наприклад, TLR4) на імунні клітини, що призводить до фосфорилювання інгібуючого фактора (I) κ B, вивільняючи ядерний фактор (NF) κ B зі свого комплексу і дозволяючи йому перенестись у ядро . NKκ B відповідає за транскрипцію про- та протизапальних цитокінів, перші з яких стимулюють циклооксигеназну 2-опосередковану конверсію арацидонової кислоти в простагландини. Простагландини (наприклад, PGE2) діють на мозок, стимулюючи гарячку та хворобу та набираючи вісь HPA. Після вивільнення глюкокортикоїди (GC) негативно подають назад, щоб інгібувати подальшу NFκ B-опосередковану транскрипцію цитокінів. (B) Перинатальна дієта може впливати на негативний зворотний зв'язок з глюкокортикоїдами, змінюючи експресію глюкокортикоїдних рецепторів (GR) в гіпокампі та гіпоталамусі, що призводить до менш ефективного опосередкованого глюкокортикоїдами інгібування NFκ B та посилення імунної відповіді.
Вплив перинатального харчування на ожиріння — пов’язане з розвитком імунної системи
Дієтичні фактори в ранньому віці явно мають вирішальний вплив на розвиток імунної системи. Друга половина цього огляду буде зосереджена на тому, як ранній спосіб харчування може запрограмувати прозапальний базальний імунний профіль, попередньо схиляючи людину до фенотипу ожиріння.
Ожиріння стає величезною проблемою у всьому світі. У розвинених країнах, таких як Австралія та США, 70–74% дорослих чоловіків та 56–64% дорослих жінок зараз мають або надлишкову вагу, або ожиріння, причому 28% обох класифікуються як ожиріння (ІМТ> 30). До 25–32% австралійських та американських дітей класифікуються як люди з надмірною вагою або ожирінням (Cretikos et al., 2008; Nhanes, 2009-2010; AHS, 2011-2012).
Перинатальне харчування може запрограмувати вагу та метаболізм дорослих, що призводить до жирозалежних змін імунної функції
Само ожиріння, чи то через метаболічні зміни, запрограмовані в ранньому віці, чи через фактори дорослого населення, пов’язане зі змінами профілю запалення. В даний час визнано, що ожиріння асоціюється з хронічним низькоякісним системним та місцевим запаленням, яке може навіть спричинитися (Gregor and Hotamisligil, 2011). Це метаболічне запалення може сприяти резистентності до інсуліну та лептину на різних рівнях, включаючи гіпоталамус (Thaler and Schwartz, 2010).
Дієтичні фактори, такі як ПНЖК та глюкоза, а також зміни мікробіоти кишечника здатні викликати хронічний низькоякісний запальний профіль спочатку в білій жировій тканині (ВАТ). Ця зміна характеризується інфільтрацією макрофагів у ВАТ, апоптозом та некрозом адипоцитів та зниженням судинності (Shu et al., 2012). Ці зміни призводять до аномальної переваги макрофагів жирової тканини, і вони можуть становити майже 40% клітин ожиріної жирової тканини (Weisberg et al., 2003; Xu et al., 2003). Макрофаги жирової тканини та потенційно збільшення рецепторів розпізнавання образів на самих адипоцитах призводять до місцевого запалення з переважанням прозапальних над протизапальними цитокінами (Shu et al., 2012). Хотаміслігіл та його колеги на початку показали, що в деяких моделях ожиріння гризунів значно збільшується експресія фактора некрозу прозапальної цитокінової пухлини (TNF), і що нейтралізація TNFα може покращити чутливість до інсуліну у цих тварин (Hotamisligil et al., 1993, 1995; Уйсал та ін., 1997). Прозапальний профіль жирової тканини призводить до викиду в циркуляцію цитокінів, адипокінів та жирних кислот, які впливають на печінку, м’язи та мозок і, зрештою, сприяють резистентності до інсуліну (Shu et al., 2012).
В результаті цих змін у профілі запалення, люди з ожирінням порушили імунну функцію і частіше помирають від гострої інфекції, ніж люди з нормальною вагою (Falagas and Kompoti, 2006). Наприклад, надмірне збільшення маси тіла відразу після народження схиляє немовлят до атопії та хрипів (Pike et al., 2010). Пацієнти з ожирінням загалом також вдвічі частіше помирають в реанімації через ускладнення, пов’язані з інфекцією, ніж пацієнти із нормальною вагою (Falagas and Kompoti, 2006).
Деякий час було ясно, що харчування на ранніх стадіях життя може запрограмувати ріст і може впливати на розвиток центральних шляхів, що забезпечують харчування та метаболізм (Spencer, 2012). Діти, народжені від матерів із надмірною вагою або ожирінням, значно частіше мають надмірну вагу або ожиріння (Dabelea et al., 2000; Ruager-Martin et al., 2010), а також діти, народжені від матерів, які вживали дієту з нездоровою їжею з високим вмістом жиру вагітні мають більш високий рівень жиру в організмі під час народження, незалежно від того, чи ожиріли матері під час вагітності (Albuquerque et al., 2006; Srinivasan et al., 2006; Ashino et al., 2012). З цим надлишком жиру в тілі пов’язані такі показники метаболічного синдрому, як гіперінсулінемія та резистентність до інсуліну (Dabelea et al., 2000; Boney et al., 2005; Sewell et al., 2006; Catalano et al., 2009).
Парадоксально, але діти, які недоїдали внутрішньоутробно, також частіше розвивають ожиріння та пов'язані з цим метаболічні порушення (Спенсер, 2012). По-перше, внутрішньоутробні фактори, які призводять до того, що дитина народжується маленьким, можуть також змінювати її метаболічні шляхи, щоб стимулювати накопичення енергії, коли їжа доступна (Vickers et al., 2000, 2003; Bellinger et al., 2004; Bellinger and Langley -Еванс, 2005). По-друге, переважною практикою з малими дітьми для гестаційного віку є програма інтенсивного годування для заохочення відповідного розвитку мозку та легенів (Lubchenco та співавт., 1972a, b; Брандт та ін., 2003), і це також наздоганяє зростання в постнатальному періоді. схиляє людину до ожиріння (Ong et al., 2000, 2006; Brandt et al., 2003; Desai et al., 2005).
Важливість цих висновків відображається у статистиці, яка показує, що діти із надмірною вагою значно частіше мають надмірну вагу у дорослих, ніж у дітей із нормальною вагою. Як вже згадувалося, надмірне збільшення ваги на першому тижні життя збільшує довгостроковий ризик ожиріння (Stettler et al., 2005). Крім того, у порівнянні з дітьми з ІМТ нижче 50-го процентилю, у дітей від 50 до 74-го процентиля ІМТ приблизно в п’ять разів частіше виникає надмірна вага у дорослих (Baird et al., 2005; Field et al., 2005; Druet et al. ., 2012).
Перинатальне харчування може запрограмувати зміни в імунній функції, які не залежать від ожиріння
З цих досліджень можна зробити висновок, що існує очевидний зв’язок між ранніми життєвими подіями, що програмують підвищену схильність до ожиріння та саме ожиріння, що призводить до базального профілактичного профілю та сприйнятливості до інфекції. Однак очевидно, що надмірна вага в ранньому віці може мати незалежний та складний вплив на запальний профіль у дорослому віці.
Цікаві докази тривалого впливу дієти на ранніх термінах життя на імунну систему дорослих надходять від осіб, які недоїдали внутрішньоутробно або ще немовлятами і не страждали ожирінням. Таким чином, дослідження трьох сільських сіл в Гамбії показало, що суб'єкти значно частіше помирали від інфекційних хвороб у зрілому віці, якщо вони народилися під час виснажуючого харчування "голодного" сезону липня-грудня, ніж у січні-червні, коли їжі було багато ( Мур та ін., 1999). Було також показано, що перинатальна дієта з обмеженим вмістом калорій впливає на активацію макрофагів у зрілому віці, так що дорослі щури, які недоїдали під час лактації, мали менше альвеолярних макрофагів, і вони виділяли менше оксиду азоту у відповідь на виклик флуоксетину (Ferreira et al., 2009). Подібним чином у дорослих щурів, які недоїдали під час лактації, не спостерігалося зміни імунних параметрів після імунної атаки ні в умовах контролю, ні під впливом удару, тоді як у контрольних щурів (нормальна дієта під час лактації) підвищений вміст лейкоцитів і титри антитіл (Barreto-Medeiros et al. ., 2007). Ці дані припускають, що недоїдання новонароджених може призвести до менш реактивної або менш ефективної імунної відповіді.
Є також деякі докази того, що тварини, що страждають ожирінням внаслідок перинатальної дієти, можуть мати зміни в нейроімунній функції в подальшому житті, які не залежать від ожиріння як такого. Зараз кілька груп показали щурів, які висмоктують невеликі посліди, де вони мають більший доступ до молока дамби, швидше набирають вагу і підтримують більшу масу тіла у зрілому віці (Plagemann et al., 1999; Schmidt et al., 2001; Morris et al. ., 2005; Rodel et al., 2008). Ми показали, що у цих щурів із надмірною вагою, як самців, так і самок, значно посилюється нейроімунна реакція на ЛПС. Ця відповідь класифікується за посиленою активацією NFκ B у щурів із надмірною вагою, більшою кількістю циркулюючих протизапальних цитокінів та більшими температурами (Clarke et al., 2012).
Важливо, що існують деякі принципові відмінності між змінами нейроімунної функції у щурів із надмірною вагою внаслідок перегодовування на ранніх термінах життя та у щурів із надмірною вагою через годування HFD у дорослому віці. По-перше, у новонароджених перегодованих щурів немає профілю базального запалення. Немає відмінностей у концентрації базальних циркулінів циркукінів, що циркулюють у грудях, що висмоктуються невеликими послідами (надмірна вага) та тими, які висмоктуються в контрольних послідах (Clarke et al., 2012). Як обговорювалося вище, кілька досліджень показали, що люди з ожирінням (Hak et al., 1999; Yudkin et al., 1999) та гризуни (Hotamisligil et al., 1993) мають підвищений рівень циркулюючих прозапальних цитокінів у нестимульованих умовах, що відображає прозапальний профіль. Ця різниця може бути результатом ступеня ожиріння, харчового складу та/або того, що перинатальне перегодовування здатне підготувати систему, щоб показати надмірно активну реакцію на імунну реакцію, не впливаючи на базальний запальний профіль (Pohl et al., 2009).
Як і у випадку з TLR4, збільшується експресія TLR3 в жировій тканині щурів, що перегодовується новонародженими (Clarke et al., 2012). Однак, на відміну від людей із ожирінням у дорослих (MMWR, 2009; Fuhrman et al., 2011) та дорослих гризунів, що харчуються HFD (Smith et al., 2007), імунна відповідь на ліганд TLR3 не змінюється у щурів страждають ожирінням через перегодовування новонароджених (Clarke et al., 2012). Можливим поясненням диференціального впливу на сигналізацію TLR4 та TLR3 є місце розташування рецептора, причому TLR4 зв’язаний з мембраною, а TLR3 інтерналізований (Kumar et al., 2009; Konner and Bruning, 2011). Таким чином, хоча ожиріння в цілому може збільшити експресію TLR3, індуковане перинатально ожиріння може не викликати відповідних змін у транспорті ліганду в клітину. Для пацієнта це може означати програмування ожиріння на ранніх термінах життя, яке може бути пов'язане з певним видом захисту від вірусної інфекції порівняно із ожирінням у дорослих.
Перинатальне перегодовування, на відміну від ожиріння у дорослих, також може посилювати імунні реакції незалежно від поведінки хвороби. Як правило, імунна відповідь викликає різноманітну поведінку хвороби на додаток до прозапальних та фебрильних змін. Сюди входять анорексія, млявість, депресія, зниження активності, втрата лібідо (Dantzer and Kelley, 2007). Незважаючи на те, що у перинатально перегодованих щурів спостерігається типова прояв хворобливої поведінки з ЛПС, це не посилюється у цих тварин, оскільки прозапальні та гарячкові реакції є (Clarke et al., 2012). На відміну від цього ожиріння у дорослих сильно пов’язане зі збільшенням поведінки при хворобі порівняно з худими дорослими (Lawrence et al., 2012). Деякі аспекти поведінки при хворобі, можливо, будуть опосередковані централізовано. Наприклад, лептин є важливим модулятором анорексії, асоційованої з інфекцією (Luheshi et al., 1999), а лікування лептином проти сироватки може повернути індуковану LPS анорексію (Sachot et al., 2004; Harden et al., 2006 ). Реакції лептину на ЛПС є подібними у новонароджених і годуючих щурів, незважаючи на виражені відмінності в інших цитокінах, що потенційно полегшує подібні реакції на хворобу (Clarke et al., 2012).
Поки незрозуміло, що ця відсутність загостреної реакції на хворобу після перинатального перегодовування означала б для людини. З одного боку, суб'єкт, ймовірно, буде стійким до почуття нездужання, пов'язаного з імунною проблемою, незважаючи на посилення прозапальної та гарячкової реакції, що дозволяє їм продовжувати життя як зазвичай, коли хворіє. З іншого боку, поведінка при хворобі дуже важлива для сприяння абстиненції, тому ресурси організму повністю доступні для ефективної боротьби з інфекцією (Carlton et al., 2012).
Гіпоталамо-гіпофізарно-надниркова вісь
Статевий диморфізм у перинатальному харчовому програмуванні імунної функції
Короткий зміст та перспективи майбутнього
Подяки та джерела фінансування
Ця робота була підтримана грантом проекту Discovery від Австралійської дослідницької ради (ARC) Сарі Дж. Спенсер (DP109339) та грантом проекту від Національної ради з питань охорони здоров’я та медичних досліджень (NHMRC) доктору Зейну Ендрюсу та Сарі Дж. Спенсер ( APP1011274). Сара Дж. Спенсер - майбутній науковий співробітник ARC (FT110100084) та старший науковий співробітник університету RMIT.
Заява про конфлікт інтересів
Автор заявляє, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
- Харчування при оцінці життєвого циклу продуктів - функція чи вплив SpringerLink
- Огляд програм харчування - Національний центр сільського господарства
- Програми харчування у громаді
- Програми харчування
- Національні програми харчування, громадського здоров'я Голод і здоров'я