Папаверинова ад’ювантна терапія при порушенні мікроциркуляції крові при важкому виразковому коліті, ускладненому інфікуванням ЦМВ: повідомлення про випадок
Анотація
Передумови
Виразковий коліт (ГК) має гіперкоагулюючий стан, збільшується ризик тромбоутворення. Це свідчить про те, що утворення мікротромбозів може бути одним із важливих патогенезів УК [1]. Особливо у пацієнтів з важким активним UC, підслизовий тромбоз часто виявляють при патологічному дослідженні, а капілярний мікротромбоз також можна спостерігати там, де запалення не є очевидним [2]. Є дані, що активація згортання може в свою чергу опосередковувати та посилювати запальні каскади при запальних захворюваннях кишечника (ВЗК) [3]. Лікування UC низькомолекулярним гепарином (НМГ), який має антикоагулянтну дію, може покращити клінічні симптоми [4]. Подібні висновки спостерігалися на моделях коліту на тваринах з вазодилататором папаверином (PAP) [5]. Важливо визначити зміни кровотоку слизової, пов’язані з хронічним запаленням.
Індукований декстріном сульфатом натрію (DSS) коліт був однією з класичних моделей тварин на UC. Деякі дослідження показали, що введення DSS викликало порушення капілярних судин до появи пошкодження епітеліальних клітин. Отже, порушення мікроциркуляції слизової оболонки було визнано тригерами коліту, спричиненого DSS [6]. Так само, як і на тваринних моделях коліту, у хворих на ВЗК у запаленій ділянці спостерігався великий ангіогенез та реорганізація мікроциркуляції [7]. Ішемічний стан сприяв додатковому рекрутингу запальних клітин та підтримував запальну реакцію [8].
У цьому випадку на основі адекватного лікування UC виявлено порушення мікроциркуляції слизової оболонки шляхом конфокальної лазерної ендомікроскопії (CLE), а терапія папаверином (PAP) досягла значного ефекту.
Презентація справи
56-річна пацієнтка була госпіталізована через неперервно слизовий кров'янистий стілець більше 1 року та загострення з лихоманкою протягом 1 місяця. Більше 1 року тому (квітень 2017 р.) Слизовий рідкий та кров’янистий стілець з’являвся у пацієнта тричі на день без температури, втоми, висипу та болю в суглобах. UC діагностували за допомогою колоноскопії та патологічного обстеження. Потім месалазин давали по 2 г щодня протягом 2 тижнів, і симптоми швидко покращувались. Через місяць симптоми хворого повністю полегшили, а месалазин припинили.
За п’ять місяців до того, як симптоми прийому повторились (лютий 2018 р.), UC E3 знову діагностували за допомогою колоноскопії. Симптоми повністю полегшуються після терапії 3 г месалазину плюс 0,5 г супозиторію месалазину щодня протягом приблизно 1 місяця.
За місяць до прийому, коли пацієнт виїжджав у подорож і припиняв вживати месалазин, стілець слизової крові поступово збільшувався до більш ніж 20 разів на день, темно-червоний стілець крові, коли симптом ставав серйозним, супроводжувався болем внизу живота перед дефекацією, загальною слабкістю, втрата апетиту та втрата ваги на 10 кг протягом 1 місяця. За ці дні інших спеціальних ліків не було, висипань не з’являлося. Лабораторне обстеження показало нормальну функцію печінки та нирок, але СРБ та ШОЕ були значно підвищені - 93,23 мг/л та 50 мм/год, а Hb та Alb, очевидно, знизились до 99 г/л та 26,1 г/л. КТ живота показала потовщення цілої стінки товстої кишки, особливо з лівого боку. Лихоманка сталася за 2 дні до прийому при максимальній температурі 38 ° C. У пацієнта немає особливого захоплення та сімейної історії. Гістероміомектомія була проведена 11 років тому, і на той момент КТ виявила кальцифікацію лівої нирки.
При вступі, Т 37,2 ° С, Р 92 ударів за хвилину, поверхневі лімфатичні вузли не збільшені. Серцево-легеневе обстеження було нормальним. Пальпація живота без точок болю і звуків кишечника була 4 рази на хвилину. УЗД черевної порожнини показало потовщення стінки всієї товстої кишки та легку спленомегалію. Діагноз при вступі: важка активність UC E3.
У перший тиждень прийому позитивних результатів у мазках фекалій на гриби та туберкульозні бактерії не виявлено, а токсин клостридіум дифіцил A/B також був негативним. PPD був негативним. Посів крові не показав зростання бактерій. Кількісна флуоресцентна ПЛР CMV-ДНК та EBV-ДНК крові становила менше 500 копій/мл. Тести на Г та ГМ були негативними. PT був нормальним, але D-димер був позитивним (лабораторні дані наведені в таблиці 1). Додано допоміжну харчову терапію (переважно ентеральне харчування) та месалазин 4 г/день перорально та 0,5 г для ректального введення щоночі, супроводжуваний меропенемом та тинідазолом для протиінфекційної емпіричної терапії, але симптоми не покращились.
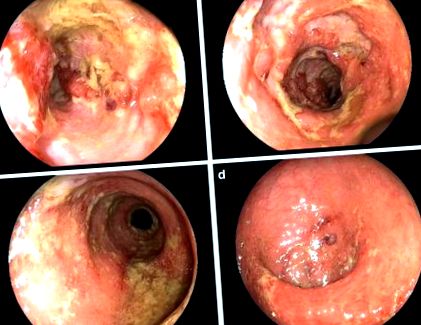
На другому тижні прийому лікування не змінилося, але за допомогою колоноскопії спостерігались великі набряки, ерозії та виразки слизової оболонки товстої кишки (див. Рис. 1а – г). Виконано багатоточкову патологічну біопсію з CMV/EBV-ДНК у слизовій тканині.
a Поперечна ободова кишка, глибокі та великі поздовжні виразки. b Поперечна ободова кишка, глибокі та великі виразки. Біопсія з CMV-ДНК у слизовій тканині. c Сигмовидної кишки, дифузний набряк, застійні явища та виразки слизової. d Пряма кишка, дифузний набряк, застійні явища та виразки слизової
На третьому тижні прийому патологічне дослідження товстої кишки визначило діагноз UC, але в той же час була виявлена кількісна флуоресцентна ПЛР ДМВ-ДНК товстої кишки 1,6 × 10 4 копій/мл позитивної. Відповідно до клінічних ознак, був поставлений діагноз важкого перебігу UC, ускладненого колітом ЦМВ. Додавали внутрішньовенно повноцінну дозу ганцикловіру та припиняли прийом антибіотиків.
На 6-му тижні прийому (після 3 тижнів противірусної терапії) загальні симптоми, очевидно, покращились, але діарея все ще була серйозною, більше 20 разів на день з жовтим рідким стільцем, іноді кров'яним стільцем та судом внизу живота перед дефекацією. Протягом періоду функція згортання була нормальною, а месалазин продовжували.
На 7-му тижні прийому ганцикловір (після 4 тижнів противірусної терапії) був зупинений, але симптом діареї не покращився. Знову була проведена колоноскопія, яка виявила, що запалення було очевидним у поперечному згинанні товстої кишки селезінки (див. Рис. 2а – г). Конфокальна лазерна мікроендоскопія на основі зонда (pCLE) виявила місцеві порушення мікроциркуляції (див. Рис. 3a – d). Додавали ПАП 90 мг повільної крапельниці принаймні 10 годин на день. Симптоми болю в животі та діареї різко зникли через 3 дні лікування РАР. Пацієнт мав жовтий кашоподібний стілець 2–3 рази на день. Патологічні дані відповідали зображенням pCLE, дифузним підслизовим крововиливом та прозорим тромбозом у капілярах (див. Рис. 4а, б).
a Виразки сліпої кишки, слизової оболонки спостерігались. b Висхідна товста кишка, набряк слизової з переплутаною судинною сіткою. c Поперечна ободова кишка, набряк слизової, застійні явища, що мають вузликову форму. Тут були отримані зображення pCLE. d Пряма кишка, слизова майже нормалізувалась
a pCLE зображення кінцевої клубової кишки, збільшені епітеліальні проміжки та витікання флуоресцеїну (позначено стрілкою). b pCLE зображення поперечної ободової кишки, витік флуоресцеїну в периваскулярній зоні (позначено стрілкою), але не в інтактній залозистій порожнині (позначено стрілкою). c pCLE зображення поперечної ободової кишки, витік флуоресцеїну в периваскулярній зоні (позначено стрілкою), але не в інтактній залозистій порожнині (позначено стрілкою). d pCLE-зображення поперечної ободової кишки, діаметр судин був нерівномірним (позначений стрілкою та наконечником стрілки) і завжди спостерігалося явище переривання кровотоку
a Патологічне зображення поперечного плями ВІН товстої кишки, підслизового крововиливу (позначено стрілкою) та прозорого тромбу в капілярах (позначеного стрілкою) у поверхневій слизовій. b Патологічне зображення поперечного плями ВІН товстої кишки, запальної клітинної інфільтрації та прозорого тромбозу капілярів у глибокій слизовій (позначено стрілкою)
На дев'ятому тижні прийому ПАП було зупинено після 10-денної терапії. Симптоми пацієнта майже всі полегшили. Її виписали з лікарні і продовжували приймати месалазин 4 г/день для лікування захворювання.
Обговорення
Діагноз пацієнта був чіткий щодо UC з ентеритом ЦМВ, який перебував у період важкої активності. Основні причини погіршення захворювання включали припинення прийому месалазину та ЦМВ-інфекцію через зниження імунітету при виснаженні. Наркотичну алергію можна виключити через відсутність спеціального вживання ліків, висипу та еозинофілії в процесі захворювання. Протягом курсу лікування симптоми діареї залишалися помітними після 4 тижнів противірусного лікування та 6 тижнів лікування месалазином. На той час колоноскопія виявила, що запалення слизової оболонки товстої кишки загалом покращується, тоді як запалення слизової оболонки від поперечного відділу товстої кишки до згинання селезінки було помітним. Це місце, точно відоме як вододіл, є найбільш часто ураженим місцем ішемії товстої кишки [9].
Важливість участі судин у UC була відома вже багато років [24]. Мікроциркуляція кишечника відіграє безліч вирішальних ролей у патогенезі UC, особливо в ангіогенезі [25]. Деякі дослідження [26] [27] продемонстрували присутність підвищеної щільності мікросудин у тканинах кишечника хворих на УК, що корелювало з активністю захворювання. Функції мікросудини потребують більшої уваги. Симптом пацієнта, що майже двадцять випорожнень на день, що супроводжуються судомами внизу живота, були справді важкою проблемою до лікування РАР. У перший день після використання PAP симптом діареї швидко зменшився. На третій день використання ПАП щоденна частота дефекацій зменшилась до свого нормального рівня, 2-3 рази на день. Значне поліпшення симптомів було пов'язане із застосуванням PAP, коли інші методи лікування не коригувались.
Опіоїдні аналоги папаверину можуть зняти спазм гладких м’язів судин [28]. В основному використовується для лікування ішемії, спричиненої спазмом судин серця, головного мозку та периферичних. PAP частіше використовувався в рецептах гастроентеролога для лікування ішемічного коліту. Його роль до кінця не з’ясована. В даний час вважається, що він головним чином пригнічує активність циклічного нуклеотиду фосфодіестерази [29]. Деякі дослідження виявили протизапальну дію PAP шляхом інгібування АФК, лейкоцитарної інфільтрації та запальних цитокінів, таких як IL-1, IL-6 та TNF [30, 31]. Нещодавно деякі вчені затвердили, що PAP може не тільки пригнічувати транскрипцію/продукцію прозапальних факторів, а й сприяти нейропротективному процесу шляхом вивчення мікрогліальної активності, індукованої ліпополісахаридами (LPS), і ці ефекти опосередковувалися сигнальним шляхом NF-κB [32 ]. Зроблено висновок, що PAP може бути цінним протинейрозапальним кандидатом. Хоча PAP має безліч протизапальних та захисних механізмів, його швидке полегшення болю в животі та симптомів діареї за такий короткий час для цього пацієнта показало, що розслаблення гладкої мускулатури та поліпшення кровопостачання були найважливішим фактором, і, звичайно, подальші дослідження потрібні.
Як антикоагулянтна терапія, НМГ має певний вплив на UC [33]. Дослідження виявили, що НМГ орієнтований на мікротромбоз кишечника [34]. Хоча немає єдиної думки щодо використання PAP при лікуванні ішемічного коліту [35], як судинорозширювальний засіб PAP стає звичайною терапією в нашому центрі завдяки швидкому полегшенню клінічних симптомів та захисному ефекту, показаному при DSS-індукованому модель коліту [5]. Видатний ефект від поліпшення мікроциркуляції кишечника у цьому випадку UC показує важливий механізм виникнення та розвитку UC. Розумно вважати, що вдосконалення лікування мікроциркуляції слизової може стати важливим напрямком лікування та досліджень ВЗК у майбутньому.
Висновок
Порушенням мікроциркуляції слизової оболонки при UC слід приділяти більше уваги, а вдосконалення методу мікроциркуляції в потрібний час може стати важливою допоміжною терапією. pCLE може бути ефективним методом спостереження кровотоку слизової оболонки в реальному часі in vivo, що потребує подальшого вивчення.
- Сильне поколювання, пекучий біль в обох ногах Невропатичний біль Форум пацієнта
- Органічний масаж; Спа-центр для масажу - органічний спа-центр Balans
- Спеціалізована терапія тіла
- Електронний пульсовий масажер для тіла та стимулятор м’язів
- Важка гіпертригліцеридемія Огляд журналу лікарняної медицини