Пептид ожиріння: прокінетицин
Кананом Небігілом
Подано: 3 травня 2016 р. Переглянуто: 9 вересня 2016 р. Опубліковано: 22 березня 2017 р
Анотація
Ожиріння підвищує ризик серцево-судинних захворювань нирок, цукрового діабету, неалкогольного стеатогепатиту, розладів опорно-рухового апарату та раку. Прокінетицин-2 - це пептидний гормон, який існує як циркулююча гормональна система, так і як місцевий паракринний-сигнальний механізм у різних тканинах, включаючи мозок, нирки та жирову клітковину. Він діє на G-білкові рецептори (GPCR) PKR1 та PKR2. Роль прокінетицину-2 в центральній нервовій системі полягає у контролі над їжею. Його анорексигенна дія принаймні частково відбувається через гіпоталамічну систему меланокортину. Прокінетицин-2 також запобігає розширенню жирової тканини, обмежуючи здатність до проліферації та диференціації преадипоцитів. Сигналізація прокінетицину-2 важлива для капілярних проходів інсуліну. Він також регулює розвиток та роботу серця та нирок. Тут ми обговорюємо новий пептид ожиріння прокінетицин, що подає сигнали в центральній регуляції прийому їжі, розвитку тканин адипоцитів та серцево-судинної функції. Прокінетицин може відігравати ключову роль у зв'язку між ожирінням та серцево-судинними захворюваннями. Ми також окреслили потенціал рецептора прокінетицину-1 як мішені для лікування ожиріння та серцево-судинних захворювань.
Ключові слова
- прокінетицин
- GPCR
- ожиріння
- діабет
- анорексигенний
- ангіогенний
інформація про главу та автора
Автор
Канан Небігіл *
- CNRS - Страсбурзький університет, (UMR 7242), Ілкірх, Франція
* Надішліть усі листування за адресою: [email protected]
З редагованого тому
За редакцією Яна Оксгольма Горделадзе
1. Вступ
2. Прокінетицини та їх рецептори
Прокінетицини - це анорексигенні та ангіогенні гормони. Через структурну, сигнальну та функціональну подібність прокінетицини розглядаються як цитокіни/хемокіни [5]. Вони вивільняються головним чином макрофагами та репродуктивними органами [6]. Останнім часом прокінетицин розглядають як адипокін, оскільки високий рівень прокінетицину був виявлений у ВАТ людини із ожирінням [7]. Ці малі пептиди (80–120 амінокислот) називаються прокінетицинами, оскільки ці молекули вперше були визначені як потужні скорочувальні фактори в шлунково-кишковому тракті [8]. Виявлено дві ізоформи прокінетицинів: прокінетицин-1 та прокінетицин-2. Прокінетицин-1 спочатку називали ендокринним судинним ендотеліальним фактором росту (EG-VEGF) [9] через його функціональну схожість з VEGF. Прокінетицин-2 також називають Bv8. Обидва ці пептиди на 45% ідентичні висококонсервованому N-кінцевому мотиву AVITGA, необхідному для їх біологічної активності [6, 10]. Активність прокінетицину опосередковується двома рецепторами, зчепленими з G-білками, PKR1 та PKR2 [11].
2.1. Прокінетицин-2 - це анорексигенний пептид
Гормони та поживні речовини, що циркулюють в організмі, інтегровані для опосередкування регуляції короткочасного та довгострокового вживання їжі в гіпоталамусі. Центр контролю живлення та енергетичного гомеостазу в гіпоталамусі називається дугоподібним ядром (ARC) [12, 13]. ARC інтегрує більшість периферичних гормональних сигналів, включаючи лептин, інсулін та грелін. ARC має дві основні субпопуляції первинних нейронів, які експресують нейрогормони з протилежним впливом на споживання їжі. Нейрони ARC, що вивільняють пептид, вироблений проопіомеланокортином (POMC), пептид альфа-меланоцит-стимулюючий гормон (α-MSH) та пептид, регульований кокаїном та амфетаміном (CART), сильно знижують споживання їжі [13, 14]. Однак нейропептиди Y (NPY), що продукують нейрони в ARC, стимулюють споживання їжі.
Прокінетицин-2 бере участь у контролі надходження їжі та жирової маси завдяки дії в АРК в гіпоталамусі [15]. Рецептор PKR1 експресується як на нейронах NPY/AgRP, так і на POMC/CART. Внутрішньочерепне введення прокінетицину-2 щурам сильно зменшує споживання їжі. Суперечки: анти-прокінетицин-2 антитіло збільшує споживання їжі. Анорексигенний ефект прокінетицину-2 опосередковується принаймні частково через систему меланокортину ARC гіпоталамуса. Прокінетицин-2 збільшує вивільнення альфа-МСГ з експлантатів ex vivo гіпоталамусу. Нещодавно PKR1 був показаний як перший немеланокортиновий GPCR, який регулюється допоміжним білком рецептора меланокортину 2 (MRAP2). Дійсно, MRAP2 суттєво та конкретно пригнічує сигналізацію PKR1 [16].
Периферичне введення прокінетицину-2 зменшує споживання їжі та масу тіла як у худих мишей, так і у моделей ожиріння, спричинених дієтою [17]. Цей ефект прокінетицину-2 не виявляється, коли підвищується апетит або підвищується поведінка годування. Рівні гіпоталамічного прокінетицину-2 були виявлені надзвичайно високими в ранньому неонатальному періоді. Однак зниження рівня прокінетицину-2 було очевидним за умов голодування [18]. Прокінетицин-2-нокаутовані миші ожиріли в пізньому віці. Люди з інактивуючими мутаціями гена прокінетицину-2 також страждають ожирінням [17, 19]. Аноректичні ефекти прокінетицину-2 скасовуються антагоністами PKR1 і не спостерігаються у мишей, у яких відсутня PKR1 [17]. Таким чином, аноректичний ефект прокінетицину-2 в гіпоталамусі опосередковується PKR1.
2.2. Прокінетицин при розвитку ожиріння
Механізми, що лежать в основі розвитку ожиріння, включають гіпертрофію та/або гіперплазію адипоцитів, запалення жирової тканини (АТ), порушення ремоделювання позаклітинного матриксу та фіброз разом із зміненою секрецією адипокінів [20]. Розширення AT включає два різні механізми: збільшення жирових клітин і збільшення числа адипоцитів [21]. Диференційовані адипоцити є постмітотичними, а отже, гіперплазія є результатом підвищеного утворення адипоцитів de novo (адипогенез). Порушення адіпогенезу пов’язане з резистентністю до інсуліну [22]. Баланс між проліферацією та диференціацією преадипоцитів та апоптозом або некрозом адипоцитів визначає кількість адипоцитів.
Встановлено, що рівень прокінетицину-2 високий у ВАТ людини із ожирінням [7]. Прокінетицин-2 пригнічує розширення АТ за допомогою двох різних механізмів: центральної регуляції споживання їжі та обмеження проліферації та диференціації преадипоцитів. Центральній регуляції маси тіла протидіє втрата PKR1 в жировій тканині у мишей. Дійсно, у цих мишей спостерігалося аномально надмірне накопичення жирової маси в животі, де PKR1 специфічно видалявся в адипоцитах (PKR1 ad -/-) [7]. Утворення нових адипоцитів як у нульових PKR1, так і у PKR1 ad -/- мишей було результатом прискорення проліферації та диференціації преадипоцитів. Проліферативний фенотип АТ перейшов на гіпертрофічний фенотип АТ, коли ці миші отримували дієту з високим вмістом жиру, що означає, що споживання великої кількості калорій бере участь у перетворенні гіперплазії на гіпертрофію. В ізольованих преадипоцитах активація PKR1 пригнічує проліферацію та адипогенну диференціацію [38].
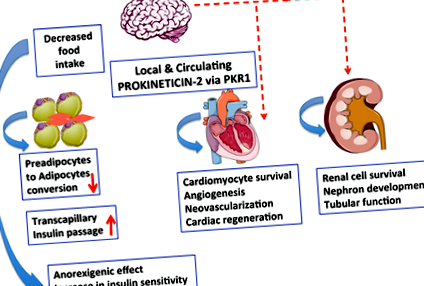
Як у PKR1null, так і у PKR1ad -/- мишей спостерігається абдомінальне ожиріння [7] Однак лише миші PKR1null мають периферичне ожиріння з діабетоподібним синдромом. Таким чином, неадипоцитарні PKR1-опосередковані події сприяють розвитку діабетоподібного синдрому. Дійсно, ендотеліально-специфічні миші-нокаути PKR1 (PKR1ec -/-) [23] мали резистентність до інсуліну в адипоцитах. У адипоцитах PKR1ec -/- інсулін не може сприяти нормальному накопиченню жиру, що призводить до надлишку циркулюючих вільних жирних кислот, які, в свою чергу, додатково сприяють стійкості до інсуліну в м’язах, що призводить до діабетоподібного синдрому. Однак, здається, PKR1 не має прямого впливу на відкладення жиру в адипоцитах. PKR1 ad -/- миші не мали сильного накопичення жирової тканини в своїх адипоцитах. Оскільки адипоцити не створюються з інших адипоцитів, але вони виникають із клітин-попередників (преадипоцитів), PKR1 пригнічує здатність цих клітин-попередників перетворюватися на адипоцити (рис. 1) [7]. Розширення і метаболізм жирової тканини є основною проблемою ожиріння.
Фігура 1.
Сигналізація прокінетицину-2/PKR1 може виступати новим сполучником між розвитком ожиріння, діабетом та серцево-судинними захворюваннями. Сигналізація прокінетицину-2/PKR1 в центральній нервовій системі (ЦНС) регулює споживання їжі. Прокінетицин-2, що виділяється з адипоцитів, контролює перетворення преадипоцитів в адипоцит за допомогою сигналізації PKR1. Сигналізація прокінетицину-2/PKR1 сприяє виживанню кардіоміоцитів та ангіогенезу та бере участь у неоваскуляризації шляхом активації серцевих клітин-попередників. Сигналізація прокінетицину-2/PKR1 сприяє розвитку серця та нирок, а також функції нирок. Чи пов'язана ця сигналізація з регуляцією роботи серця та нирок через ЦНС, ще слід вивчити.
2.3. Прокінетицин при резистентності до інсуліну
Ендотелій важливий для транскапілярної доставки інсуліну до інтерстицію скелетних м’язів. Цей процес є обмежуючим швидкістю поглинанням глюкози, стимульованого інсуліном. [24] Порушення процесу доставки інсуліну сприяє резистентності до інсуліну [25]. З іншого боку, резистентність до інсуліну призводить до дисфункції ендотелію [26]. Таким чином, судинний ендотелій є потенційною терапевтичною мішенню для профілактики інсулінорезистентності та пов'язаних з цим ускладнень [27].
Ендотеліоспецифічні миші-нокаутери PKR1 (PKR1 ec -/-) демонструють порушення формування капілярів та низьке поглинання транскапілярного інсуліну [23]. Порушення доставки інсуліну та сигналізації в ендотеліальних клітинах (ЕК) спостерігалося у випадках резистентності до інсуліну при цукровому діабеті 2 типу та ожирінні. Ендотеліальні клітини, що надмірно експресують PKR1, сприяють захопленню трансендотелію інсуліну [9] та ангіогенезу [28]. PKR1ec -/- миші демонструють ліподистрофію через погане формування капілярів в АТ. Ліподистрофії, що включають втрату ВАТ, викликають гіперфагію та периферичну резистентність до інсуліну [29].
Підсумовуючи, прокінетицин регулює апетит (вплив на центральну нервову систему (ЦНС)) і пригнічує розширення адипоцитів (прямий вплив на тканину адипоцитів), сприяє нормальному накопиченню жиру (ендотеліально-залежний ефект) і підвищує чутливість до інсуліну. Терапевтичні стратегії, орієнтовані на PKR1, можуть бути важливими для лікування ожиріння та асоційованої з ожирінням резистентності до інсуліну.
2.4. Прокінетицин у регуляції серцево-судинної системи
Ожиріння є як незалежним фактором ризику, так і маркером ризику розвитку безсимптомної та симптоматичної ішемічної хвороби серця, серцевої недостатності та миготливої аритмії [2]. Взаємозв'язок ожиріння та серцево-судинних захворювань може бути пов'язана з гемодинамічними та анатомічними серцево-судинними змінами, пов'язаними із надмірною масою тіла [30]. Однак взаємозв'язок може також опосередковуватися метаболічними, запальними та нейрогормональними змінами, пов'язаними з ожирінням.
Змінена експресія прокінетицинів та їх рецепторів пов'язана з розвитком ряду патологічних серцевих захворювань, включаючи серцеву недостатність [31]. Прокінетицини та їх рецептори визначені як важлива система серцево-судинної сигналізації, особливо прихильність серцевих клітин та комунікація між клітинами [32].
Опосередкована сигналізація PKR1 сприяє виживанню кардіоміоцитів та репарації серця дорослих. PKR1 активує Akt у кардіоміоцитах для захисту цих клітин від опосередкованого гіпоксією апоптозу [33]. Трансгенні (TG) миші, що надмірно експресували PKR1 у кардіоміоцитах (TG-PKR1), мали збільшену кількість клітин-попередників, отриманих з епікарда, із збільшенням щільності капілярів та коронарних артеріол. [32] Сердечна сигналізація PKR1 регулює власний ліганд прокінетицин-2, щоб стимулювати диференціювання EPDC в ендотеліальні та гладком’язові клітини для сприяння неоваскулогенезу [32]. Однак кардіоміоцит-PKR1 необхідний для виживання кардіоміоцитів та скоротливості. Нульові миші PKR1 виявляли дефекти скорочення кардіоміоцитів та апоптоз частково через відсутність сигналізації PKR1 у кардіоміоцитах. [34]
В ендотеліальних клітинах (EC) PKR1 активує Akt та MAPK для сприяння проліферації, міграції та ангіогенезу. За погодженням з результатами in vitro, специфічна втрата PKR1 від ЕК миші призвела до дефекту ангіогенезу, що призвело до некрозу/апоптозу в навколишніх тканинах кількох органів, включаючи серце та нирки [23].
У дорослих серцях PKR1 ec -/- серця було значно менше утворення капілярів. Задні стінки сердець PKR1 ec -/- були тоншими, що було обумовлено втратою капілярного утворення та високим рівнем апоптозу [23]. Залишок життєздатного серцевого м’яза піддається більшому біомеханічному стресу, що викликає гіпертрофію [23]. Фракції скорочення (показники скоротливості лівого шлуночка) поступово зменшувались у мутантних мишей. PKR1 ec -/- у серцях спостерігається дерегуляція ЕС, рефракція капілярів, апоптоз, фіброз та відкладення ектопії ліпідів, ненормальна сигналізація про інсулін у серцях, що призводить до порушення діастолічної функції.
ЕК серця демонстрували суттєве зниження поглинання FICT-інсуліну, що вказує на дефектний транскапілярний транспорт інсуліну в судинній стінці цих мишей. Ізольовані ЕК з мутантної серцевої та ниркової тканин виявляли дуже мало поглинання інсуліну, що підтверджує, що втрата PKR1 від ЕК зменшує транспорт інсуліну [23]. Надмірна експресія PKR1 у цих ЕК сприяла проходженню інсуліну флуоресцеїну ізотіоціанату (FITC). Дійсно, основним дефектом, що пов'язує резистентність до інсуліну та дисфункцію ендотелію, вважається дефіцит оксиду азоту ендотеліального походження [35]. На узгодження, поглинання інсуліну та інсуліно-опосередкована активація eNOS були порушені у всіх мутантних ЕК. Подібним чином нещодавно продемонстровано зміну активації eNOS та низьку дію інсуліну в ендотелії пацієнтів із цукровим діабетом [36]. Таким чином, порушення доставки інсуліну до ЕК може призвести до дефектної активації NOS та eNOS в аортах PKR1 ec -/-, внаслідок чого погіршити залежність від ендотелію. Ці дані підкреслюють роль PKR1 як позитивного регулятора поглинання інсуліну [37].
Сигналізація PKR1 також сприяє розвитку серця. Розвиваючи серце, PKR1 регулює епікардіальний-мезенхімальний перехід (ЕМТ), утворюючи клітину-попередник епікардіального походження (EPDC) [38]. Генетична абляція PKR1 в епікарді призводить до гіпоплазії шлуночків та дефектів перегородки під час ембріогенезу. Порушення васкулогенезу у цих мишей зумовлене порушенням проліферації EPDC, а також неповноцінною диференціацією EPDC на тип клітин ендотелію та гладких м’язів. PKR1 в EPDCS активує передачу сигналів Akt, змінює морфологію клітин, ремоделювання цитоскелету актину та профіль експресії гена EMT. Epicardial-PKR1 сприяє кардіоміоцитам, проліферації та ритмічності в паракринному шляху.
2.5. Прокінетицин у розвитку та функції нирок
Глобальні нокаутовані миші PKR1 мають периферичне ожиріння, що супроводжується діабетоподібним синдромом у пізньому віці (36 тижнів) [7], головним чином через дисфункцію ендотелію та порушення функції жирової тканини [37]. Ці миші також виявляли кардіомегалію, важкий інтерстиціальний фіброз та серцеву дисфункцію в стресових умовах. Ці миші також мали порушення розширення ниркових канальців, зменшення капілярів клубочків, виведення фосфатів із сечею та протеїнурію [34].
Подібним чином, специфічні для ендотелію PKR1-нокаутовані миші (PKR1 ec -/-) також виявляли розширення просторів Боумена в більшості клубочків, компактний клубочок, фіброз і збільшені трубчасті структури з набряклим некротичним ядром, аномальні мітохондрії та аномальна організація подоцитів. Аномальна канальцева функція з вищими рівнями абсолютної екскреції ниркового фосфату (Pi) у мишей PKR1 ec -/- зумовлена нижчими рівнями натрій-кальцію та фосфатного обмінника. Морфологічні зміни нирок PKR1 ec -/- були пов’язані з більш високим рівнем апоптозу та порушенням сигналізації інсуліну та накопичення ліпідів. У мишей-мутантів спостерігався високий рівень кліренсу креатиніну та протеїнурії. [34] Ендотеліальна дисфункція внаслідок втрати сигналізації PKR1 частково лежить в основі патологічних особливостей серця та нирок.
Сигналізація PKR1 у нирках є важливою для розвитку нефрону під час ембріогенезу [38]. Нещодавно було показано, що у мишей-мутантів з цілеспрямованими порушеннями гена PKR1 у родоначальниках нефрону спостерігалася часткова ембріональна та постнатальна летальність через гіпопластичні нирки з передчасними клубочками та некротичними нефронами. Дефекти розвитку нирок у цих мишей проявляються у дорослої стадії як атрофія нирок з дефектами клубочків, нефропатією та уремією. Таким чином, PKR1 необхідний для ниркового мезенхімально-епітеліального переходу (MET), який бере участь у формуванні ниркових родоначальників, регулюючи гломерулогенез у напрямку формування нефронів під час розвитку нирок. Дійсно, PKR1 через NFATc3 модифікує обробку MET для розвитку нефрону.
3. Висновок
Сигналізація PKR1 має різні сприятливі ефекти, наприклад, центральна регуляція апетиту, пригнічення маси адипоцитів та сенсибілізуючий інсулін вплив на скелетні м’язи та інші тканини, регенеративні ефекти серця та регуляція функції нирок. Це викликало значний інтерес до можливого використання цього рецептора як мішені для лікування проти ожиріння, діабету та серцево-судинних захворювань. Внутрішньосерцевий перенос гена PKR1 покращив рівень виживання та функції серця після інфаркту міокарда [33]. Оскільки було встановлено, що PKR2 сприяє витоку судин та гіпертрофічній кардіоміопатії [39], декілька лабораторій зосереджені на відкритті агоніста PKR1. Нещодавно був виявлений непептидний агоніст PKR1 [40]. Агоніст PKR1 запобігає утворенню серцевих уражень та покращенню серцевої функції після інфаркту міокарда у мишей, сприяючи проліферації серцевих клітин-попередників та неоваскулогенезу. Агоніст PKR1 у стратегіях лікування метаболічних захворювань ще слід вивчити.
Також слід визначити, як прокінетицин-2 сприяє реконструкції АТ [41], як він модулює взаємодію між адипоцитами, макрофагами та ендотеліальними клітинами для регулювання розширення АТ [42]. Циркулюючий рівень прокінетицину у пацієнтів із ожирінням, діабетом та серцевою недостатністю ще слід вивчити.
Подяка
Я хочу подякувати людям, які брали участь у описаних тут дослідженнях, включаючи Кіоджі Ураяму, Селію Гуйліні, Гюлена Туркері, Монію Булбердаа, Мойде Дормішян, Рехану Куреші, Хіманшу Арору та Аделіну Гассер. Публікація була підтримана частково грантами Фонду для медичних досліджень (Equipe Labellisée), Національного центру наукових досліджень та Страсбурзького університету. Ця робота також була опублікована в LABEX ANR ‐ 10 ‐ LABX‐ 0034_Medalis та отримала фінансову підтримку від французького уряду, керованого Agence Nationale de la Recherche (ANR), у рамках програми „d investissement d ׳ avenir“.
- Безпоживний повнотекстовий дієтичний пептид шовку запобігає ожирінню, спричиненому дієтою, і спричиняє ожиріння
- Пептид лікує ожиріння та діабет у щурів - майбутнє
- Біг допомагає запобігти набору ваги, незважаючи на "гени ожиріння", виявляє дослідження
- Пісні для альбому "Здоровіша Америка" борються із ожирінням серед дітей
- Арахіс, арахісове масло можуть утримувати ключ до запобігання ожирінню - ScienceDaily