Олія кита холодного віджиму знижує циркулюючий холестерин ЛПНЩ/ЛПНЩ, окислення ліпідів та атерогенез у мишей з дефіцитом аполіпопротеїну Е, які годували дієтою західного типу протягом 13 тижнів
Анотація
Передумови
Довголанцюгові n3-поліненасичені жирні кислоти (LC n3-PUFA) добре відомі своєю протизапальною активністю та своїм впливом на серцево-судинні захворювання. Китова олія холодного віджиму (CWO) має половину кількості LC n3-PUFA порівняно з олією печінки тріски (CLO). Тим не менш, спостерігається більш виражений сприятливий вплив на маркери серцево-судинних захворювань від прийому CWO порівняно з прийомом CLO в дослідженнях людського втручання. Також було показано, що екстракти CWO, позбавлені жирних кислот, виявляють антиоксидантну та протизапальну дію in vitro. Метою цього дослідження було дослідити, чи прийом дієти західного типу із високим вмістом жиру, доповненої CWO, не запобігає розвитку атеросклеротичних уражень у мишей з дефіцитом аполіпопротеїну Е (ApoE -/-).
Методи
Сімдесят самок мишей ApoE -/- годували WD, що містить 1% CWO, CLO або кукурудзяну олію (CO). Оцінювали формування атеросклеротичних уражень, вагу тіла та тканин, експресію печінкових генів разом із сироватковим рівнем ЛПНЩ/ЛПНЩ-холестерину, бич-ЛПНЩ, загальним антиоксидантним статусом та різними серцево-судинними захворюваннями/прозапальними маркерами. Статистичний аналіз проводили за допомогою SPSS, а тест Шапіро-Вілка проводили для визначення розподілу змінних. Статистичну різницю оцінювали за допомогою одностороннього ANOVA з пост-тестом Тукіса або тестом Крускала-Уолліса. Відносну експресію гена печінки аналізували за допомогою REST 2009 (V2.0.13).
Результати
Миші, яких годували CWO, мали менше атеросклеротичних уражень в дузі аорти в порівнянні з мишами, які отримували CO. Рівні холестерину LDL/VLDL-холестерину та ox-LDL-холестерину також помітно знижувались, тоді як загальний рівень антиоксидантів підвищувався у мишей, яких годували CWO, порівняно з мишами, які годували CO . Крім того, миші, які годувались CWO, набирали меншу вагу, і кілька печінкових генів, що беруть участь в метаболізмі холестерину, регулювались в порівнянні з мишами, які годували CO.
Висновок
У цьому дослідженні миші, яких годували ВД, доповненою 1% ХВО, мали знижене утворення атеросклеротичних вогнищ у дузі аорти, зниження рівня холестерину ЛПНЩ/ЛПНЩ і окс-ЛПНЩ у сироватці крові, підвищення загального антиоксидантного статусу в сироватці та зниження маси тіла порівняно з мишами годували WD з додаванням 1% CO.
Передумови
Атеросклероз характеризується ураженням артеріальних ліпідів в інтимі великих артерій, і хвороба може бути тихою або безсимптомною протягом десятиліть. Проте атеросклероз є основною причиною ряду інших серцево-судинних захворювань (ССЗ), таких як нестабільна стенокардія, інфаркт міокарда та інсульт. Роки накопичення ліпідів у судинній стінці спричиняють утворення нальоту та звуження просвіту. Розрив нальоту може з часом призвести до гострого атеротромбозу, що перешкоджає адекватному притоку крові до легенів, серця та тканин мозку [1, 2]. Зв’язок між атеросклерозом та запаленням було всебічно з’ясовано [3,4,5,6,7], і кілька цитокінів та хемокінів є ключовими факторами, що сприяють прогресуванню атеросклерозу [8,9,10,11]. Протизапальний ефект довголанцюгових n3-поліненасичених жирних кислот (LC n3-PUFA) добре відомий. Особливо ейкозапентаенова кислота (EPA) та докозагексаєнова кислота (DHA) та те, як вони сприяють пом'якшенню атеросклеротичної прогресії у коронарних хворих [12,13,14,15,16,17]. Жирна риба є хорошим дієтичним джерелом ЕРА та ДГК. Риба також містить інші складові, такі як білки, амінокислоти, пептиди та біоактивні сполуки, які можуть сприяти сприятливим ефектам, що спостерігаються після прийому риби [18,19,20].
Звичайний кит-минка (Balaenoptera acutorostrata) харчується ракоподібними та пелагічною рибою в Північній Атлантиці [21], а їх товстий шар сала є життєво важливим для теплоізоляції, плавучості та накопичення енергії [22]. Сало протягом століть було важливою складовою раціону корінних жителів Арктики та Субарктики. Два десятиліття тому китове масло холодного віджиму (CWO) та олія печінки тріски (CLO) давали здоровим людям як дієтичні добавки в рамках більш масштабного дослідження [23, 24]. Результати показали, що група CWO сприятливо впливала на маркери ССЗ та покращувала запальний ефект, також у порівнянні з групою CLO. Склад жирних кислот (FA) CWO та CLO відрізняється кількістю LC n3-PUFA. Китовий жир має 10,3% LC n3-PUFA, включаючи 3,3% EPA, 1,7% докозапентаенової кислоти (DPA) і 4,7% DHA, тоді як CLO має 25,1% LC n3-PUFA, включаючи 9,5% EPA, 1% DPA і 13,5% DHA в CLO [24]. Нещодавно ми продемонстрували в дослідженні in vitro з CWO, позбавленим жирних кислот, що CWO містить екстрактуються антиоксиданти та має протизапальну активність, пов’язану з невстановленими до цього часу сполуками [25].
У цьому дослідженні ми дослідили, чи вживання дієти західного типу із високим вмістом жиру, доповненої CWO або рафінованою олією китів (RWO) у поєднанні з екстрактами китового жиру, запобігає розвитку атеросклеротичних уражень в дефіциті аполіпопротеїну Е (ApoE -/-) миші.
Методи
Експериментальні тварини та житло
Сімдесят два жіночі ApoE -/- - миші без патогенів (B6.129P2-Апое tm1 Unc N11) були придбані у Taconic (Taconic M&B, Ry, Данія). Після прибуття до місцевого тваринного закладу всіх мишей було призначено і випадковим чином розподілено на 6 груп (n = 12) з рівною кількістю кліток за втручання (n = 4 клітини/дієта). Через втрату ваги під час тижневої акліматизації було виключено двох мишей (n = 11 у групах RWO-I та CWO). На початку експерименту мишам було вік 6 тижнів з масою тіла від 16 до 21 г. Мишей, забезпечених водою та гранульованими кормами ad libitum, протягом 13 тижнів утримували у вентильованих клітках, розміщених в одному приміщенні у звичайному лабораторному відділенні для тварин. Температура та відносна вологість повітря становили 21 ° C і 55% за 12-годинний цикл день/ніч (світло: від 0600 до 1800 год). Клітки та постільну білизну міняли раз на тиждень. Наприкінці дослідження всі миші були позбавлені корму протягом 3 год перед евтаназією шляхом інгаляції вуглекислого газу. Кров брали шляхом серцевої пункції, і сироватку готували і заморожували при - 80 ° C. Серцеву, печінкову, ниркову, селезінкову та жирову тканини розсікали, зважували, швидко заморожували та зберігали при - 80 ° C.
Приготування дієтичних масел
Свіжоморожене сало від звичайного мінкового кита було надано компанією Ellingsen Seafood AS (Скрова, Норвегія). Сало подрібнювали один раз перед центрифугуванням за таблицею 1 Вміст дієт, г/кг
Аналіз атеросклеротичного нальоту
Відразу після дренажу крові всі миші були перфузовані через лівий шлуночок стерильним фізіологічним розчином (0,9%), доки в перфузаті не було залишкової крові (приблизно 5 хв перфузії). Вся аорта (проксимально піднімаючись по аорті до біфуркації клубових артерій) очищалася in situ від периадвентиціального жиру, розсікалася і фіксувалася в 1% розчині параформальдегіду. Нарешті, аорта була забарвлена фарбуванням Oil Red O, розкрита поздовжньо і en face-встановлені на слайдах, як описано раніше [27]. Після 48 год відпочинку слайди сканували за допомогою сканера високої роздільної здатності. Площі уражень оцінювали за допомогою програмного забезпечення ImageJ [28], а ступінь атеросклерозу повідомляли як відсоток від загальної площі даної аорти чи області аорти, зайняту атеросклеротичними ураженнями.
Загальна екстракція РНК
Після перфузії мишей печінку видаляли, зважували і заморожували в рідкому азоті перед зберіганням при - 80 ° C до екстракції. Сто мг печінкової тканини гомогенізували в 1 мл Trizol (Life Technologies) розмелюванням гранул (Precellys 24, Bertin Technologies). Зразки інкубували на льоду протягом 30 хв з наступним 20-хвилинним центрифугуванням при 12000 × g при 4 ° C. Зразки осаджували протягом ночі ізопропанолом і центрифугували протягом 21000 × g протягом 30 хв при 4 ° C. Гранули розчиняли в розчинах для зберігання РНК і РНК зберігали при - 80 ° C до подальшої обробки. Загальну концентрацію РНК вимірювали за допомогою флуорометра Qubit 1.0 (Life Technologies) та тестували якість за допомогою біоаналізатора Agilent 2100 (Agilent Technologies, Inc). Коефіцієнт цілісності РНК становив 7,6–9,3 для використаних зразків.
Зворотна транскрипція та кількісна ПЛР у реальному часі
Набір для зворотної транскрипції кДНК (4 368 813, Applied Biosystems) був використаний для виготовлення 3-х повторностей зворотної транскриптази (загальна РНК 50 нг у 20 мкл). Кількісна RT-PCR була використана для аналізу 4 мкл кДНК на 20 мкл реакції за допомогою суміші TaqMan® Fast Universal PCR Master (4 352 042, Applied Biosystems) та заздалегідь розроблених аналізів експресії генів TaqMan® (додатковий файл 1: Таблиця S1). На 96-лункових планшетах працювали на швидкому циклері ABI Prism 7500 (Applied Biosystems), використовуючи попередньо встановлений профіль ампліфікації (95 ° C 20 с, 40 × 95 ° C 3 с і 60 ° C 30 с). Найстабільніше експресовані ендогенні контрольні гени, гіпоксантин-гуанін-фосфорибозилтрансфераза 1 (Hprt1) і зв'язуючий білок TATA-Box (Tbp), були відібрані за допомогою ендогенного аналізу мишей TaqMan Array (4 426 701, Applied Biosystems). Середнє геометричне цих референтних генів було використано для нормалізації експресії генів. Міжпластинковий калібратор та контролі без шаблону були включені у всі аналізи.
Аналізи сироватки
Холестерин у сироватці крові, ліпопротеїни низької щільності та ліпопротеїни дуже низької щільності (ЛПНЩ/ЛПНЩ), глюкоза, триацилгліцерин (TAG), загальні концентрації білка, сечова кислота, неестерифіковані жирні кислоти (NEFA; D07940, Dialab, Австрія) та загальна кількість антиоксидантний статус (TAS; NX2332 Randox Total Antioxidant Status, Randox Laboratories Ltd., Великобританія) аналізували із застосуванням звичайних ферментативних наборів та біоаналізатора MaxMat PLII (MaxMat PL, Монпельє, Франція). Якщо не вказано інше, всі комплекти були від MaxMat PL (Монпельє, Франція). Окислений у сироватці крові ЛПНЩ (Ox-LDL) кількісно визначався у двох примірниках згідно з інструкцією виробників за допомогою мишачого набору ELISA (E90527Mu, USCN Life Science Inc., Техас, США). Зразки сироватки аналізували у двох примірниках на такі цитокіни: інтерферон гамма (IFNγ), інтерлейкін 10 (IL-10), інтерлейкін 1 бета (IL-1β), інтерлейкін 2 (IL-2), інтерлейкін 5 (IL-5), інтерлейкін 6 (IL-6), хемоаттрактант кератиноцитів, регульований ріст онкогену (KC-GRO), та фактор некрозу пухлини альфа (TNF-α). Ці аналізи були проведені відповідно до інструкцій виробника з використанням набору протизапальних панелей миші MSD 1 V-Plex (MULTI-ARRAY®, Meso Scale Discovery, Gaithersburg, MD).
Статистичний аналіз
Весь статистичний аналіз проводився за допомогою IBM SPSS Statistics для Macintosh (Випуск 22.0.0.0, SPSS, Inc., Чикаго, Іллінойс, США). Тест Шапіро-Вілька був проведений для визначення розподілу змінних, а ненормально розподілені змінні були перетворені в журнал перед статистичним аналізом. Статистичну різницю оцінювали за допомогою одностороннього ANOVA з пост-тестом Тукіса або тестом Крускала-Уолліса. Відносну експресію гена аналізували за допомогою REST 2009 (V2.0.13) [29]. Значення стор
Результати
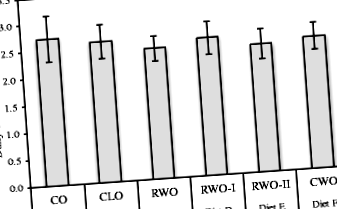
Загальне фізичне здоров'я та приріст ваги здавались нормальними для всіх мишей, крім однієї миші, що годується СО (евтаназованої через втрату ваги) протягом 13 тижнів під час експериментальних дієт. Середнє добове споживання корму (г/миші) було рівним для всіх 6 дієтичних груп (рис. 1). Тим не менше, миші, яких годували CWO, набирали меншу масу тіла порівняно з мишами, які годували CO (рис. 2а). Вага печінки у мишей, яких годували CWO та RWO-II, була нижчою, ніж вага печінки у мишей, які годували CO (рис. 2b). Ці суттєві відмінності були також при відносній вазі печінки. Кількість білої жирової тканини також була меншою у мишей, яких годували CWO, порівняно з мишами, які годували CO (1,44 г ± 0,12 проти 2,24 ± 0,2, відповідно), проте, не суттєво (стор = 0,078). Не було явних відмінностей у розмірах тканин між групами серця, нирок або селезінки (табл. 2). Криві зростання для всіх експериментальних дієт представлені на рис. 2в.
Середнє щоденне споживання корму (г/миші) жіночих мишей з дефіцитом аполіпопротеїну Е, яких годували дієтами з високим вмістом жиру та різними оліями протягом 13 тижнів. Результати представлені як середнє значення ± SD. CO (n = 11), CLO (n = 12), RWO (n = 12), RWO-I (n = 11), RWO-II (n = 12), CWO (n = 11)
Атеросклеротичні ураження
П'ять мишей були вилучені з набору даних для аналізу атеросклеротичних уражень через методологічні артефакти або сильну кальцифікацію черевної аорти (від ниркових артерій аж до роздвоєння клубової кістки), незважаючи на мінімальне утворення уражень в області дуги аорти. Опущені миші були; три миші, яких годували CLO (n = 9), одна миша годувала RWO (n = 11) і одна миша, яка годується CWO (n = 10). Площа ураження дуги аорти була нижчою у мишей, яких годували CWO, порівняно з площею ураження дуги аорти у мишей, які харчувались СО (рис. 3а). В інших регіонах аорти (черевна частина, грудна частина або навіть для загальної аорти) суттєвих відмінностей між групами не спостерігалося (рис. 3b-d відповідно).
Антиоксидантний статус у сироватці крові, рівень холестерину ЛПНЩ/ЛПНЩ у сироватці крові та рівень окси-ЛПНЩ у сироватці крові
TAS у сироватці крові був вищим у мишей, яких годували CWO та RWO-II, порівняно з мишами, які годували CO (рис. 4а). TAS також був вищим у мишей, яких годували RWO-I, RWO-II та CWO, порівняно з TAS у мишей, які годували CLO (рис. 4а). Рівні холестерину ЛПНЩ/ЛПНЩ у сироватці крові та рівні окси-ЛПНЩ-холестерину в сироватці крові були нижчими у мишей, яких годували RWO-I, RWO-II та CWO, порівняно з цими рівнями у мишей, які годували CO (рис. 4b та c). Загальний рівень холестерину (рис. 4г) та тригліцериди в сироватці крові не відрізнялися між мишами, котрі годували СО, та іншими групами дієти; як і рівень глюкози або цитокінів у сироватці крові (табл. 2).
Експресія гена
Обговорення
Основною метою цього дослідження було дослідити, чи може дієтичне споживання WD, доповненого CWO (дієта F), запобігти атеросклеротичному розвитку у ApoE -/- - мишей. Нещодавно наша група продемонструвала, що екстракти з CWO мали антиоксидантну та протизапальну активність, не пов'язану із вмістом LC n3-PUFA [25]. Коли CWO вводили як дієтичну добавку здоровим добровольцям, спостерігали сприятливий вплив на маркери ССЗ та покращений протизапальний ефект [23, 24]. Тут WD доповнювали 1% CWO, або 1% RWO, збагаченим двома різними екстрактами з китового жиру, використовуючи CO (дієта A) та CLO (дієта B) як контрольну дієту на основі попередніх результатів [23,24,25].
Через менший вміст EPA та DHA у жирі китів порівняно з риб’ячим жиром, ми очікували та спостерігали незмінений рівень TAG у сироватці крові. Змінений рівень TAG у сироватці крові спостерігався в ряді інших досліджень, де ApoE -/- - мишам вводили порівнянні кількості EPA, DPA та DHA [38,39,40]. Ефективне зниження рівня TAG у сироватці крові вимагає добавок EPA, DPA та DHA у фармацевтичних дозах, які може бути важко отримати дієтою [41]. Відомо, що олія китового жиру містить велику кількість DPA порівняно з риб'ячим жиром, і деякі дослідження показали, що DPA може бути найважливішим LC n3-PUFA, коли мова йде про захист ССЗ [42, 43]. У сукупності ці висновки можуть означати, що дієта CWO сприяє виведенню холестерину з кровообігу, підвищеному кліренсу холестерину в печінці, підвищеному рівню TAS, зниженому окисненню LDL-холестерину, що сприяє пом'якшенню атеросклерозу.
Висновок
У цьому дослідженні ми спостерігали, що миші, які годували WD з 1% CWO, мали зменшення утворення атеросклеротичних уражень у дузі аорти порівняно з мишами, які годували WD з 1% CO. Крім того, миші, які годували CWO, мали знижений рівень LDL/VLDL-холестерину в сироватці крові, ХС-ЛПНЩ-холестерин та маса тіла та підвищений загальний антиоксидантний статус у сироватці крові порівняно з мишами, котрі годуються CO. Наше дослідження додає нове розуміння передбачуваних захисних механізмів дієтичного введення добавок CWO при ССЗ, включаючи активацію ендогенних антиоксидантних реакцій, інгібування окислення ЛПНЩ, ослаблення гіперхолестеринемії, спричиненої дієтою, та зменшення атерогенезу аорти. Ці результати можуть бути інформацією щодо майбутніх дієтичних рекомендацій щодо зменшення ССЗ та зміцнення здоров'я населення.
Скорочення
Касета для зв'язування АТФ, член підсімейства G 5
Касета для зв'язування АТФ, член підсімейства G 8
- Краниопластика без періостальної дисекції зменшує втрату крові при хірургії пі-пластики для сагіталу
- Свіжий органічний грейпфрутовий сік холодного віджиму Evolution
- Частота контактів та грошова винагорода за втрату ваги, зміну ліпідів та зниження артеріального тиску
- Виклична Японія сприятиме вживанню м’яса китів - The New York Times
- Циркулюючий саліцилова кислота та метаболічний профіль після 1-річного втручання у харчування та поведінку