Оцінка протигрибкових засобів для лікування грибкового забруднення в середовищі повітря у приміщенні
Senthaamarai Rogawansamy
1 Лабораторія гігієни праці та навколишнього середовища, Дисципліна громадського здоров’я, Школа охорони здоров’я населення, Університет Аделаїди, Південна Австралія 5005, Австралія; Електронні листи: [email protected] (S.R.); [email protected] (M.T.); [email protected] (Д.П.)
Шарин Гаскін
1 Лабораторія гігієни праці та навколишнього середовища, Дисципліна громадського здоров’я, Школа охорони здоров’я населення, Університет Аделаїди, Південна Австралія 5005, Австралія; Електронні листи: [email protected] (S.R.); [email protected] (M.T.); [email protected] (Д.П.)
Майкл Тейлор
1 Лабораторія гігієни праці та навколишнього середовища, Дисципліна громадського здоров’я, Школа охорони здоров’я населення, Університет Аделаїди, Південна Австралія 5005, Австралія; Електронні листи: [email protected] (S.R.); [email protected] (M.T.); [email protected] (Д.П.)
2 Здоров’я та навколишнє середовище, Школа довкілля, Університет Фліндерса, Південна Австралія 5042, Австралія
Діно Пізаніелло
1 Лабораторія гігієни праці та навколишнього середовища, Дисципліна громадського здоров’я, Школа охорони здоров’я населення, Університет Аделаїди, Південна Австралія 5005, Австралія; Електронні листи: [email protected] (S.R.); [email protected] (M.T.); [email protected] (Д.П.)
Анотація
1. Вступ
Населення розвинених країн проводить більше 90% свого часу в приміщенні, а встановлення та обслуговування систем опалення, вентиляції та кондиціонування (HVAC) набуває все більшого значення. Спори грибків є загальними компонентами повітря як у приміщенні, так і зовні. Однак гриби стали однією з провідних причин скарг на якість повітря в приміщеннях (IAQ) у професійних умовах [1,2,3]. В даний час гриби часто спричиняють збудника хвороби у „синдромі хворої будівлі” [4], а зараження грибком приміщень у приміщеннях пов’язане з негативними наслідками для здоров’я, включаючи головний біль, алергію, астму, подразнюючу дію, проблеми з диханням, мікози (грибкові захворювання) та кілька інших неспецифічних проблем зі здоров’ям [5]. Понад 80 родів грибів асоціюються із симптомами алергії дихальних шляхів із Cladosporium, Alternaria, Aspergillus та Penicillium серед найпоширеніших родів алергенів [6]. Окрім алергенності, багато грибів виробляють мікробні леткі органічні сполуки (MVOC) та мікотоксини, які, як вважають, подразнюють дихальну систему. Дослідження досліджень на тваринах та дані професійних досліджень показали, що вплив мікотоксинів може призвести до подразнення слизової оболонки, шкірних висипань, запаморочення, нудоти та імуносупресії [7].
В Австралії в даний час не існує рекомендацій щодо якості повітря у приміщеннях для грибків у повітрі. Однак існує низка міжнародних настанов, як діючих, так і історичних (як зазначено в [3]), але, як правило, прийняті настанови Світової організації охорони здоров’я [11]. Оскільки зв’язок між вологістю, впливом мікробів та впливом на здоров’я неможливо точно визначити, „жодні кількісні орієнтири на основі здоров’я та порогові значення не можуть бути рекомендовані для прийнятних рівнів забруднення мікроорганізмами” [11]. Натомість рекомендується запобігати проблемам вологості та цвілі та швидко усувати їх, коли вони виникають, щоб зменшити ризик небезпечного впливу мікробів та хімічних речовин. Інші міркування включають взаємозв'язок між внутрішнім та зовнішнім рівнями, представлений одночасно зібраними зразками. Принцип полягає в тому, що нижчі рівні грибків у приміщенні, ніж на відкритому повітрі, вказують на прийнятне середовище в приміщенні, а різноманітність кімнатних родів грибів має бути подібним до тих, що зустрічаються на відкритому повітрі [3,5].
Щоб мінімізувати можливість опромінення, важливо відновити внутрішній простір з видимими грибковими забрудненнями. Процес виправлення передбачає видалення помітно забрудненого будівельного матеріалу та використання протигрибкового засобу для обробки поверхонь, разом із кроками для модифікації внутрішнього середовища для запобігання розвитку грибків у майбутньому [12]. Рекомендується використовувати пилосос HEPA у поєднанні з вологим протиранням непористих поверхонь для видалення дисперсних спор у будівлях [13].
Протигрибковий засіб, або фунгіцид, - це біоцидна хімічна сполука або біологічний організм, який використовується для знищення або інгібування грибків або спор грибків. Австралійські рекомендації щодо цвілі [14] широко прийняті у промисловості і рекомендують вологе протирання миючим засобом, розчином оцту або спиртовим розчином для видалення грибків із забруднених поверхонь. У ньому також перелічені протигрибкові засоби, такі як відбілювачі, спирт (100%), сполуки четвертинного амонію та формальдегід, як хімічні речовини, що використовуються при обробці грибків на поверхнях, але явно не рекомендує використовувати ці засоби для запобігання подальшому зростанню.
Метою цього дослідження було оцінити відносну ефективність п'яти комерційно доступних засобів для чищення, опублікованих або анекдотичних, для лікування грибків у приміщенні. П’ять агентів включали два загальноприйняті багатоцільові промислові дезінфікуючі засоби (Cavicide ® та Virkon ®), 70% етанол, оцет (4,0% –4,2% оцтової кислоти) та рослинна сполука (олія чайного дерева (Melaleuca alternifolia)).
2. Експериментальна секція
2.1. Вибір протигрибкового агента
2.2. Вибірка та ідентифікація екологічних грибів
Зразки повітря навколишнього середовища збирали на пластини з солодовим екстрактом агару (MEA) за допомогою одностадійного життєздатного каскадного ударника BioStage®, прикріпленого до пробовідбірника повітря SKC QuickTake ™ 30. Зразки повітря відбирали по 2 хв при витраті 28,3 л/хв [21]. Пластини з агаром інкубували протягом 7 днів при 25 ° С. Через 7 днів колонії грибів стрічкою піднімали на предметне скло і фарбували бавовняним синім лактофенолом протягом 5 хв перед спостереженням за допомогою фазово-контрастної мікроскопії (Nikon Eclipse Ci; Coherent Scientific). Два роди, що представляють найчастіше виділені гриби із зразків навколишнього середовища, були відібрані для використання в дослідженні (Aspergillus fumigatus з приміщення та Penicillium chrysogenum ззовні). Гриби, відібрані для використання в цьому дослідженні, представляють надзвичайно поширені повітряно-крапельні гриби, здатні рости на широкому діапазоні субстратів і часто виділяються із закритих середовищ не тільки в Австралії, але й у всьому світі [22,23].
Для отримання чистих культур з краю окремої колонії A. fumigatus за допомогою кінця скляної піпетки Пастера вирізали три агарові пробки діаметром 6 мм, асептично переносили на свіжу тарілку MEA та рівномірно розставляли. Це повторили для P. chrysogenum. Пластини загортали у плівку та інкубували при 25 ° C протягом 7 днів і спостерігали за появою чистих колоній грибів.
2.3. Протигрибкова ефективність за допомогою аналізу дифузії дисків
Аналіз дифузії дисків Фікера [24] використовували для оцінки інгібуючої дії протигрибкових засобів на ріст A. fumigatus та P. chrysogenum. Суспензії спор готували, заливаючи пластини з культурами грибів 3 мл стерильної дистильованої води, і стерильну петлю використовували для перемішування колоній. Сто мікролітрів кожної спорової суспензії використовували для інокуляції пластин MEA, які залишали сушитися при кімнатній температурі протягом 15 хв. Інокульовані пластини MEA розділяли на половинки, а 20 мкл кожного з випробовуваних речовин піпетували на автоклавований диск для фільтрувального паперу Whatman TM діаметром 9 мм і поміщали в середину кожної секції.
Фенол (88% розчин) використовували як позитивний контроль для пригнічення росту грибків, а стерильну дистильовану воду - як негативний контроль. Пластини герметизували парафільмом та інкубували при 25 ° C протягом 7 днів перед спостереженням за зростанням грибків та утворенням зон інгібування навколо дисків. Кожен тест повторювали мінімум 3 рази для кожного агента (додаткові повтори n = 4-6 проводили там, де був знайдений позитивний результат). Засіб класифікували як протигрибкову, коли діаметр зони гальмування перевищував 9,5 мм, на 0,5 мм більше діаметра паперового диска [24]. Це значення служить системою відліку, з якою можна порівняти протигрибкову сприйнятливість грибів. Чим більша концентрична площа пригніченого росту, тим більша ефективність протигрибкового засобу.
Протигрибкову активність ТТО у паровій фазі оцінювали, використовуючи модифікований метод [25]. Суспензію спор 100 мкл кожного виду гриба розподіляли на свіжі пластинки МЕА і давали їй висохнути на повітрі протягом 15 хв при кімнатній температурі. Двадцять мікролітрів ТТО піпетували на 9-міліметровий паперовий диск і поміщали на внутрішню поверхню кришки чашки Петрі, не маючи безпосереднього контакту з поверхнею інокульованого агару. Пластини швидко герметично закривали парафільмом, щоб мінімізувати витікання летких компонентів, потім інкубували при 25 ° C і спостерігали через 7 і 14 днів. Протигрибкову ефективність визначали шляхом вимірювання середнього перпендикулярного діаметра зони гальмування. Для вивчення ефекту інгібування росту ТТО з часом пластини для аналізу дисків пари та розчину ТТО для обох родів грибів повторно інкубували протягом додаткових семи днів після початкової обробки, доводячи загальний інкубаційний період до 14 днів. Після повторної інкубації аналітичні планшети повторно вимірювали на інгібування росту.
2.4. Аналіз даних
Порівняння зон інгібування протигрибковими агентами та контролю проводили за допомогою одностороннього ANOVA. Припущення про нормальність даних перевіряли та виконували для параметричного аналізу. Повторний аналіз проводили там, де це потрібно, за допомогою тесту множинних порівнянь Тукі. Значимість для всіх тестів була встановлена на рівні р ≤ 0,05. Статистичний аналіз проводили за допомогою програм SPSS v.16 та GraphPad Prism V.4.
3. Результати та обговорення
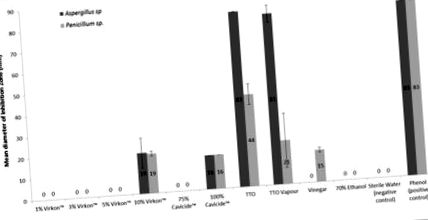
Встановлено, що олія чайного дерева, застосовувана як розчин для прямого контакту, має найвищий інгібуючий ефект на ріст як A. fumigatus, так і P. chrysogenum після семиденного періоду інкубації порівняно з іншими випробуваними протигрибковими засобами (рис. 1). Ріст A. fumigatus повністю пригнічував ТТО із середнім діаметром зони гальмування (83 мм), значно більшим, ніж інші досліджувані сполуки (р 2 = 0,9761), і порівнянним з результатами позитивного контролю фенолу. ТТО був менш токсичним для P. chrysogenum (середній діаметр зони гальмування 43,5 мм ± 4,93), але більш ефективний у пригніченні росту, ніж інші досліджувані сполуки (р 2 = 0,9620). ТТО при застосуванні у формі пари виявився менш ефективним, ніж пряме застосування при інгібуванні росту кондидатних грибів (A. fumigatus - середній діаметр зони гальмування 81 мм ± 4; P. chrysogenum - середній діаметр зони гальмування 20,6 мм ± 12,85 для аналіз пари).
Діаметр зон інгібування росту Aspergillus fumigatus та Penicillium chrysogenum після обробки з використанням різних протигрибкових засобів. Середнє значення ± SD (N = 40).
Віркон ® був ефективним лише для зменшення росту грибів при концентрації 10%, демонструючи середній діаметр зони гальмування 19,25 мм (± 7,08) для A. fumigatus та 18,67 мм (± 1,15) для P. chrysogenum (рис. 1). П’ятивідсотковий, 3% та 1% розчини Віркон ® не впливали на ріст жодного грибка.
Встановлено, що нерозбавлений Cavicide ® має подібний інгібуючий ефект на ріст обох грибів із середнім діаметром зони гальмування 16 мм (± 0) для обох (рис. 1). На відміну від цього, 75% кавицид не чинив інгібуючої дії на ріст жодного грибка.
Оцет (4,0% –4,2% оцтової кислоти) чинив інгібуючу дію на ріст P. chrysogenum із середнім діаметром зони гальмування 15 мм (± 1,15), але не виявляв інгібуючої дії на ріст A. fumigatus ( Фігура 1 ). Сімдесятивідсотковий етанол не мав видимого впливу на ріст обох грибків (рисунок 1).
Для деяких досліджуваних речовин, хоча зростання не залишалося незмінним, відзначалося пригнічення спороношення. П’ять відсотків, 3% та 1% Virkon ® інгібували спороношення P. chrysogenum, але не мали видимого впливу на спороношення A. fumigatus. Сімдесят п’ять відсотків Cavicide ® інгібували спороношення A. fumigatus, але не P. chrysogenum. Оцет пригнічував спороношення P. chrysogenum, але не впливав на спороношення A. fumigatus.
Потенційні триваліші ефекти пригнічення росту ТТО на A. fumigatus та P. chrysogenum показані на малюнку 2. ТТО, що застосовується у вигляді розчину, стає менш ефективним у пригніченні росту P. chrysogenum через 14 днів лікування (р = 0,004), але не так для A. fumigatus. Пара ТТО демонструє зниження пригнічення росту як функцію часу щодо обох грибів, хоча лише показано, що воно є значущим для A. fumigatus (р = 0,0002). Спороношення спостерігали на 14-й день лікування на всіх культурах, що зазнали впливу ТТО.
Різниця в зонах гальмування росту Aspergillus fumigatus та Penicillium chrysogenum через 7 та 14 днів після первинної обробки олією чайного дерева. Середнє значення ± SD (N = 24).
Олія чайного дерева як розчин прямого контакту було найбільш ефективним у пригніченні росту грибів обох випробовуваних видів серед усіх агентів, оцінених у поточному дослідженні. Цей результат узгоджується з раніше опублікованими даними про антимікробну ефективність ТТО in vitro з клінічних умов [17,18]. Вважається, що механізм протигрибкової дії ТТО полягає у зміні структури клітинної мембрани, внаслідок чого вона стає проникною, що призводить до витоку клітинного матеріалу та порушення функцій клітини [39]. Hammer та ін. [17] встановили, що ТТО мав як інгібуючу, так і фунгіцидну дію на ниткоподібні гриби. Автори виявили, що як пророщені конідії, так і невирослі конідії грибкових ізолятів продемонстрували сприйнятливість до ТТО. У поточному дослідженні результати показують, що P. chrysogenum менш сприйнятливий до ТТО, ніж A. fumigatus. Знижена сприйнятливість різних конідій до протигрибкових засобів, можливо, обумовлена товщиною, складом і щільністю стінки конідію.
Обробку 2,4% гіпохлоритом натрію (NaOCl) випробовували на Alternaria alternate, Aspergillus niger, Cladosporium herbarum, Penicillium chrysogenum, Stachybotrys chartarum і Trichophyton mentagrophytes і виявили, що інактивують всі спори основних культур до невизначуваних рівнів через 5 хв часу контакту на -пористі поверхні та через 10 хв часу контакту на пористих поверхнях [45]. Ці результати свідчать про те, що дезінфікуючі засоби гіпохлориту ефективно знижують поширення грибків та рівень алергенів у приміщенні. Гіпохлорит натрію також рекомендується використовувати в дуже низьких концентраціях (0,04%) для інактивації грибів на зернах, горіхах та овочах [46].
Ця робота широко висвітлює необхідність послідовності рекомендацій щодо усунення грибкових уражень та важливість перевірки анекдотичних доказів або «загальновідомих порад» протигрибкових засобів та процедур очищення. Важливо зазначити, що будь-який прийнятий протигрибковий засіб повинен застосовуватися разом із технічними заходами, такими як покращення вентиляції та зменшення вологості повітря в приміщенні, щоб запобігти подальшому зростанню.
4. Висновки
Внески автора
Шарін Гаскін та Майкл Тейлор задумали та спроектували дослідження. Senthaamarai Rogawansamy проводив збір даних за сприяння Шарина Гаскіна (відбір проб повітря для ізолятів грибів) та Майкла Тейлора (ідентифікація видів грибів). Аналіз даних проводила Шарин Гаскін. Сентаамараї Рогавансамі та Шарин Гаскін склали рукопис, а Майкл Тейлор та Діно Пізаніелло переглянули рукопис. Усі автори прочитали та схвалили остаточний рукопис.
Конфлікт інтересів
Автори не заявляють конфлікту інтересів.
- Лікування телят ботоксом у лондонській клініці Cosmedocs
- Найкращі позабіржові японські засоби для схуднення Магнітне пальцеве кільце для огляду пальців ноги Огляд лікування Яке середнє значення
- Рандомізоване контрольоване дослідження зменшення ваги як лікування раку молочної залози
- Найкращі програми для схуднення та програми схуднення в Хайдерабаді, Бангалорі, Ченнаї, Пуні та Індорі
- Набір для інтенсивного схуднення BeWell Green, 1 комплект - Інтернет-магазин Ecco Verde