Нові варіації гена адипонектину (ADIPOQ) може впливати на розподіл олігомерних комплексів
Анотація
Вступ
Ожиріння є головною проблемою в Сполучених Штатах, оскільки понад дві третини дорослих та третина підлітків класифікуються як люди з надмірною вагою або ожирінням Огден та ін. (2012). Хоча надмірна вага є фактором ризику діабету 2 типу, у більшості людей із ожирінням не розвивається діабет 2 типу (T2D) (Boyle et al. 2010; Eckel et al. 2011; Writing Group for the Search for Diabetes in Youth Study Group et al . 2007). Адипонектин може допомогти пояснити підвищений ризик розвитку СД2 у деяких людей із ожирінням. Адипонектин має протизапальні та сенсибілізуючі до інсуліну властивості, а низький рівень адипонектину передує розвитку інсулінорезистентності та T2D (Hotta et al. 2001; Lindsay et al. 2002). Механічно адипонектин сприяє дії інсуліну в периферичних тканинах, активуючи AMP-кіназу та p38 MAPK (Combs et al. 2001; Yamauchi et al. 2002). Однак вплив адипонектину на чутливість до інсуліну є більш клінічно значущим у людей із ожирінням. У худорлявих особин Мартін та співавт. (2005) та мишей Maeda et al. (2002), концентрації адипонектину не пов'язані з чутливістю до інсуліну; проте в контексті ожиріння концентрації адипонектину демонструють сильний зв'язок з рівнем інсуліну (Maeda et al. 2002; Martin et al. 2005).
Адипонектин кодується ADIPOQ (NCBI GeneID 9370), розташований на 3q27. ADIPOQ одиничні варіації нуклеотидів (SNV) були пов'язані з T2D (p -2), резистентністю до інсуліну (p -2) та адипонектином у сироватці крові (p -8) (Vasseur et al. 2002; Filippi et al. 2004; Hivert et al. 2008; Mackevics et al. 2006; Mousavinasab et al. 2006). Мультимеризується адипонектин, що призводить до чотирьох циркулюючих олігомерних форм: тримерів (LMW), гексамерів (MMW), високомолекулярних комплексів (HMW) та дуже високих молекулярних мас (VHMW) комплексів Tsao et al. (2002). Комплекси HMW та VHMW найбільш активні в біологічному відношенні Pajvani et al. (2004). На сьогодні описано п'ять причинних SNV (R55H, G84R, G90S, R112C та R131H). Ці SNV пов’язані з гіпоадіпонектинемією, порушенням мультимеризації адипонектину та T2D (Waki et al. 2003; Takahashi et al. 2000; Jungtrakoon et al. 2011). Однак ці SNV рідкісні і не можуть повністю пояснити варіабельність адипонектину, припускаючи, що існують невстановлені причинно-наслідкові SNV.
Таким чином, наша мета - виявити нове та відоме ADIPOQ кодування змін і відношення їх до олігомерних форм адипонектину. Шляхом секвенування ADIPOQ у підлітків з екстремальним рівнем адипонектину в сироватці крові (високим або низьким) ми збагатили нашу дослідницьку групу несинонімами ADIPOQ SNV. У цій статті ми представляємо ADIPOQ варіації кодуючої області та їх вплив на олігомеризацію адипонектину. Незважаючи на те, що вплив цих SNV може маскуватися на худорлявих осіб, після перевірки в механістичних дослідженнях, ці мутації можуть бути включені в метрику, яка використовується клініцистами для консультування дітей із групи ризику щодо їх підвищеного ризику резистентності до інсуліну до того, як вони стануть надмірно важими нечутливий.
Результати
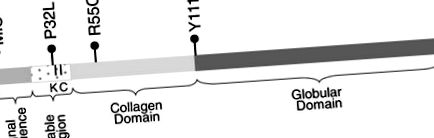
Було виявлено чотири несинонімічні SNV: пропуск ініціювання метіоніну (c.130 G> A скорочено MIS), P32L, R55C та Y111H (рис. 1). Кожен SNV був присутній як гетерозигота і виявлявся у однієї особини. Три з 4 SNV (MIS, P32L та R55C) були ідентифіковані серед 10 (30% успіху) осіб з найнижчим 1 відсотком адипонектину в нашій когорті з дуже низьким вмістом адипонектину в сироватці крові. У проекті NHLBI Exome лише 21 несинонім ADIPOQ зміни виявлено у 5138 осіб: рівень успіху 0,4 відсотка. Відбір осіб з найнижчим рівнем адипонектину для послідовності призвів до статистично значущого збагачення для несинонімічних змін порівняно з проектом послідовності NHLBI (точне значення p-тесту Фішера р -5).
ADIPOQ структура генів та місцезнаходження виявлених змін кодування. MIS, P32L, R55C та Y111H. K - положення гідроксильованого та глікозильованого лізину. C - положення цистеїну, що утворює дисульфідні зв’язки.
Особи з кодуючими SNV виявляли фенотипову неоднорідність щодо ІМТ та інсуліну (табл. 1), але показники глюкози були клінічно нормальними і, отже, не були представлені. Цікаво, що особи з SNV адипонектину та низькими значеннями адипонектину мали порушення олігомеризації, про що свідчать вестерн-блот (рис. 2) та олігомерні ІФА (табл. 2), навіть коли враховували мінливість ІМТ та інсуліну.
Олігомеризація адипонектину в сироватці крові за допомогою Вестерн-блот на нередукуючих гелях. C, негативний контроль лише буфера завантаження. V, особина з варіацією. М, відповідний контроль. MM, невідповідне управління. Через низькі концентрації адипонектину в деяких зразках гелі запускали з використанням двох різних концентрацій (панель A: 2 мкл, панель B: 4 мкл).
Ідентифікація нового адипонектину SNV: MIS
Наш учасник з ІСВ мав найнижчий адипонектин у когорті; однак ця особа виявляла нормальне ожиріння (процентиль ІМТ CDC, таблиця 3 In silico оцінка рідкісна ADIPOQ варіації (SNV)
Ідентифікація адипонектину SNV R55C
Наш учасник з R55C мав низький вміст адипонектину, був резистентним до інсуліну та страждав ожирінням (ІМТ ≥ CDC 95-й процентиль). Цей SNV нещодавно повідомлявся в рамках проекту NHLBI Exome, але жодної фенотипової інформації не було надано. Вестерн-блот показує відсутність VHMW і мало адипонектину HMW, зі значним діапазоном LMW при 2 мкл (рис. 2). При 4 мкл спостерігається подвійна смуга НМВ, можливо, вказуючи на димер, якого не було видно в інших зразках. З ІФА адипонектин HMW не виявляється. Вражаюче, що показники SIFT/Polyphen-2 для цієї мутації передбачають пошкоджуючий/ймовірно пошкоджуючий ефект, рівний за величиною причинній мутації R112C (Таблиця 3).
Ідентифікація адипонектину SNV Y111H
Особа з цим раніше повідомленим СНВ мала діабет 1 типу та рівень загального адипонектину вище нашого середнього показника в когорті. Ця особа була худорлявою і не продемонструвала ніяких відмінностей у циркулюючих олігомерних структурах щодо її відповідності або контролю невідповідності. Оцінки SIFT та PolyPhen-2 для цієї зміни передбачають, що Y111H переноситься та є доброякісним (Таблиця 3).
Обговорення
Оскільки адипонектин пов’язаний із ризиком розвитку ожиріння СД2, пов’язаного з ожирінням, і суттєво визначається генетичними факторами, наша мета полягала у визначенні нових та відомих ADIPOQ кодування змінюється і пов'язує їх зв'язок з олігомерними формами адипонектину. Застосовуючи надзвичайно суперечливий підхід до фенотипування, чотири несинонімічні гетерозиготи ADIPOQ були виявлені зміни, дві з яких були новими. Шляхом секвенування осіб з надзвичайно низьким рівнем адипонектину в сироватці крові ми збагатили зразок на несинонімічні SNV у порівнянні із зразком, секвенированним без урахування рівня адипонектину. Три із чотирьох SNV виявляли порушення олігомеризації, що відповідає біоінформативному передбачуваному функціональному ефекту. Після біологічної перевірки ці варіації можуть бути використані для виявлення осіб, яким загрожує ожиріння, пов'язана з ожирінням, резистентність до інсуліну та T2D.
Повідомлялося про Y111H (rs17366743) (Vasseur et al. 2002; Waki et al. 2003; Kretowski et al. 2005), з незначною частотою алелів 5,8%. Хоча попередні звіти свідчать про те, що рівні адипонектину знижувались за допомогою цього SNV (Vasseur et al. 2002; Kretowski et al. 2005), у людини з цією зміною рівень адипонектину був вище середнього для нашої когорти, що відповідає вищим рівням адипонектину, що спостерігаються у осіб із типом I цукровий діабет (Morales et al. 2004; Frystyk et al. 2005). Крім того, цей SNV не змінює олігомерного розподілу адипонектину.
У цій роботі ми повідомляємо про ідентифікацію трьох передбачуваних функціональних гетерозигот ADIPOQ SNV після секвенування десяти осіб з найнижчим вмістом адипонектину в нашій когорті. Враховуючи наш високий рівень успіху в ідентифікації кодуючих SNV, генерування генів-кандидатів та екстремальний підхід до фенотипу можуть бути чудовим механізмом доповнення сучасних підходів до секвенування екзомів. Що важливо, наш підхід виявив рідкісні гетерозиготні несинонімічні SNV; оцінка цих гетерозиготних несинонімічних змін може бути складною в даних секвенування екзоми, оскільки попередні дослідження продемонстрували, що тисячі несинонімічних SNV можуть бути присутніми в будь-якому окремому Wheeler et al. (2008). З огляду на велику кількість несинонімічних гетерозиготних змін, ймовірність будь-якого гетерозиготного SNV може бути досить значною. Дійсно, хоча R55C був ідентифікований у проекті секвенування екзомів NHLBI, немає досліджень, які б вивчали його вплив. Це може бути проблемою для адипонектину, оскільки всі функціональні SNV гетерозиготні (Jungtrakoon et al. 2011; Kondo et al. 2002; Vasseur et al. 2002).
Оскільки адипонектин відіграє важливу роль у опосередкуванні ожиріння, пов'язаного з ожирінням (Martin et al. 2005; Maeda et al. 2002), особливо високомолекулярні форми Pajvani et al. (2004), виявлення функціональних варіацій адипонектину може мати суттєві клінічні наслідки. Зокрема, якщо ці варіації спричиняють гіпоадіпонектинемію, то особам із цими змінами може знадобитися порадити більш агресивно підтримувати здорову вагу та дієту з низьким вмістом вуглеводів, оскільки ці особи мають найвищий ризик розвитку гіперінсулінемії та T2D. Однак одним з обмежень цього дослідження є невеликий обсяг досліджуваної вибірки, тому з цього дослідження неможливо встановити, чи можуть ці варіації траплятися у інших пацієнтів та призвести до тих самих висновків щодо олігомеризації. Тому важливо спочатку підтвердити ці результати біологічно та клінічно. Наприклад, дослідження рівня адипонектину в сироватці крові та олігомеризації у 21 особи з Проекту секвенування екзомів NHLBI із варіацією R55C може надати додаткову підтримку того, що ця варіація, ймовірно, функціональна.
Важливо визнати, що, хоча це дослідження було зосереджене на кодуванні змін, які потенційно можуть вплинути на рівень адипонектину та олігомеризацію, існують інші варіації в 5 ’-часткових областях гена, пов’язані з експресією гена адипонектину або рівнями сироватки крові. Зокрема, ми та інші повідомляли, що коливання між 10 і 12 кб вище за течією ADIPOQ сайт початку транскрипції може змінювати рівень адипонектину (Woo et al. 2006; Heid et al. 2010; Gupta et al. 2012), а проксимальні промоторні поліморфізми також мають відношення до Laumen et al. (2009). Оскільки особини були відібрані для секвенування та вестерн-блоттінгу лише на основі фенотипу, багато хто також містив різні промоторні області, синонімічні та інтронічні варіації, раніше генотиповані в цій популяції Woo et al. (2006). Однак у випадково вибраному наборі з 54 осіб з цієї когорти (дані не наведені) лише одна особа мала ШММ настільки низьку, як наша особина з P32L, і жодна така низька, як наші особи з R55C та MIS. Таким чином, навряд чи ці інші варіації відповідають за дуже низький рівень адипонектину HWM, присутній у наших людей зі структурними змінами.
Висновки
Підводячи підсумок, ми виділили два нові синоніми ADIPOQ варіації з використанням екстремального підходу до послідовності фенотипів. Особи з цими новими варіаціями мали низький рівень адипонектину і виявляли знижені структури ГМВ порівняно з особами без цих варіацій. Хоча кожна варіація присутня в гетерозиготному стані, ефекти можуть бути переважно негативними. Це дослідження підкреслює корисність секвенування осіб з надзвичайними фенотиповими значеннями для виявлення нових змін у кодуванні. Ці варіації можуть надати важливі підказки щодо відносин між людьми ADIPOQ генетичні варіації, олігомерний розподіл адипонектину та загальний рівень адипонектину в циркуляції. Дійсно, майбутні дослідження цілком можуть продемонструвати, що рідкісні потенційно причинно-наслідкові зміни, виявлені в цьому дослідженні, сприяють статистичній асоціації більш поширених варіацій з метаболічними фенотипами у більших популяцій.
Методи
Захист суб'єктів людини
Це дослідження було схвалено Інституційною комісією з огляду медичного центру дитячої лікарні Цинциннаті. Усі учасники або батьки/опікуни надали письмову інформовану згоду. Суб'єкти віком до 18 років дали згоду.
Населення
Загальна схема дослідження - це екстремальний підхід до фенотипу (рис. 3). Коротко, було обрано 30 учасників з ненормальним рівнем адипонектину або специфічними фенотипами ADIPOQ секвенування; 10 з найнижчим рівнем адипонектину (діапазон 0,6 - 2,5 мкг/мл), 10 з найвищим рівнем адипонектину (діапазон 19,9 - 29,15 мкг/мл), 5 діабетиків (4 T2D, 1 T1D) та 5 з резистентністю до інсуліну (діапазон 127 - 1327 пмоль/л інсуліну). З цих осіб 48 відсотків були чоловіками, середній вік становив 14,4 року, а чорно-білих було рівною кількістю.
Дизайн дослідження призвів до збагачення предметів зі змінами, що не відповідають вимогам.
Всі 30 учасників були відібрані з більшої когорти з 1196 чорно-білих студентів, які мали рівні адипонектину, проаналізованих Мартіном та ін. (2005). У свою чергу, 1196 учасників були випадковим чином відібрані з дослідження 2501 студента шкільного округу міста Принстон (Цинциннаті, штат Огайо), які були зараховані з п’ятого по дванадцятий класи для участі у шкільному дослідженні вуглеводного обміну Долан та ін. . (2005). Вимірювали зріст і вагу та відбирали зразки крові.
Лабораторні дослідження
Сироватковий інсулін, глюкоза та адипонектин натще аналізували, як описано раніше (Martin et al. 2005; Dolan et al. 2005). Олігомерні аналізи на адипонектин (вестерн-блот та ІФА) проводили у 12 осіб. Для Western Blots SDS-PAGE проводили за методом Леммлі Laemmli (1970). Буфер зразка для нередукуючих, не денатураційних тепла умов становив 2% SDS, 50 мМ Tris – HCl рН 6,8 і 10% гліцерину. Зразки інкубували протягом ночі в буфері для зразків при 4 ° C і розділяли, використовуючи 4-12% градієнтні гелі SDS-PAGE (Jules, Inc., Milford, CT) при постійній напрузі 80 В. Білки, відокремлені SDS-PAGE, переносили в мембрани нітроцелюлози і блокували буферним сольовим розчином, забуференним Tris, 0,5% Твін, що містить 3% знежиреного молока, та інкубували з поліклональним антитілом, специфічним для людини ADIPOQ (0,2 мкг/мл; R&D Systems, Міннеаполіс, Міннесота) протягом ночі при кімнатній температурі. Після ретельного промивання мембрани інкубували з кон'югованим HRP поліклональним ослом-козлом IgG (1: 5000; Chemicon, Temecula, CA) протягом 1 години при кімнатній температурі. Смуги виявляли за допомогою хемілюмінесцентного реагенту для виявлення (Pierce, Rockford, IL) та впливу рентгенівської плівки (Amersham, Великобританія). Діапазони LMW, MMW та HMW були класифіковані як
75 кД, 135–150 кД і
300 кД відповідно, відповідно до попередніх звітів (Pajvani et al. 2004; Waki et al. 2003); спостерігається більш висока смуга кД була класифікована як дуже висока молекулярна маса (VHMW). Для подальшого вивчення олігомерних профілів ми використовували ALPCO HMW та ELISA для загального адипонектину відповідно до інструкцій виробника (ALPCO, Salem, NH) Ebinuma et al. (2006).
Послідовність
ДНК витягували із замороженого баф'яного шару за допомогою системи Magnesil (Promega Corporation, Madison, WI), автоматизованої на магнітному маніпуляторі KingFisher96 (Thermo Electron, Waltham, MA). Праймери для посилення ADIPOQ область кодування (екзон 2 і 5 ′ кінець екзона 3, таблиця 4) були розроблені з використанням ExonPrimer (http://ihg.gsf.de/ihg/ExonPrimer.html). Фрагмент 1954 п.н. ампліфікували з 50 нг геномної ДНК за допомогою системи ПЛР AmpliTaq Gold (Applied Biosystems, Фостер-Сіті, Каліфорнія), модифікованої зі стандартних умов за рахунок підвищення температури відпалу до 65 ° C і тривалості продовження до 3 хвилин. ПЛР-праймери та нуклеотиди ферментативно видаляли з амплікону перед безпосереднім секвенуванням за допомогою ExoSAP-IT (GE Healthcare, Fairfield, CT). Всього було проведено 4 реакції секвенування для отримання двонаправленого секвенування всієї кодуючої області (праймери в таблиці 4) з використанням набору BigDye v3.1 Terminator на ДНК-аналізаторі 3730xl (Applied Biosystems). Аналіз SNV проводили за допомогою програмного забезпечення Mutation Surveyor v2.61 (SoftGenetics, State College, PA).
Особи з несинонімічними змінами кодування відповідали віку (± 6 місяців), стадії статевого дозрівання, статі та расі серед осіб із більшої когорти. Було обрано один контроль (Match-A) з аналогічним показником BMI Z та інсуліном, враховуючи демографічну відповідність. Вибрано другий контроль (Match-B), який відповідає демографічним змінним та Z-оцінці ІМТ, але відрізняється щодо інсуліну. Відповідні елементи управління були послідовно розподілені, щоб переконатись, що вони не містять місця ADIPOQ зміни кодування.
Статистичний аналіз
Z-показник ІМТ розраховували на основі таблиць зростання CDC. Резистентність до інсуліну визначали як рівень інсуліну> 95% неблагополучної особини в загальній когорті з 2501 студентів з однаковою стадією раси, статі та статевого дозрівання. (2005). Визначити, чи є особи з ADIPOQ кодуючи зміни виявляли екстремальні фенотипи, ми розрахували 5-й та 95-й процентилі за віком, адипонектином, інсуліном, глюкозою та Z-оцінкою ІМТ, використовуючи нашу когорту з 1196 студентів Мартіна та ін. (2005). Для порівняння частоти виявлення несинонімічних SNV до загальнодоступної бази даних (Проект секвенування екзома NHLBI) ми використали точний тест Фішера.
- Швидке автоматизоване вимірювання розподілу жиру в організмі з МРТ всього тіла, Американський журнал
- Російський рітейлер X5 Retail відкриває дистриб'юторський центр в Ярославлі
- PLOS ONE Трансляційна сигналізація, атрогенна та міогенна експресія генів під час розвантаження та
- Reddit - AsianBeauty - Чи може масаж обличчя насправді змінити розподіл жиру на обличчі
- Традиційні португальські ковбаси різних видів, поживного складу та нових тенденцій -