Низький аеробний енергетичний метаболізм мітохондрій при погано або недиференційованій нейробластомі
Анотація
Передумови
Сукцинатдегідрогеназа (SDH) пов'язана з канцерогенезом у феохромоцитомі та парагангліомі. У цьому дослідженні ми досліджували компоненти системи окисного фосфорилювання у зразках тканини нейробластоми людини.
Методи
Спектрофотометричні вимірювання, імуногістохімічний аналіз та Вестерн-блот-аналіз використовувались для характеристики аеробного мітохондріального енергетичного обміну в нейробластомах (NB).
Результати
Порівняно з мітохондріальною цитрат-синтазою, активність SDH була сильно знижена в NB (n = 14) порівняно з нирковою тканиною. Однак жодної з чотирьох субодиниць SDH не вдалося виявити патогенних мутацій. Крім того, ніяких генетичних змін не вдалося виявити у двох нових факторах збірки SDH SDHAF1 та SDH5. Зміни в генах, що кодують nfs-1, фратаксин та isd-11, які можуть призвести до зниження активності SDH, у NB не виявлені.
Висновок
Оскільки спостерігалося також зниження регуляції інших комплексів системи окисного фосфорилювання, у нейробластомі, здається, присутнє більш узагальнене зменшення дихання мітохондрій на відміну від дефекту одиничного ферменту, виявленого у спадкових феохромоцитомах.
Передумови
Відповідно до Міжнародної класифікації патологій нейробластоми (NB), NB визначаються як ембріональні пухлини симпатичної нервової системи, походять від нервового гребеня та виникають в мозковому відділі надниркових залоз, паравертебральних симпатичних гангліях та симпатичних парагангліях [3.0.CO; 2-7 . "href ="/article/10.1186/1471-2407-10-149 # ref-CR1 "> 1]. Парагангліома та феохромоцитома гістологічно пов'язані з NB, оскільки всі вони є похідними нервового гребеня. NBs в основному складаються з незрілих нейробластів, тоді як феохромоцитоми та парагангліоми містять зрілі хромафінні клітини.
Феохромоцитоми та парагангліоми часто виявляють мутації в субодиницях сукцинатдегідрогенази (SDH) SDHB, SDHC, SDHD, що вказує на те, що ці субодиниці SDH діють як супресори пухлини в нейроендокринних тканинах [2]. Комплекс SDH складається з чотирьох субодиниць і містить молекулу флавіну (FAD), негемові центри заліза та цитохром b-типу в якості протезних груп. Комплекс закріплений великим SDHC і невеликою субодиницею SDHD, які разом містять мембранний протеїн-гемовий білок cyt b [3]. Крім того, нещодавно було повідомлено про два фактори складання SDH SDHAF1 та SDH5. SDH5 - це ген, необхідний для флавації SDH [4]. Патогенні мутації SDH5 були виявлені в парагангліомах [5].
Мутації в генах PHOX2B та анапластичної лімфоми-кінази (ALK) пов’язані зі схильністю до нейробластоми [6–10]. Мутації PHOX2B були виявлені у меншості випадків сімейної нейробластоми. До цих пір не було продемонстровано чіткого зв'язку з енергетичним метаболізмом для цих двох генів.
Аеробне використання глюкози як джерела енергії за допомогою гліколізу є ознакою, спільною для більшості солідних пухлин, що, в свою чергу, призводить до меншої залежності від OXPHOS, що називається ефектом Варбурга [25, 26]. Зниження регуляції OXPHOS в клітинах пухлини, здається, досягається за допомогою різних механізмів. По-перше, глибока гіпоксія може бути причиною компенсаторної регуляції гліколізу в більшості пухлин. По-друге, стає все більш очевидним, що втрата генів супресорів пухлини, таких як VHL і с53 або активація онкогенів призводить до зниження регуляції OXPHOS [27, 28]. Нарешті, пряма інактивація компонентів OXPHOS була виявлена у меншості пухлин. Окрім взаємозв'язку SDH та розвитку пухлини, втрата NADH: убихінон оксидоредуктази (комплекс I) дихального ланцюга також була виявлена при оксифільних пухлинах [29, 30].
Метою цього дослідження було визначити, чи є специфічні зміни аеробного енергетичного метаболізму в НБ, особливо SDH, чи є загальна регуляція комплексів OXPHOS.
Хоча загальновизнано, що тверді раки в більшості випадків демонструють перехід від окисного фосфорилювання до гліколізу, тип зміни не досліджувався у багатьох видах раку, і, наскільки нам відомо, не при нейробластних пухлинах.
Методи
Зразки
NB від 14 пацієнтів були отримані з Університетської лікарні Зальцбурга, Австрія та лікарні Ольги, Штутгарт, Німеччина. П'ятнадцять неушкоджених тканин нирок служили еталонами для ферментативних вимірювань. Для імуногістохімічних досліджень використовували фіксований формалін, вбудовані в парафін NB та незмінені тканини надниркових залоз.
Дослідження проводилось відповідно до австрійського Закону про генні технології. Експерименти проводились відповідно до Гельсінської декларації 1975 р. (Переглянутої 1983 р.) Та керівних принципів Зальцбурзького комітету з питань етики (етична угода: AZ 209-11-E1/823-2006), оскільки клінічне випробування наркотиків та епідеміологічне дослідження не проводилось. Усі пацієнти підписали інформовану згоду щодо хірургічного видалення та терапії пухлин. Крім того, дослідження не поширилося на вивчення окремих записів справ. Забезпечена анонімність пацієнтів.
Всі тканини були заморожені та зберігались у рідкому азоті протягом 30 хв після операції. Вміст клітин пухлини та клітинний склад зразків оцінювали із застосуванням заморожених зрізів, пофарбованих гематоксилін-еозином. Досліджували зразки тканин із вмістом пухлинних клітин понад 90%. У дослідженні використовували слабо диференційовані або недиференційовані пухлинні тканини (табл. 1).
Вимірювання ферментів
Тканини NB та нирок (20-100 мг) гомогенізували дезінтегратором тканин (Ultraturrax, IKA, Staufen, Німеччина) в екстракційному буфері (20 мМ Tris-HCl, pH 7,6, 250 мМ сахарози, 40 мМ KCl, 2 мМ EGTA) і, нарешті, гомогенізували за допомогою моторного гомогенізатора з тефлонового скла (Potter S, Braun, Melsungen, Німеччина). Гомогенат центрифугували при 600 ° С g протягом 10 хв при 4 ° C. Постнуклеарний супернатант (600 g гомогенат), що містить мітохондріальну фракцію, використовували для вимірювання активності ферментів та вестерн-блот-аналізу. Цитрат-синтазу визначали за даними Srere [31] із модифікаціями. Коротко кажучи, реакційна суміш містила 50 мМ трис-HCl рН 8,1, 0,1% бичачого сироваткового альбуміну (BSA), 0,1% TritonX-100, 0,2 мМ 5,5'-дитио-біс (2-нітробензойна кислота), 0,15 мМ ацетил- CoA та 600 г гомогенату. Після первинного запису активності тіолази протягом 2 хв реакцію цитрат-синтази розпочинали додаванням 0,5 мМ оксалоацетату і спостерігали при 412 нм протягом 8 хв. Середня неспецифічна активність тіолази в NBs становила 2% від активності CS.
Активність ферментів комплексів OXPHOS визначали, як описано раніше [32, 33]. Коротко, чутливу до ротенону активність комплексу I вимірювали спектрофотометрично як NADH/децилюбіхінон оксидоредуктаза при 340 нм. Активність ферментів цитрат-синтази та комплексу IV (ферроцитохром с/оксидоредуктаза кисню) та чутливу до олігоміцину АТФазу активності F1F0 АТФ-синтази визначали, використовуючи буферні умови, як описано раніше Рустіном та співавт. (1994) [34]. Всю реакційну суміш для вимірювання активності АТФази обробляли протягом 10 секунд ультрасоніфікатором (Bio cell disruptor 250, Branson, Відень, Австрія). Активність SDH вимірювали згідно з Rustin et al. із наступними змінами. Реакційна суміш містила 50 мМ фосфату калію, рН 7,8, 2 мМ ЕДТА, 0,1% BSA, 3 мкМ ротенону, 80 мкМ 2,6-дихлорфенолу, 50 мкМ децилюбіхінону, 1 мкМ антиміцину А, 0,2 мМ АТФ, 0,3 мМ KCN і 600 г гомогенат. Суміш попередньо інкубували протягом 10 хв при 37 ° С, починали додаванням 10 мМ сукцинату, після чого протягом 6 хв при 600 нм.
Реакційна суміш для вимірювання активності комплексу III містила 50 мМ фосфатний буфер калію рН 7,8, 2 мМ ЕДТА рН 8,6, 0,3 мМ KCN, 100 мкМ цитохрому с, 200 мкМ відновленого децил-убіхінолу. Реакцію розпочинали додаванням 600 г гомогенату. Через 3 - 4 хв реакцію гальмували додаванням 1 мкМ антиміцину А. Антиміцин А-нечутливу активність віднімали від загальної активності для розрахунку активності комплексу III. Всі спектрофотометричні вимірювання (Uvicon 922, Kontron, Мілан, Італія) проводили при 37 ° C.
Послідовність SDHA, SDHB, SDHC, SDHD, SDHAF1, SDH5, nfs-1, LYRM4, фратаксин, PHOX2B та ALK
ДНК виділяли за допомогою набору тканин NucleoSpin ® (Macherey-Nagel). РНК виділяли з кріосекцій тканин NB за допомогою Tri-Reagent ™ (Molecular Research Center Inc., Цинциннаті, Огайо). 2 мкг РНК обробляли ДНКазою I (Ambion, Остін, штат Техас) і зворотну транскрипцію здійснювали зворотною транскриптазою 140 U Superscript II (Invitrogen Corporation, Карлсбад, Каліфорнія) відповідно до інструкцій виробника. Для ампліфікації ПЛР використовували 100 нг геномної ДНК (для секвенування SDHB, SDHC, SDHD, SDHAF1, SDH5, PHOX2B) або кДНК (для секвенування SDHA, фратаксину, nfs1, LYRM4, ALK) (табл. 2). Продукти ПЛР інкубували з Exo SAP IT 500 (USB Corporation), а для реакції секвенування використовували комплект швидкого запуску CEQ DTCS (Бекман Коултер) з використанням праймерів ПЛР, перелічених у таблиці 2, з подальшим поділом за допомогою системи аналізу ДНК CEQ 2000 ( Бекман Коултер).
Визначення числа копії мтДНК
Кількість копії mtDNA визначали, як описано раніше [35].
Вестерн-блот-аналіз
Імуногістохімічне фарбування та аналіз
Використовували фіксовані формаліном та вбудовані в парафін пухлинні тканини. Для імуногістохімічного фарбування використовували такі антитіла: миша моноклональна антикомплекс II субодиниця 70 кДа Fp (1: 5000; MitoSciences), миша моноклональна антикомплекс III субодиниця Core 2 (1: 1500; MitoSciences) та миша моноклональна антипорін 31HL (1: 3000; MitoSciences) антитіла. Всі антитіла розбавляли в розчиннику антитіл Dako з фоновими відновлюючими компонентами (Dako).
Зрізи 5 мкм депарафінізовані та регідратовані з подальшим нагріванням індукованого епітопу в буфері TE-T (10 мМ основа Тріс, рН 9,0, 1 мМ ЕДТА, 0,05% Твін 20) протягом 40 хв при 95 ° C і 20 хв при RT . Зрізи промивали в дистильованій H2O і врівноважували забуференним фосфатом фізіологічним розчином, що містить 0,5% Твін 20 (pH 7,4, PBS-T). Фарбування проводили за допомогою системи виявлення Envision (Dako) відповідно до інструкцій виробника з наступною візуалізацією діамінобензидином (DAB) протягом 1 хв. Скла були забарвлені гематоксиліном.
Результати
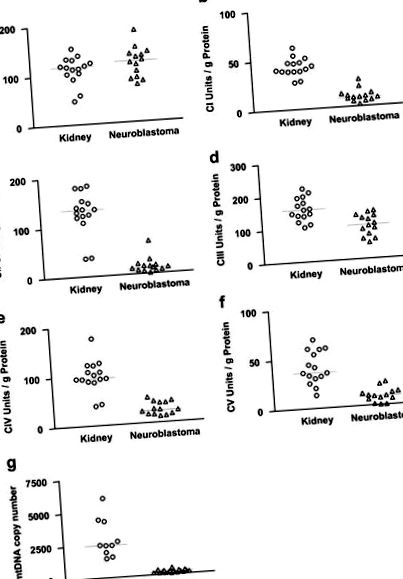
Характеристики 14 педіатричних пацієнтів та їх пухлин із НБ наведені в таблиці 1. Активність цитратсинтази була порівняно високою у нормальних тканинах коркової нирки та НБ (рис. 1). Більше того, рівень активності цитрат-синтази відповідав рівню порину, визначеному імуногістохімічним фарбуванням. Як цитратсинтаза, так і порин часто використовуються як маркерні білки для мітохондріальної маси. NB показали лише незначне зниження рівня порину порівняно з нормальною корою надниркових залоз та тканиною довгастого мозку надниркових залоз (рис. 2). Отже, мітохондріальні маси НБ та нормальної ниркової тканини були подібними.
Активність комплексів OXPHOS у нормальних тканинах нирок та НБ. a: цитратсинтаза (CS), b: комплекс I (CI), c: комплекс II (CII), d: комплекс III (CIII), e: комплекс IV (CIV), f: комплекс V (CV), g: номер копії mtDNA.
- Muscletech Vitamax Energy and Metabolism for Men SX-7 Black Onyx 120 таблетки; Харчування Bizz
- Метаболізм для ванни - найкращі солі для ванни; Краща ванна Краще тіло
- Metabolism Boost Кращий крем для схуднення
- Посилення метаболізму у Бадана
- Відгуки про втрату ваги доктором Мо