Некротизуючий ентероколіт асоціюється з гострими реакціями мозку у недоношених свиней
Анотація
Передумови
Некротизуючий ентероколіт (НЕК) - це гострий запальний розлад кишечника, який виникає у недоношених дітей у перші тижні після народження. Немовлята, які пережили НЕК, часто виявляють порушення нервового розвитку. Механізми, що пов'язують ураження НЕК з пізнішим нейророзвитком, недостатньо вивчені, але можуть включати прозапальну сигналізацію в незрілому мозку. Використовуючи недоношених свиней як модель для недоношених дітей, ми висунули гіпотезу про те, що важкі ураження кишкового тракту пов'язані з гострим впливом на розвивається гіпокамп.
Методи
Недоношені свині, доставлені кесаревим розтином (n = 117) вирощували протягом 8 днів і спонтанно розвивали змінну тяжкість уражень НЕК. Збудження новонароджених, фізична активність та нейротогенні ефекти цереброспінальної рідини in vitro досліджували у свиней, що виявляли ураження NEC в товстій кишці (Co-NEC) або в тонкій кишці (Si-NEC). Аналіз транскриптома гіпокампа та qPCR використовували для оцінки експресії генів та їхнього відношення до біологічних процесів, включаючи нейрозапалення, та нейронну пластичність. Активація мікроглії була кількісно визначена стереологією. Нейрітогенну реакцію на вибрані білки досліджували в первинних культурах нейронів гіпокампа.
Результати
Розвиток НЕК швидко знизив фізичну активність свиней, особливо коли ураження відбувалися в тонкому кишечнику. Si-NEC та Co-NEC були пов'язані з 27 та 12 диференційовано експресованими генами гіпокампа (DEG) відповідно. Сюди входили гени, пов’язані з нейрозапаленням (тобто., S100A8, S100A9, IL8, IL6, MMP8, SAA, TAGLN2) та гіпоксія (тобто., PDK4, IER3, TXNIP, АГЕР), і всі вони були регульованими у свиней Si-NEC. Гени, пов'язані із захистом від окисного стресу (HBB, ALAS2) та олігодендроцити (ОПАЛІН) були знижені у свиней Si-NEC. ЦСЖ, зібрана у свиней NEC, сприяла зростанню нейритів in vitro, а білки S100A9 та S100A8/S100A9 можуть опосередковувати нейритогенні ефекти пов'язаної з NEC ЦСЖ на нейрони гіпокампа. Поразки NEC не впливали на загальну кількість клітин мікрогліальних клітин, але помітно збільшили частку Iba1-позитивних амебоїдних мікрогліальних клітин.
Висновки
Ураження NEC, особливо коли вони присутні в тонкому кишечнику, пов'язані зі змінами експресії гена гіпокампа, які потенційно опосередковують нейрозапалення та порушують формування нервових ланцюгів за рахунок посиленої нейрональної диференціації. Ранні втручання у захист мозку можуть бути критично важливими для недоношених дітей, уражених кишковими ураженнями НЕК, для зменшення їх пізніх неврологічних дисфункцій.
Передумови
Некротизуючий ентероколіт (НЕК) - це гостре руйнівне запальне захворювання кишечника, яке переважно виникає у недоношених дітей незабаром після народження [1]. Епідеміологічні дослідження показують, що 45% тих, хто вижив із НЕК, мали неврологічні порушення у віці 20 місяців з вищим ризиком розвитку ДЦП, слуху, зору, когнітивних та психомоторних порушень [2, 3]. Важкий НЕК, що вимагає хірургічного втручання, є незалежним фактором ризику важкої травми головного мозку, виявленої при МРТ, поганого психічного та психомоторного розвитку приблизно у віці 2 років [4, 5] та різних когнітивних дефіцитів у шкільному віці [6]. Цілком можливо, що НЕК може спричинити гострі пошкодження головного мозку та подальші тривалі порушення нервового розвитку. Проте основні механізми та пов'язані з NEC гострі ефекти мозку в основному невідомі.
Недоношені свині, виведені в період вагітності 90%, виявляють порушення розвитку кишечника, імунітету та мозку з високою чутливістю до новонароджених інфекцій (тобто НЕК та сепсис) та дефіциту поведінки та навчання [21,22,23]. Таким чином, велика частка недоношених свиней розвиває НЕК спонтанно протягом першого тижня після народження, коли їх годують неоптимальними дієтами (наприклад, дитячими сумішами чи молоком для донорів людини) [24]. На відміну від моделей гризунів, ця модель не вимагає надмірного лікування переохолодження та гіпоксії [21]. Використовуючи недоношених свиней як модель для недоношених новонароджених, ми висунули гіпотезу, що ураження NEC можуть спричинити негайні зміни в гіпокампі, що розвивається, що може допомогти пояснити пізні дефіцити нейророзвитку у тих, хто вижив. Ми показуємо, що конкретно ураження NEC, розташовані в тонкому кишечнику, пов'язані зі зниженою фізичною активністю та підвищенням регуляції генів, пов'язаних із запаленням, в гіпокампі. Вплив нейронів гіпокампа на СЧС свиней з НЕК сприяв переростанню невритів in vitro, можливо, через пов'язані з НЕК фактори ЦСЖ, такі як білки VEGF, CINC-3 та S100A9. Таким чином, наші результати підтверджують гіпотезу про те, що ураження НЕК призводять до негайного впливу на мозок, що розвивається у недоношених дітей.
Методи
Спонтанна модель NEC у недоношених свиней
Сто сімнадцять недоношених поросят були доставлені від восьми свиноматок шляхом кесаревого розтину на 106 день (90% вагітності, данський ландрас x Large White x Duroc, ферма Askelygaard, Данія). Свиней утримували в індивідуальних інкубаторах з регульованою температурою (37–38 ° C) та подачею кисню (0,5–2,1/хв, протягом перших 24 годин). Свиням вводили орогастральний зонд для годування та пупковий катетер для батьківського харчування та інфузії плазми свиноматки, як описано раніше [25]. Для індукування спонтанного НЕК [21] недоношених свиней годували поступово зростаючими дозами людського донорського молока (0–135 мл/кг/день) та поступово зменшуючи дозами парентерального харчування (96–48 мл/кг/день) протягом 8 днів, як описано раніше [24, 25].
Активність домашньої клітки та записи збудження новонароджених
Протягом періоду дослідження фізичну активність усіх поросят реєстрували за допомогою інфрачервоних відеокамер, підключених до реєстратора руху. Частка активного часу була проаналізована за допомогою прикладного програмного забезпечення PIGLWin (Ellegaard System, Фаборг, Данія), як описано раніше [26]. Збудження новонароджених у кожного поросяти реєстрували як час від народження до першого відкривання очей, першого стояння та першої ходьби, як описано раніше [26].
Збір тканин, оцінка NEC та експресія цитокінів у кишечнику
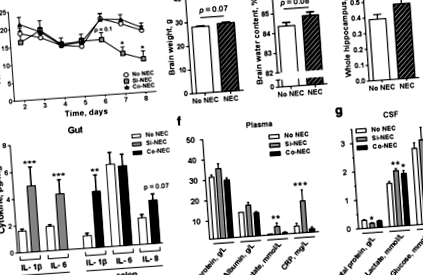
Свиням знеболювали, а кров брали шляхом серцевої пункції з подальшою евтаназією внутрішньосерцевою ін’єкцією пентобарбіталу натрію (60 мг/кг). Фракції гепаринізованої плазми збирали і зберігали при - 80 ° C. Зразки ліквору відбирали підпотиличною пункцією відразу після евтаназії, розподіляли їх аликвотами та зберігали при - 80 ° C. Після визначення мокрої ваги мозку мозок швидко розсікали, а ліві утворення гіпокампа швидко заморожували у рідкому азоті та зберігали при - 80 ° C до подальшої обробки. Праву півкулю фіксували у 4% параформальдегіді. Суху вагу мозку та вміст води визначали після висихання решти тканин мозку до постійної маси.
Аналіз зразків плазми та ліквору
Спектрофотометричне вимірювання вмісту оксигемоглобіну в зразках ліквору проводили при A450 нм для виключення зразків, що містять забруднення крові [29]. Загальну концентрацію білка у зразках ліквору та у плазмі крові вимірювали за допомогою набору для білкового аналізу Pierce BCA. Альбумін плазми, ліквору, лактату та глюкози вимірювали за допомогою аналізатора цільної крові GEM premier 3000 (Instrumentation Laboratory, Bedford, MA). Концентрацію С-реактивного білка в плазмі крові (CRP) вимірювали методом ІФА (DY2648, R&D системи, Міннеаполіс, Міннесота, США).
Аналіз переростання невритів
Аналіз RNA-seq гіпокампа
Цілісні заморожені гіпокампі (n = 5–6 на групу) гомогенізували кріогенним пульверизатором тканин у рідкому азоті, а загальну РНК виділяли за допомогою міні-набору RNeasy Lipid Tissue Mini (Qiagen, Копенгаген, Данія). Цілісність зразків РНК для аналізів RNA-seq та qPCR оцінювали за допомогою Agilent Bioanalyzer 2100 та RNA 6000 Nano Chips (Agilent Technologies, Glostrup, Данія) і давали середнє число цілісності РНК (RIN) 8,5 (SD ± 0,6). Бібліотеки секвенування були побудовані з використанням підготовчого набору бібліотек РНК NEBNext UltraTM для Illumina (New England BioLabs, Іпсвіч, Массачусетс, США), дотримуючись рекомендацій виробника. Після ампліфікації продукти очищали системою AMPure XP і оцінювали якість бібліотеки на системі Agilent Bioanalyzer 2100. Кластеризація індексовано кодованих зразків проводилася на системі генерації кластерів cBot за допомогою кластерного набору HiSeq 4000 PE (Illumina, Сан-Дієго, Каліфорнія, США). Після генерації кластера сконструйовані бібліотеки кДНК були послідовно розподілені на платформі Illumina Hiseq 4000 (Illumina) та генеровано необроблені зчитування з парним кінцем на 150 bp.
Сирі зчитування були оброблені для отримання чистих зчитувань, включаючи видалення послідовності адаптерів, і низькоякісні зчитування, що містять або більше 50% основ з q значення
Результати
НЕК асоціюється зі зниженою фізичною активністю, кишечником та системним запаленням
По-перше, ми дослідили, чи пов'язаний NEC зі зміненою фізичною активністю. Час, що пройшов до першого стояння, прогулянки або розкриття століття, був подібним між свинями NEC та No NEC (Додатковий файл 2: Таблиця S1). Зокрема, свині Si-NEC демонстрували тенденцію до зниження фізичної активності, починаючи з 6-го дня (стор = 0,1) і надалі (стор Рис. 1
Діагностика NEC була підтверджена аналізом тканинних протизапальних цитокінів [28], які виявили значне збільшення експресії IL-1β та IL-6 у дистальному відділі тонкої кишки тварин Si-NEC (обидва стор Рис.2
Транскриптом гіпокампа і біологічні процеси, що стосуються уражень НЕК
Аналіз GO всіх цих генів, пов'язаних з NEC, виявив чотири біологічних процеси в гіпокампі, які можуть бути пов'язані з NEC, включаючи "міграцію лейкоцитів, що бере участь у відповіді на запалення", "регулювання біосинтетичного процесу оксиду азоту", "регулювання ремоделювання тканин" і “Регулювання рН” (рис. 3c; додатковий файл 3: таблиця S5). Більшість генів, що беруть участь у цих функціях, були регульованими лише у свиней Si-NEC, за винятком HBB (залучений до регуляції процесу біосинтезу оксиду азоту), який був регульований в обох групах НЕК (рис. 3в). Більше того, ми ідентифікували 76 DEG між Si-NEC і групою Co-NEC, і 23 та 3 з них раніше були ідентифіковані як гени, пов'язані з Si-NEC та Co-NEC, відповідно (рис. 3а, додатковий файл 3: Таблиця S4 та додатковий файл 1: Рисунок S3c).
Потім кілька генів, специфічних для свиней Si-NEC, з кожної категорії біологічних процесів були перевірені qPCR. Таким чином, регуляція PDK4 і S100A8 у свиней Si-NEC було підтверджено (стор Рис.4
NEC асоціюється з активацією мікроглії
Далі ми продовжили вивчати, чи зміни у цитокіновому профілі ліквору та експресії гена гіпокампа у свиней NEC були пов’язані з активацією мікроглії-резидента. Гіпокампі свиней із NEC або без нього фарбували на маркер мікроглії Iba1, а кількість та морфологію мікрогліальних клітин аналізували із використанням неупередженого стереологічного підходу (рис. 5а). Не було статистичних відмінностей у загальній кількості мікроглії серед груп (стор > 0,05, рис. 5б). Аналіз морфологічного фенотипу Iba1-позитивних клітин показав, що мікроглі з розгалуженими відростками були найвидатнішим типом у всіх трьох групах. Однак спостерігались також мікроглії з амебоїдним фенотипом [38], і їх кількість значно зросла в гіпокампах обох груп NEC (стор Рис.5
Гетерокомплекс S100A9 та S100A8/S100A9 сприяють зростанню нейритів
Нарешті, ми далі досліджували потенційні біологічні ефекти білків, кодованих генами гіпокампа, асоційованими з NEC, а саме S100A8 та S100A9 (кальгрануліни). Раніше було показано, що кілька інших представників сімейства S100, включаючи S100A4 та S100A12, сприяють переростанню невритів із різних типів первинних нейронів [57, 58]. Отже, ми дослідили, чи впливали гетерокомплекс S100A8, S100A9 та S100A8/S100A9 (кальпротектин) на розвиваються нейрони гіпокампа in vitro. Первинні нейрони стимулювали серійно розведеними S100A9, S100A8 та S100A8/A9 протягом 24 годин. Як показано на рис. 6a, b, S100A9 та S100A8/A9 сприяли переростанню невритів залежно від дози, тоді як ніякого впливу S100A8 на розширення невриту виявити не вдалося. Далі підтверджують, що індуковані запаленням білки можуть впливати на розвиваються нейрони гіпокампа.
Обговорення
Загальновизнано, що реакції на запалення та окислювальний стрес часто виникають одночасно, але незрозуміло, чи активовані гіпоксією гени виконують послідовну, корелятивну чи причинну роль. DEG Si-NEC були високо збагачені регульованими генами, пов'язаними з гіпоксією (див. Розділ "Результати"), та кодируючими транскриптами, що регулюються заниженою кількістю. HBB та його синтетаза ALAS2. Відомо, що гемоглобін бета (HBB) експресується в нейронах [72], астроцитах гіпокампа та зрілих олігодендроцитах [73] і є нейропротектором проти окисних та нітрозативних стресів [74]. HBB може також підтримувати метаболізм нейронів через епігенетичний контроль гістонів [75] та функції мітохондрій нейронів [72]. Таким чином, регулювання, пов'язане з Si-NEC, HBB тому може виявити нейрони для потенційного окислювального та NO-стресу та пригнічувати функції мітохондрій гіпокампа. Разом події, пов’язані із запаленням та гіпоксією, здається, відповідальні за вплив Si-NEC на розвивається гіпокамп.
Ми спостерігали збільшення популяції амебоїдної мікроглії в гіпокампі свиней NEC, що становило близько 10–20% від загальної кількості мікрогліальних клітин. Однак ми не спостерігали різниці між групами в загальній кількості мікроглії. Відносно низька кількість активованої мікроглії можна пояснити підвищеною регуляцією ADM, оскільки адреномедулін знижує регуляцію LPS-індукованої активації мікроглії та зменшує продукцію прозапальних цитокінів in vitro [76]. Далі, регульований вираз S100A8 і S100A9, та їх рецептора RAGE, може відігравати певну роль, оскільки розчинний RAGE може функціонувати як рецептор-приманка, послаблюючи прозапальну дію білків S100. Нарешті, пов'язане з NEC регулювання USP18 (Рис. 3a, Додатковий файл 3: Таблиця S3), що кодує убіквітин-специфічну протеазу 18, негативний регулятор активації мікроглії [77], тому може протидіяти дії NEC на активацію мікроглії.
Загалом, ми спостерігали більш глибокі зміни в експресії гена гіпокампа у свиней Si-NEC, ніж у свиней Co-NEC. Ці зміни свідчать про потенційне нейрозапалення, гіпоксію та окислювальний дистрес, які більш очевидні у свиней з ураженням НЕК в тонкій кишці, ніж у товстій кишці. Це може бути пов’язано з тим, що тонкий кишечник у ранній період життя більш вразливий до образ, ніж товста кишка [78, 79], а НЕК тонкої кишки частіше пов’язаний із збільшенням тяжкості захворювання та смертності, меншим поглинанням поживних речовин та високим ризиком транслокації бактерій [ 28]. Деякі свині групи Si-NEC також мали ураження NEC в товстій кишці, проте профіль експресії гена гіпокампа цих свиней не відрізнявся від свиней, які мали NEC лише в тонкому кишечнику (додатковий файл 1: Рисунок S4). Окрім запалення новонароджених, гіпотрофія, пов’язана з НЕК, та поганий ріст також є факторами ризику травм головного мозку та порушень нервового розвитку недоношених дітей [80,81,82]. Однак харчові фактори можуть не відігравати вирішальної ролі в цьому дослідженні, оскільки постійне парентеральне харчування всіх тварин і вага тіла не відрізнялася серед груп.
Висновок
Наші результати допомагають пояснити, чому НЕК в ранньому віці пов’язаний із поганим неврологічним результатом у недоношених дітей. Ми показуємо, що особливо ураження NEC в тонкому кишечнику пов'язані зі зміненою фізичною активністю та глибоким впливом на експресію гена гіпокампа, пов'язане із запаленням та гіпоксією. СМЖ свиней, позитивних до NEC, сприяє зростанню нейритів та розгалуженню нейронів, таким чином припускаючи, що периферичне запалення може перешкоджати дозріванню нейронів. Результати показують важливість надання захисних заходів для головного мозку госпіталізованим недоношеним дітям, які зазнають важких уражень НЕК. Потрібні подальші дослідження, щоб з’ясувати, чи пов’язане з НЕК запалення в мозку, що розвивається, негативно впливає на формування нейронної мережі та когнітивні функції більш довгостроково.
Скорочення
Індукований цитокінами хемоаттрактант нейтрофілів
- Пацієнт долає рідкісний гострий некротизуючий панкреатит - ScienceDaily
- Результати PRIME PubMed FDG PET-CT про позагрудний саркоїд пов’язані із серцевим саркоїдом A
- Майлі Сайрус відмовляється від веганства, кажучи, що її мозок не функціонує належним чином
- Поживні речовини Безкоштовний повнотекстовий дієтичний коефіцієнт n-6n-3 впливає на склад жирних кислот мозку у дорослих щурів
- Зниження маси тіла PRIME PubMed, пов'язане із загальним результатом лікування сибутраміном