Мікрокомп’ютерна томографія дозволяє покращити візуалізацію міканій у процесі розвитку та між статями жуків Euwallacea ambrosia
Еллі Шпар
Відділ рослинництва та ґрунтознавства, Університет Західної Вірджинії, Моргантаун, Західна Вірджинія, Сполучені Штати Америки
Метт Т. Кассон
Відділ рослинництва та ґрунтознавства, Університет Західної Вірджинії, Моргантаун, Західна Вірджинія, Сполучені Штати Америки
Тейя Кіджімото
Відділ рослинництва та ґрунтознавства, Університет Західної Вірджинії, Моргантаун, Західна Вірджинія, Сполучені Штати Америки
Пов’язані дані
Анотація
Вступ
Вирощування грибів, мабуть, найвідоміший приклад опосередкованого грибами симбіозу, розвинулось у багатьох лініях комах або як єдине джерело харчування, або як доповнення харчових потреб [4]. Екологія та еволюція вирощування грибів широко вивчалась у перетинчастокрилих (мурах), Blattodea (термітів) та Coleoptera (жуків) [4, 5]. У мурах і термітів мікофагія еволюціонувала лише один раз і вражаюче випромінювала, приводячи до різноманітних існуючих на сьогоднішній день клад [6, 7]. На відміну від мурах і термітів, жуки неодноразово розвивали харчові симбіози з грибами протягом усього ряду колеоптерів [6, 8].
Жуки-амброзії представляють дві підродини довгоносиків (Curclionidae: Scolytinae, Platypodinae), які підтримують зв'язкові харчові взаємності. В симбіозі амброзії обов’язкові харчові симбіози еволюціонували паралельно із приблизно 11 незалежними джерелами вирощування грибів. Кожна взаємозв'язок збіглася з незалежним походженням спеціалізованих структур (мікангій) для перенесення симбіотичних пропагул всередині або на тілі комахи [5, 8, 9]. Ці структури розвиваються всередині або зовні через голову, грудну клітку та живіт і можуть варіюватися від неглибоких ямок в екзоскелеті до складних мішків або трубчастих структур [9]. Деякі мікангії показали докази залозистих клітин, але поглиблена категоризація потенційних секреторних функцій не була ретельно досліджена у всіх мікангіях [10, 11]. Крім того, поглиблені анатомічні дослідження окремих видів жуків на різних етапах життя або статі ніколи офіційно не досліджувались.
Жуки Euwallacea ambrosia приділяли значну увагу протягом останнього десятиліття через шкоду, яку вони завдають різноманітним деревам у середовищі, де вторглись середовища існування по всьому світу, включаючи Ізраїль, Австралію, Мексику, США та, нещодавно, Південну Африку [12–15] . Виходячи з Азії, ці жуки завдали серйозної шкоди виробництву авокадо у всьому світі та вплинули на численних деревних господарів як у культивованому, так і в лісовому середовищі [16]. Один з видів, що представляє особливий інтерес, Euwallacea validus, інтродукований з Азії на схід США наприкінці 1900-х рр. [17], має парні оральні мікангії та переносники двох видів грибів; первинний поживний симбіонт Fusarium oligoseptatum та Raffaela subfusca, вторинний гриб, який послідовно відновлюється з жіночих голів із інтродукованих популяцій на сході США, але роль якого залишається незрозумілою [13, 18].
Жуки-ксилеборини, включаючи Euwallacea spp., Розмножуються шляхом спарювання гаплодиплоїдного сиб [19]. Як і в типових гаплодиплоїдних репродуктивних системах, диплоїдні самки вибірково запліднюють яйця, щоб отримати жіноче потомство, тоді як незапліднені гаплоїдні яйця дають початок чоловічому потомству, яке потім буде спаровуватися зі своїми братами та сестрами в галерейному тунелі [20]. Самки жуків відіграють головну роль у опосередкуванні симбіозу з F. oligoseptatum, розподіляючи їх між деревами-господарями, тоді як самці зменшуються в розмірах і не літають; функція всередині галереї зводиться до розмноження та, можливо, підтримки грибків [20].
На сьогоднішній день парні оральні мікангії були описані у дорослих жінок-ксилеборіні з використанням як деструктивних, так і неруйнівних методів секціонування. Дослідження з поперечним перерізом мікротомів (деструктивний метод), такі як повідомлення про Xyleborus glabratus від Фрідріха та співавт. (2008), Xyleborus affinis від Hulcr і Cognato (2010) та Ambrosiodmus lecontei від Li et al. (2015) виявили базову структурну організацію та підтвердили наявність грибкових пропагул [21–23]. Більш детальні структурні дослідження мікангії у Ксилеборіні та близькоспоріднених таксонів (Premnobiina) базуються на методології мікротомів із використанням нових неруйнівних методів візуалізації. Мікангії Ambrosiodmus lecontei, A. minor, Ambrosophilus atratus, Premnobius cavipennis та Euwallacea interjectus спостерігали за багатьма методами (мікротом, сканування LAT та μCT) [24, 25].
Таблиця 1
| E. fornicatus | Вища медіальна | Фарбування GFP | Фрімен та ін. 2016 [29] | |
| E. interjectus | Нижній бічний | MicroCT | поперечний і сагітальний | Цзян та ін. 2019 [30] |
| E. interjectus | Вища медіальна | LATscan | поперечний | Лі та ін. 2018 [25] |
| E. perbrevis | Вища медіальна | Ілюстрація | поперечний і сагітальний | Фернандо 1960 [26] |
| E. sp. | Верхня медіальна і нижня бічні | Описовий | Не застосовується | Goto 1998 [28] |
| E. validus | Вища медіальна | Розділ мікротомів | невизначений | Накашима 1982 [27] |
| E. validus | Вища медіальна | Розділ мікротомів | поперечний | Кассон та ін. 2013 [13] |
Тут, інтегруючи дві методи візуалізації (традиційне поперечне перерізування мікротомів та μCT) всієї голови, наша мета - збагатити знання щодо розвитку мікангії на різних етапах життя жуків, а також між статями. Зокрема, ми зосередились на вивченні термінів розвитку, а також можливого статевого розвитку мікангій у E. validus. Такі дослідження також важливі для Ксилеборіні, оскільки; 1) попередні дослідження, як правило, зосереджувались на підтвердженні однієї пари мікангій, забезпечуючи лише частковий або одноплощинний поперечний зріз голів дорослих самок, можливо, з видом на наявність вторинних структур; і 2) кілька Euwallaea spp. дали більше одного гриба з подібними вмістами у своїх мікангіях [13, 31], що підвищує можливість спільного культивування в одиночних мікангіях або спеціалізованих структурах, пристосованих для кожного симбіонту [32].
Матеріали і методи
Вирощування протоколу
Методи вирощування були адаптовані від Cooperband et al. (2016) [33] з урахуванням регіональних переваг господаря (Ailanthus altissima) для наших цільових видів жуків-амброзій, Euwallacea validus. Кінцівки Ailanthus altissima були зрубані та зібрані в кампусі Евансдейла Університету Західної Вірджинії в Моргантауні, Західна Вірджинія. Кінцівки розрізали на поперечні зрізи довжиною 2,5 см і сушили при кімнатній температурі протягом декількох тижнів. Висушений матеріал кінцівок подрібнювали до розміру частинок трапецієподібних тирси розміром 1 мм для середовищ, що вирощують жуків, за допомогою пульвісетту 25 для різання Fritsch Power (Fritsch GmbH, Німеччина). Стерилізований агар з тирси, як описано Cooperband et al. (2016) [33] готували у 50 мл сокольних пробірках.
Пізньою весною (червень) жуки були вилучені із заражених стеблів Ailanthus altissima в лісі Університету Західної Вірджинії. Стебла були розрізані на 0,6-міліметрові ділянки та поздовжньо розділені на чверть, щоб відкрити галерейні тунелі. Жуків усіх стадій життя збирали з галерей за допомогою механічної сили та діставали за допомогою стерильної води та малярських пензлів або щипців з м’яким захопленням. Життєві етапи зберігалися окремо. Потім жуків переносили на неінокульовані середовища та забезпечували “стартові” тунелі вздовж зовнішньої частини трубки. По 5 дорослих самок жуків та до додаткових 3 самців було внесено в одну пробірку середовища та поміщено в інкубатор при 26 ° C.
Постановка тварин
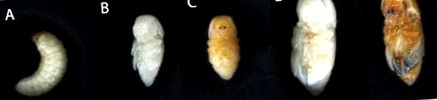
Лялечок ставили та відбирали на основі забарвлення на капсулі голови та надкрилах (рис. 1). Дорослі самки ставили за кольором тіла (рис. 4); колір відноситься до ступеня склеротизації екзоскелету та оцінює зрілість дорослої особи після линьки.
«Пізні» та «ранні» етапи позначень були зроблені на основі забарвлення капсул для голови та надкрил. Тварини, близькі до еклозії, здаються темнішими по всьому тілу тварини.
Сині ящики позначають верхню, медіальну мікангію, тоді як червоні позначають нижню, бічну торбинки. A-D) Зовнішній вигляд чудових поперечних перерізів (E-H). I-L) Сагітальні поперечні розрізи виявляють вищу мікангію та нижчі мішечки у пізніх лялечок (K) та дорослих (L) самок жуків. M, N) Нижній поперечний переріз ілюструє парні нижчі мішечки у пізніх лялечок (M) та дорослих (N) самок жуків.
Мікрокомп’ютерна томографія
Euwallacea validus фіксували в 70% етанолі при кімнатній температурі принаймні протягом ночі. Потім комах фарбували протягом ночі в 5% розчині Люголя (I3K), модифікованому від Metscher et al. (2009) [34] щодо йоду в плямах йодистого калію.
Сканування проводили за допомогою Skyscan 1272 μCT (Bruker). Зразки сканувались у етанолі у насадках для піпеток на 200 мкл, встановлених на підставці. Параметри сканування були уніфіковані для всіх зразків (об'єднання 2x2 при розмірі пікселя 4,3 мкм, без фільтра. Рентгенівське джерело встановлено на 50 кВт та 200 мкА). Дані сканування були скомпільовані за допомогою NRecon (версія 1.7.1.0) та обрізані в Dataviewer (версія 1.5.3.4). Цифрові перерізи та відеозаписи були отримані з 3D-моделі в CTVox (версія 3.3). Детальний знятий фільм доступний як додатковий фільм (https://doi.org/10.6084/m9.figshare.12221981.v1).
Поперечний переріз мікротомів
Зразки фіксували у 2% PFA протягом ночі та замочували у фенолі протягом 6 днів перед вкладанням парафіну та його поперечним розрізом (як модифіковано з Li et al. 2015) [23]. До введення парафіну комах повторно фіксували формальдегідом, а потім зневоднювали у серії градієнтів етанолу. Зразки зберігали до секції. Поперечні зрізи були зроблені за допомогою поворотного мікротома Microm HM 325 (Walldorf, Німеччина) та предметних стекол, забарвлених вручну у гематоксилін та еозин-флоксин Гарріса. Слайди отримували за допомогою складеного мікроскопа Nikon Eclipse E600 (Nikon Instruments, Melville, NewYork) та мікроскопа Nikon Digital Sight DS-Ri1 з високою роздільною здатністю за допомогою програмного забезпечення для обробки зображень Nikon NIS-Elements BR 3.2.
Результати
Детальний опис дорослих самок мікангії
Дорослі самки жуків демонструють дві пари оральних мішків (у всіх п’яти зразків дорослих самок комах). Перший набір організований супермедіальним до нижньої щелепи в (ростральній) головній тканині (рис. 2А, 2В і 2С). Друга пара організована латерально, поступаючись задній частині нижньої щелепи, біля кожного складного ока (рис. 2А, 2В і 2D, див. Також додатковий фільм; https://doi.org/10.6084/m9.figshare.12221981.v1) . Поперечний розріз мікротомів виявив внутрішню колонізацію як медіальних верхніх кишень (рис. 3C), так і на бічній стороні голови біля ока (рис. 3F), як еквівалент нижчих суглобоподібних структур на наших зображеннях μCT. Стовпчасті клітини вистилають первинну мембрану бічних мішкоподібних структур (S1B та S1C Рис.). Канальцеподібні конструкції (S1A, S1B та S1E Fig) присутні поруч із камерою, але ми не спостерігали фізичного зв'язку між цими ознаками серед створених нами секцій. Далі ділянки мікротомів вказували на те, що у жуків розвиваються невеликі шипи та волоскоподібні структури в протоці (S1A, S1B, S1D та S1E Рис.). Подібні стовпчасті клітини, що вистилають бічні мішечки разом із периферичними протокоподібними та волоскоподібними структурами, можна побачити в латеральних мікангіях близьких родів жуків, а також більш віддалених споріднених племен (S2 Рис.) [24, 35].
Сині ящики позначають верхню, медіальну мікангію (C), а червоні - нижню, бічну структуру (D). Площина візуалізації для кожної парної структури (C, D), позначена відповідним кольором (E).
- Мікрокомп’ютерна томографія дозволяє покращити візуалізацію мікангії протягом розвитку та між ними
- Ресурси для зміцнення здоров’я - діти, люди похилого віку та соціальний розвиток
- Розмови в клініці Майо Епізод 49 Дієти з примхливими явищами Школа постійного професійного розвитку в клініці Майо
- Здорове харчування - діти, люди похилого віку та соціальний розвиток
- Графіки годування LifeStart призводять до кращого розвитку вимені