Метаболоміка плазми виявляє нижчі концентрації карнітину у собак-лабрадорів із надмірною вагою
Анотація
Передумови
Поширеність надмірної ваги зростає у собак, але метаболічні події, пов'язані з цим станом, все ще недостатньо вивчені. Метою дослідження було дослідити постпрандіальну реакцію метаболітів плазми за допомогою тесту на випробування їжі та виявити метаболічні зміни, пов'язані зі спонтанною надмірною вагою у приватних собак.
Результати
Було включено двадцять вісім здорових самців інтактних собак лабрадор-ретрівер, 12 з яких були класифіковані як худі (оцінка стану тіла (BCS) 4–5 за 9-бальною шкалою) і 16 як надмірна вага (BCS 6–8). Після нічного голодування (14–17 год) відбирали зразки крові, а собак згодом годували їжею з високим вмістом жиру. Зразки крові після їжі збирали щогодини чотири рази. Метаболіти плазми були виявлені за допомогою ядерно-магнітного резонансу. Постпрандіальні метаболоми відрізнялись від метаболомів натще при багатовимірному дискримінантному аналізі (PLS-DA: Q 2 Y = 0,31–0,63, перехресна перевірка ANOVA: P ≤ 0,00014) Одинадцять метаболітів, усі амінокислоти, сприяли поділу. Карнітин було визначено як метаболіт, пов’язаний із зайвою вагою (поетапний логістичний регресійний аналіз P ≤ 0,03), а собаки із надмірною вагою мали загальну нижчу реакцію карнітину (аналіз повторних вимірювань змішаної моделі P = 0,005), ніж худі собаки. Примітно, що середня концентрація карнітину натощак у собак із надмірною вагою (9,4 ± 4,2 мкМ) була близькою до запропонованої контрольної межі для недостатності карнітину.
Висновки
Виявлено амінокислотну відповідь після їжі, але не було виявлено змін, що залежать від часу щодо груп стану тіла. Більш низькі концентрації карнітину були виявлені у людей із надмірною вагою порівняно з худими собаками. Останні результати можуть свідчити про недостатність карнітину, пов’язану зі спонтанним ожирінням та зміною ліпідного обміну у собак із надмірною вагою у цій групі здорових лабрадорів.
Передумови
Ожиріння є складним розладом і стало однією з основних проблем зі здоров'ям собак, а також людей [1,2,3,4]. Регулювання ваги у собак є складним завданням як для власників, так і для ветеринарів. Сучасна терапія для собак із зайвою вагою зосереджена головним чином на обмеженні енергії, що не завжди є успішним [5, 6]. Отже, велика кількість собак страждає від хронічної надмірної ваги і має підвищений ризик низької якості життя, раннього початку хронічних захворювань та скороченого терміну життя [7,8,9].
У собак, як і у людей, надмірна вага може призвести до порушення обміну речовин, наприклад інсулінорезистентність та гіперліпідемія [10,11,12,13]. Незважаючи на зростаючу поширеність ожиріння серед собак, молекулярні механізми, пов'язані з цим станом, досі не повністю вивчені. Ядерно-магнітний резонанс (ЯМР) є потужним та широко використовуваним інструментом для виявлення молекулярних змін за різних умов [14]. Метод ЯМР дозволяє ідентифікувати та кількісно визначити різноманітні метаболіти (переважно малі аміни та органічні кислоти) і може дати нові уявлення про метаболізм у стані здоров'я та хвороб. Недавні дослідження метаболоміки показали, що у людей із надмірною вагою часто підвищені концентрації ацилкарнітинів у плазмі [15,16,17] та амінокислот з розгалуженим ланцюгом [18, 19], і що у перегодованих собак може спостерігатися двофазна картина різних метаболітів плазми, тобто під час гострого набору ваги, а згодом і нормалізації при хронічній надмірній вазі [20]. Метод ЯМР має потенціал для виявлення метаболічних змін між худими та собаками з надмірною вагою, але широко не використовується для вивчення метаболітів плазми у собак із спонтанною надмірною вагою.
У кількох дослідженнях, що вивчали метаболоми плазми натще у собак, було показано, що метаболом натще змінюється залежно від індивідуальних варіацій та дієти [20,21,22], а собаки із надмірною вагою демонструють зміни в метаболітах, пов’язаних з метаболізмом ліпідів [23, 24]. У людини метаболом після їжі є менш мінливим, ніж натще і може генерувати більше інформації про важливі метаболічні зміни, які інакше було б важко виявити [25,26,27,28,29]. У собак із надмірною вагою ми раніше виявляли більш виражені метаболічні зміни в постпрандіальному режимі порівняно з сечею натще [30]. Отже, метаболоміка плазми у поєднанні із прийомом їжі може покращити розуміння собачого метаболізму та виявити незначні метаболічні зміни, пов’язані із зайвою вагою у собак. Наскільки нам відомо, метаболом плазмової маси худорлявих та спонтанно надмірної ваги, але здорових собак в іншому випадку під час випробування на їжу, раніше не публікувався. Отже, метою дослідження було дослідити постпрандіальні метаболіти плазми у здорових лабрадорів-ретриверів з надмірною та надмірною вагою за допомогою тесту на випробування їжі та виявити метаболічні зміни, пов’язані із спонтанною надмірною вагою.
Методи
Тварини
Загальний навчальний дизайн
Оцінка стану здоров’я та стану організму
Кожна собака проходила стандартне фізичне обстеження (оцінка загального стану, стану шкіри, ректальної температури, видимих слизових оболонок, прощупуваних лімфатичних вузлів, аускультації серця та легенів, пальпації живота та ходи). Собак зважували та фотографували. Були проведені планові гематологічні та біохімічні аналізи (аланінамінотрансфераза, лужна фосфатаза, жовчні кислоти натще, креатинін, сечовина, глюкоза, фруктозамін, загальний білок, альбумін, С-реактивний білок, загальний тироксин, тиреотропний гормон, натрій, калій та хлорид). на зразки крові натще. Сечу аналізували за допомогою стандартного хімічного тесту щупа та рефрактометрії. Деякі незначні проблеми зі здоров’ям (злегка скута хода та м’яка кульгавість, м’який періодонтит, відчутне навколосуглобове утворення остеофітів та фурункульоз шкіри) були виявлені у 11 собак. Жодна з цих собак не була виключена, оскільки життєві параметри, гематологія, біохімія сироватки крові та аналіз сечі знаходились у межах референтних діапазонів для здорових собак.
Тим же ветеринаром (JS) собакам був присвоєний показник клінічного стану тіла (BCS) за 9-бальною шкалою [32], а граничне значення для надмірної ваги (BCS ≥ 6) було застосовано до класифікувати собак як худих або із зайвою вагою. За даними BCS, худу групу (BCS 4–5) складали 12 собак (середнє значення ± SD, вік 5,3 ± 1,4 року, маса тіла 34,8 ± 2,5 кг), а групу із зайвою вагою (BCS 6–8) складали 16 собак ( вік 5,2 ± 1,6 року, маса тіла 39,5 ± 4,6 кг), де розрахункова худорлява маса тіла становила 36,2 ± 3,3 кг. Вага тіла суттєво різнилася між групами станів тіла (Р = 0,004), тоді як вік та ідеальна вага тіла не відрізнялися. Частота, з якою собакам вручали обрізки столів, ласощі або жування собак, не відрізнялася між групами станів тіла (Таблиця 1). Концентрацію лептину в сироватці крові використовували для перевірки клінічного групування стану організму [30].
Тест на виклик їжі
Збір проб крові
Після фізичного огляду катетер (Venflon ™ Pro 1,1 * 32 мм, Becton – Dickinson, Сінгапур, Малайзія) поміщали в дистальну головну вену і відбирали проби крові за 15 хв до (натщесерце), а потім щогодини протягом 4 год прийом їжі (після їжі). Катетер промивали 2 мл фізіологічного сольового розчину після кожного забору крові. Сироваткові пробірки (Hettich Vacuette Z Serum Clot Activator, Greiner bio-one, Kremsmünster, Австрія) залишали згущуватися при кімнатній температурі протягом 30 хв, а потім центрифугували при 1500 ×g протягом 10 хв. Плазмові пробірки (літієвий гепарин Hettich Vacuette, Bio-one Greiner, Кремсмюнстер, Австрія) центрифугували (як зазначено вище) безпосередньо після відбору проб. Сироватку та плазму переносили в поліпропіленові пробірки (SC Micro Tube PCR-PT, Sarstedt AG & Co, Нюмбрехт, Німеччина) і негайно заморожували при - 70 ° C. Сироватку натощак аналізували на біохімію як предиктор загального стану здоров’я, а плазму з усіх часових точок використовували для ЯМР-аналізів. Катетер видаляли після остаточного забору крові.
Цільовий ЯМР-аналіз метаболоміки
Підготовка зразків, збір даних ЯМР та спектральна обробка
Ідентифікація та кількісне визначення метаболітів плазми
Кожен окремий метаболіт оцінювали за допомогою набору показників якості [36], щоб визначити, чи підходить він для включення до статистики чи ні. Критеріями включення плазмових метаболітів, кількісно визначених AQuA, у поточному дослідженні були: CV ≤ 20%, наявність метаболітів ≥ 50% усіх зразків та відсутність позиційного відхилення позиційного сигналу між експериментальними спектрами. Встановлено, що можна кількісно визначити 43 із 55 метаболітів з прийнятною якістю за допомогою AQuA. Глюкоза та молочна кислота були виключені із набору даних під час статистичних оцінок, оскільки їх велика мінливість пригнічувала коливання в межах інших метаболітів у багатоваріантних статистичних моделях. Отже, 41 метаболіт залишився і був включений до остаточних багатовимірних моделей та однофакторного статистичного аналізу (додатковий файл 3).
Статистичний аналіз
Різні багатоваріантні моделі використовувались як відправна точка для ідентифікації дискримінантних метаболітів, які змінювались з часом у тесті на прийом їжі або були пов’язані із зайвою вагою. Дискримінантні метаболіти були додатково досліджені за допомогою змішаних моделей повторних аналізів. Значення P 1 і для якого відповідні 95% -ні довірчі інтервали (КІ), що базуються на ножах, не були близькими або не включали нуль, вважалися дискримінаційними та значущими для спостережуваних поділів.
Поетапний логістичний регресійний аналіз
Для кожного часового моменту для визначення метаболітів, пов’язаних із надмірною вагою (BSC ≥ 6), використовували двійкову (тобто худі та групи собак із надмірною вагою) поступову логістичну регресію [38]. Для цього було використано логістичну процедуру в пакеті SAS (2014, 9.4 Institute Inc., Cary, NC).
Змішана модель аналізу повторних вимірів
Реакції плазми на тест на виклик їжі оцінювали шляхом аналізу змішаних моделей повторних вимірювань [39] в SAS [38, 40]. У статистичній моделі група станів тіла була визначена як незалежна змінна, а значення голодування було включено як момент часу. Модель аналізувала реакцію протягом часу від голодування до 4 год після годування та відмінності між худими та групами із надмірною вагою. Таким чином, модель могла здійснювати загальне та парне порівняння та мала можливість скоригувати багаторазові порівняння в рамках моделі за допомогою корекції Тукі – Крамера. Логарифмічне перетворення вихідних даних проводили з метою виправлення ненормальності (на основі розподілу залишків у моделі) при статистичному аналізі концентрацій карнітину та 3-гідроксибутирату. Тільки дискримінантні метаболіти, виявлені за допомогою багатоваріантних моделей, тестували в аналізі повторних вимірювань змішаної моделі, а потім застосовували корекцію Бонферроні для множинних порівнянь. Коли відбору важливих метаболітів не передували багатоваріантні підходи, а натомість фізіологічне значення (тобто кетонові тіла), для загального числа метаболітів (рівень значущості α) застосовували корекцію Бонферроні для множинних порівнянь
Результати
Порівняння метаболом плазми натще і після їжі
Плазмові метаболоми у всіх 28 собак, проаналізованих за допомогою багатоваріантних моделей PCA, мали чітке візуальне розділення між відповідними точками часу після їжі (1, 2, 3 та 4 год) та часом голодування (додатковий файл 4). Значущі розбіжності між періодами голодування та відповідними часовими точками після їжі підтверджувались аналізом на моделях PLS-DA та CV-ANOVA (табл. 2). VIP-аналізи, засновані на моделях PLS-DA, виявили 11 дискримінаційних метаболітів (табл. 2), з яких 10 виявилися різними між часовими точками в аналізі повторних вимірювань змішаної моделі (застосовували корекцію Бонферроні для множинних порівнянь, рівень значущості α Таблиця 2 Метаболіти плазми, що диференціюють метаболоми натще і після їжі при багатофакторному дискримінантному аналізі, включаючи всіх 28 собак
Порівняння метаболомів плазми у худих і надмірних ваг собак
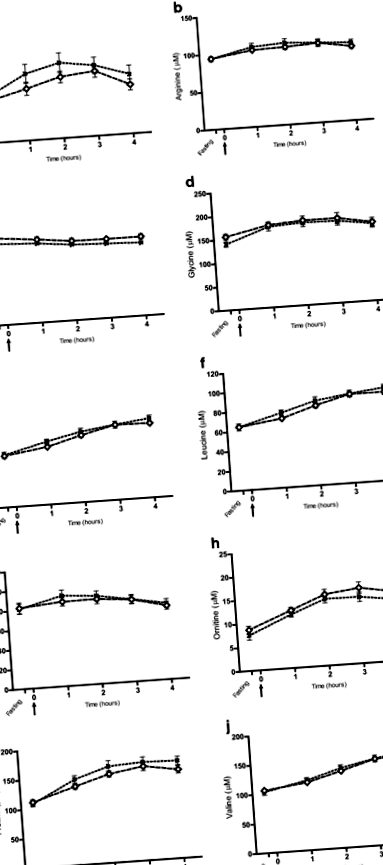
Візуально не спостерігалось поділу між худими та собаками із надмірною вагою на багатофакторних моделях PCA, ні натощак, ні через 1-4 години після їжі. Це було підтверджено висновком, що жодна з моделей PLS-DA не може бути встановлена з використанням худих і надмірно вагових собак як заздалегідь визначених груп у будь-який момент часу. 10 амінокислот, які були дискримінантними з часом у тесті на випробування їжі, не відрізнялися між групами станів тіла (рис. 1), як і два кетонових тіла (додатковий файл 5). У логістичних регресійних аналізах було показано, що карнітин був пов’язаний із надмірною вагою в будь-який момент часу (P ≤ 0,03 для всіх), тоді як за цією статистичною моделлю не виявлено жодних інших метаболітів. В аналізі повторних вимірювань на змішаній моделі було виявлено, що карнітин в цілому нижчий за надмірну вагу порівняно з худими собаками протягом усього тесту на випробування їжі (Р = 0,005), але на відповідь карнітину не впливало споживання їжі в жодній з груп ( Рис.2). У собак із надмірною вагою середня концентрація карнітину становила 9,4 ± 4,2 мкМ під час голодування (приблизно дві третини концентрації худорлявих собак), а дві групи стану тіла суттєво відрізнялися натще (Р = 0,008) (рис. 2).
Дискримінантні метаболіти, значущі з плином часу в тесті на прийом їжі, аналізовані щодо груп стану тіла. Собаки були розділені на дві групи стану тіла: худорляві (BCS 4–5, n = 12) і надмірна вага (BCS 6–8, n = 16), і застосовано змішаний аналіз повторних вимірів. Значення, наведені як µM концентрації (середнє значення ± SEM). Зразки плазми натще приймали за 15 хв до подачі тестової їжі в час 0 (стрілка), а концентрації метаболітів у худорлявих та надмірних ваг показані як криві відповіді від голодування до 4 год після годування. Залежних від часу змін загальної реакції метаболітів щодо груп стану тіла не виявлено (a-j)
Обговорення
У цьому дослідженні були визначені та визначені кількісно метаболоми плазми після їжі для подальшого розуміння собачого метаболізму після їжі та для вивчення потенційних метаболічних змін, пов’язаних із спонтанною надмірною вагою здорових собак. За допомогою аналітичної платформи ЯМР та методики кількісного визначення AQuA було виявлено амінокислотну реакцію після їжі в собачому метаболомі, а вільний карнітин виявився нижчим за надлишкової ваги порівняно з худими собаками.
Цікаво, що ми не виявили впливу прийому їжі на плазмову концентрацію карнітину, хоча тестова їжа містила попередники карнітину, отримані з м’яса (але без добавок l-карнітину). Таким чином, наші результати вказують, що відбір проб після нічного голодування порівняно з 1–4 год після змішаної їжі, що містить м’ясо, може дати порівнянні результати щодо концентрації карнітину у плазмі у собак. Однак вплив нещодавнього прийому їжі та різних видів їжі на звичайний раціон необхідно додатково вивчити. Наші результати після прийому їжі частково підтверджуються результатами дослідження серед людей, яке показало, що карнітин, що не містить плазми крові, може мати уповільнене збільшення після їжі, виміряне через 24 години після тривалого голодування [56]. Тому можливо, що більш тривалий період голодування або час відбору проб, що перевищує 4 год після їжі, дав би різні результати.
Висновки
Це дослідження показало, що підхід метаболоміки може покращити розуміння собачого метаболізму після їжі. Не було виявлено амінокислотної відповіді після їжі, але не було виявлено залежних від часу метаболічних змін щодо надмірної ваги. Карнітин, що не містить плазми крові, був визначений як метаболіт, пов’язаний із зайвою вагою у цій когорті здорових собак-лабрадорів-ретриверів, і нижча концентрація може свідчити про потенційну недостатність карнітину, пов’язану із спонтанним ожирінням та зміною ліпідного обміну.
- ROYAL CANIN Лабрадор-ретрівер Дорослий сухий корм для собак (Безкоштовна доставка) Жувальний
- Королівська Канін Порода Здоров'я Харчування Лабрадор-ретрівер Щеня Суха собака Fo; Петсенсе
- Датці із надмірною вагою частіше мають собак із зайвою вагою - ScienceDaily
- Кожен четвертий дорослий має надлишкову вагу або страждає ожирінням, що страждає на патологію, Пакистан - Gulf News
- PLOS ONE Світські тенденції поширеності надмірної ваги та ожиріння у сицилійських школярів у віці