Регуляція обміну речовин
Метаболічна регуляція - це термін, що використовується для опису процесу регулювання метаболічних шляхів (як анаболічного/біосинтетичного, так і катаболічного/деградаційного шляхів) у ссавців.
Пов’язані терміни:
- Глюкоза
- Цукровий діабет
- Обмін речовин
- Фермент
- Білок
- Інсулін
- Ожиріння
- Інсулінозалежний цукровий діабет
Завантажити у форматі PDF
Про цю сторінку
Інженерні основи біотехнології
Анотація
Розуміння метаболічного контролю є важливим аспектом маніпулювання метаболічними шляхами. Було добре задокументовано, що просте усунення конкуруючих шляхів та регулятивні ефекти призводять до обмеженого успіху. Найчастіше такі модифікації не призводять до змін або ефекту, який є менш корисним, ніж передбачалося. Контрольний аналіз забезпечує кількісний аналіз системи, що дозволяє нам краще зрозуміти, як системи реагують на різні збурення. Отже, знання реакції систем на збурення дозволяє нам націлити конкретні елементи на модифікацію, щоб отримати бажану реакцію. Ця стаття буде зосереджена на різних підходах, розроблених для метаболічного контролю, а також експериментальних підходах, розроблених для отримання даних для обчислювального аналізу. При повному розумінні динаміки метаболічного контролю можна досягти успішної маніпуляції метаболічним потоком і концентраціями метаболітів.
Молекулярно-клітинна біологія
Вступ
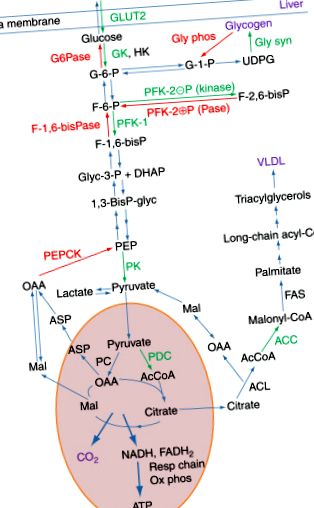
Мета цієї статті - подати короткий зміст усталених принципів метаболічної регуляції в клітинах і тканинах тварин. Замість вичерпного опису того, що відомо про регуляцію певного ферменту чи метаболічного шляху, ми обговорюємо метаболічну регуляцію в контексті фізіологічних станів, які будуть цікаві більшості читачів. У своєму досвіді дослідників у цій галузі, а також викладачів медичної біохімії ми виявили, що чудові шляхи, за допомогою яких печінка здатна переходити з органу, який синтезує паливо для зберігання у ситому стані, на орган, який забезпечує паливо для решта тіла - це хороший спосіб зрозуміти різні механізми, за допомогою яких регулюються метаболічні шляхи (Малюнок 1).
Фігура 1 . Шляхи, що беруть участь в метаболізмі глюкози в печінці під час годування та голодування. Основні шляхи, зображені тут, - це гліколіз, синтез і деградація глікогену, цикл трикарбонових кислот, ліпогенез та глюконеогенез. Ці шляхи скорочені, щоб виділити ключові регуляторні ферменти. Ключові ферменти та транспортер у біосинтетичних шляхах печінки під час годування зображені зеленим кольором, а ключові ферменти в шляхах розкладання, що діють натщесерце, мають червоний колір. Використовувані абревіатури ферментів: HK, гексокіназа; ГК, глюкокіназа; GLUT2, транспортер глюкози 2; Gly syn, глікогенсинтаза; Глі фос, глікоген фосфорилаза; PFK-1, фосфофруктокіназа-1; PFK-2, фосфофруктокіназа-2; F-1,6-бісПаза, фруктоза-1,6-бісфосфатаза; ПК, піруваткіназа; PDC, піруватдегідрогеназний комплекс; ПК, піруват-карбоксилаза; ACL, АТФ-цитратна ліаза; ACC, ацетил-КоА карбоксилаза; FAS, синтаза жирних кислот. Абревіатури, що використовуються для проміжних продуктів, зазвичай використовуються в метаболічних шляхах.
Метаболічне регулювання глобальними регуляторами у відповідь на культурне середовище
Анотація:
Основні механізми метаболічної регуляції пояснюються з точки зору регуляції катаболітів, регуляції азоту та фосфатів, а також впливу кислотного рН, теплового шоку та поживного голодування на метаболічні регуляції. Увагу зосереджено на впливах глобальних регуляторів (факторів транскрипції із сигма-факторами), таких як cAMP-Crp, Cra, Mlc, RpoN, ArcA/B, Fnr, SoxR/S, PhoR/B, RpoH та RpoS на метаболізм. Також пояснюються ефекти вибивання таких генів, як cra, crp, mlc, arcA/B, phoR/B, soxR/S та rpoS, на метаболічну регуляцію.
Молекулярна біологія Арестінів
1 Короткий вступ до метаболічного регулювання
Метаболічна регуляція - це фізіологічний механізм, за допомогою якого організм приймає поживні речовини та доставляє енергію за необхідності. Метаболічна регуляція працює в кінцевому підсумку на молекулярному рівні, головним чином, шляхом модуляції ферментної діяльності, яка функціонує разом як цілісна система, щоб відчути баланс енергії, що надходить, і необхідної енергії. Різні органи в організмі мають свої характерні закономірності метаболізму відповідно до своїх функцій в організмі. Таким чином, критично важливо, щоб метаболічні шляхи взаємодіяли в динамічному сенсі у всьому організмі. Крім того, ендокринна та нервова системи повинні точно координувати свою діяльність, щоб контролювати потік енергії в організмі.
Значна частина регуляції обміну речовин регулюється гормонами, які доставляються через кров і діють через специфічні клітинні рецептори. Як рецептори клітинної поверхні (які зазвичай зв'язують пептидні гормони), так і ядерні рецептори (які зв'язують гормони щитовидної залози, стероїдні гормони та інші мембранно-проникні ліганди) відіграють вирішальну роль у метаболічній регуляції. Гормони, що діють через рецептори клітинної поверхні, беруть участь у швидких метаболічних корекціях. Ці рецептори сигналізують через малу молекулу циклічного аденозин 3,5-монофосфату (циклічний АМФ або цАМФ) та мембранний ліпід фосфатидилінозитол (3,4,5) трисфосфат. Після цього діяльність метаболічних ферментів, що перебувають у потоці, регулюється ковалентною модифікацією, особливо фосфорилюванням та дефосфорилюванням, та/або транслокацією ферментів усередині клітини. Активація ядерних рецепторів їх лігандами, навпаки, безпосередньо контролює транскрипцію метаболічних генів і призводить до тривалої метаболічної регуляції.
Дослідження, проведені з декількома різними сімействами рецепторів, показали, що β-арсетини визначають специфічність, просторовість і тимчасовість клітинних сигналів, а також внутрішньоклітинний рух рецепторів та інших сигнальних комплексів. 1–4 Зв’язування β-арестинів з пов’язаними з лігандом рецепторами, пов’язаними з білками G (GPCR), фізично від’єднує G білок від рецептора і ефективно припиняє опосередковану білком G сигналізацію. Приєднуючись до активованого лігандом рецептора, β-арсетини також ініціюють передачу сигналу GPCR незалежно від білка G. Крім того, β-арсетини знімають різноманітні сигнальні комплекси, тим самим пов'язуючи активовані рецептори з різними наборами допоміжних та ефекторних білків. Враховуючи складну метаболічну регуляторну мережу, що складається з різноманітних гормонів та їх специфічних рецепторів, не слід дивуватись тому, що належне функціонування β-арсетинів є необхідним для метаболічної функції організму. У цій главі узагальнено функцію β-арестинів у метаболічній регуляції, а також обговорюється їх зв'язок із метаболічними синдромами, включаючи інсулінорезистентність, діабет 2 типу та ожиріння.
Основний обмін речовин
1.14 Регуляція обміну речовин і марний цикл
Метаболічна регуляція клітини забезпечує ріст клітин шляхом оптимізації генерації АТФ (катаболізм) та синтезу клітин (анаболізм) під час фази росту клітини. Більше того, клітина регулює обмін речовин, щоб впоратися з різними видами стресів, спричинених змінами в середовищі культури, і, отже, непросто зрозуміти весь механізм метаболічної регуляції. Метаболічна регуляція відбувається як на рівні гена, так і на рівні ферментів, де регуляція рівня ферментів зазвичай здійснюється за допомогою алостеричної регуляції, яка досягається зміною тривимірної структури шляхом зв’язування конкретних метаболітів тощо. Наприклад, G6PDH та 6PGDH інгібуються NADPH, тоді як Pfk інгібується PEP. PDH також інгібується NADH, ATP, AcCoA тощо. Розглянемо регуляцію Pfk і Fbp на шляху EMP, де Pfk каталізує наступну реакцію:
тоді як Fbp каталізує зворотну реакцію, таку як:
Якщо ці реакції відбуваються одночасно, енергія, що генерується одним шляхом, використовується іншим шляхом без ефективного використання. Це явище називається а марний цикл, де це відбувається завдяки незалежному контролю з боку кожного шляху. Подібне явище можна спостерігати для Ppc та Pck для анаплеротичних та глюконеогенетичних шляхів, таких як:
Зверніть увагу, що це відбувається залежно від умов культури.
Порушення сну добового ритму (CRSD)
М.Т. Цао, C.M. Пандя, в Енциклопедія сну, 2013
Опіоїди, гіперкапнічні та гіпоксичні вентиляційні реакції
Метаболічний контроль дихання значною мірою визначається взаємодією між центральними та периферичними хеморецепторами. Центральні хеморецептори розташовані в декількох центрах ЦНС, включаючи солітарій ядерного тракту, спинну дихальну групу, медулярний рафе, пре-BotC та ретротрапезоїдну/парафаціальну дихальну групу. Ці центральні хеморецептори в основному відчувають H +/PCO2 в ЦНС. Ступінь вентиляторної стимуляції дихальної системи для даного рівня PaCO2 відомий як HCVR. На відміну від цього, ступінь вентиляторної стимуляції для певного зниження напруги кисню (PaO2) у крові відома як HVR і опосередковується переважно в місці периферичних хеморецепторів. Розташовані в каротидних тілах, периферичні хеморецептори виявляють зміни головним чином у PaO2 із синергічними реакціями на діоксид вуглецю та рН. Периферичні хеморецептори мають вхідні дані та взаємодіють з центральними дихальними центрами, які потім зв’язуються з руховими нейронами, що іннервують основні дихальні м’язи (тобто діафрагму, внутрішні/зовнішні інтеркостали та м’язи живота).
Опіоїдні рецептори перебувають у всій периферичній нервовій системі та ЦНС. Всі опіоїди стимулюють μ-опіоїдні рецептори, які експресуються як на дихальних, так і на нейронах болю. Всі аспекти дихання, включаючи частоту дихання, дихальний об’єм та хвилинну вентиляцію, пригнічуються у присутності опіоїдів. Зниження рівня HVR та HCVR призводить до менш сильної стимуляції дихання при певному ступені гіпоксії (низький рівень PaO2) та гіперкапнії (підвищений рівень PaCO2). Показано, що підвищена периферична хіміочутливість (HVR) є фактором, що сприяє розвитку SDB. Однак загальний коефіцієнт посилення контролера є складовою як HCVR, так і HVR, і, як зазначалося раніше, попередня реакція зменшується за рахунок опіоїдів.
Вплив нокауту специфічного гена на метаболізм
Анотація:
Метаболічна регуляція специфічного генного нокауту Escherichia coli пояснюється термінами 13 потоків С-метаболізму, активністю ферментів, концентрацією внутрішньоклітинних метаболітів та експресією генів. Показано, що шлях гліоксилату активується у мутантів pckA та ppc, де вихід клітин може бути покращений порівняно з диким типом. У разі gnd-мутанта E. coli, шлях ED активується там, де Mez активується як для zwf, так і gnd-мутантів, щоб підкріпити продукцію NADPH. Проаналізовано механізм регулювання мутантної кишкової палички pykF, де показано, що він стійкий проти вибивання таких генів шляхом перенаправлення шляхів. Крім того, на основі аналізу метаболічного потоку 13 C та іншої інформації також пояснюються метаболічні регулятори мутантів lpdA, sucA та C, а також мутантів icdA та ldhA.
Фотосинтетична фіксація вуглекислого газу
Регуляція циклу Кальвіна
Епігенетика метаболічних хвороб
Дієта, метаболізм та епігеном
Метаболічна регуляція зрештою функціонує на молекулярному рівні. Хроматин, який знаходиться під генетичним та епігенетичним контролем, сприяє регуляції транскрипції в усіх типах клітин, і все більше доказів вказують на регуляторну взаємодію між хроматином та енергетичним гомеостазом [18]. Вплив дієтичних факторів на епігенетичну регуляцію дає пояснення того, як взаємодіє спосіб життя, а епігеном впливає на метаболізм людини на стан здоров'я та хвороби.
Вплив донорів метилу, біоактивних компонентів їжі та поживних речовин на епігенетичні модифікації часто вивчали в умовах, де досліджується вплив материнської дієти на метилювання ДНК у нащадків. Наприклад, дієтичні добавки з докозагексаєновою кислотою омега-3 жирної кислоти під час вагітності спричиняли підвищений рівень метилювання ДНК відбитого гена фактора росту інсуліну 2 (IGF2), що є важливим для росту та розвитку, у пуповинній крові немовлят [25]. ]. Найбільш наочний приклад того, як доступність донора метилу під час гестації має вирішальне значення для встановлення зразків метилювання ДНК у нащадків від мишей Агуті. Нащадки матерів, що харчуються дієтою, багатою з донорами метилу, отримують забарвлення шерсті дикого типу (коричневий), тоді як потомство матерів, що харчуються стандартною дієтою, отримує жовтий колір шерсті [26]. Коричневий колір шерсті обумовлений гіперметилюванням ДНК довгого термінального повтору, що контролює експресію гена агуті, що спричинило знижену експресію гена агуті і, таким чином, змінило пігментацію шару.
Таблиця 37.1. Підбірка досліджень, де метилювання ДНК та експресія генів головного регулятора метаболізму активованого проліфератором пероксисоми рецептора гамма-коактиватора 1 альфа (PPARGC1A) пов’язане з метаболічними захворюваннями та його схильними факторами
| Дієта з високим вмістом жиру | Здорові молоді чоловіки | Скелетні м’язи та підшкірна жирова тканина | Підвищення метилювання промотору через 5 днів перегодовування з високим вмістом жиру | [29,30] |
| Миші, материнські | Скелетні м’язи | Збільшення метилювання промотора та зниження експресії генів у нащадків | [75] | |
| Фізичні вправи | Здорові, сидячі чоловіки та жінки | Скелетні м’язи | Зниження метилювання промотора, збільшення експресії генів | [38,40] |
| Фізична бездіяльність | Здорові молоді чоловіки | Скелетні м’язи | Підвищення метилювання промотору та зниження експресії генів через 9 днів постільного режиму | [42] |
| Низька вага при народженні | Здорові молоді чоловіки, які народилися з НТГ | Скелетні м’язи та підшкірна жирова тканина | Підвищений метилювання промотору | [29,30,57] |
| ІМТ матері | Народження новонароджених жінок із ожирінням | Кров пуповини | Позитивна кореляція між ІМТ матері та метилюванням промоторів у новонароджених | [58] |
| Ожиріння | Діти дошкільного віку | Периферична кров | Метилювання промоторів у дітей передбачало ожиріння через 5–7 років у житті | [59] |
| GDM і T1D | Дорослі чоловічі та жіночі нащадки | Скелетні м’язи | Зниження експресії генів у потомства GDM | [68] |
| T2D | T2D, чоловіки та жінки | Острівці підшлункової залози | Збільшення метилювання промотора, зниження експресії генів | [77] |
| T2D, чоловіки та жінки | Скелетні м’язи | Підвищений метилювання промотору | [80,95] |
ІМТ, індекс маси тіла; GDM, гестаційний цукровий діабет; LBW, низька вага при народженні; T1D, діабет 1 типу; T2D, діабет 2 типу.
На моделі мишей із ожирінням, спричиненою дієтою, було виявлено змінене метилювання гістонів у сперматозоїдах батьків у генах, важливих для ембріогенезу, що свідчить про те, що дієтичний вплив може модулювати гістонні модифікації генів, що беруть участь у процесах розвитку [33]. Наша дієта також може впливати на експресію міРНК. У печінці мишей, що харчуються дієтою, порівняно з мишами, що годувались чау, експресія miR-21 була зменшена, що, націлюючись на білок 7, що зв’язує жирні кислоти, було пов’язано з накопиченням внутрішньоклітинних ліпідів у печінці (розглянуто в [ 34]).
У печінці щурів, які зазнали 8-тижневої контрольної дієти або дієт із високим вмістом жиру на сахарозі з добавками донорів метилу або без них, глобальне метилювання ДНК у печінці було напрочуд знижене від щурів, які годувались контролем, які піддавались добавкам донорів метилу [35]. Цей висновок, разом із роз'єднанням епігенетичної пластичності жирової тканини та скелетних м'язів, спричиненої дієтою, у тих самих суб'єктів свідчать про необхідність цілеспрямованих досліджень (тобто добре підібраних дослідницьких груп та стандартизованих втручань) з чіткими гіпотезами при дослідженні впливу дієта за загальносвітовими, геномними та специфічними епігенетичними закономірностями у людей та тварин.
Основне розуміння того, наскільки схильний людський епігеном до дієтичних змін, в основному невідоме. Подальші дослідження, спрямовані на з’ясування впливу дієти на епігеном, можуть забезпечити оптимізовані дієтичні рекомендації і тим самим покращити профілактику метаболічних порушень.
Голодування та голодування: біохімічні аспекти
Регулювання адаптації
Метаболічна регуляція при голодуванні є складною і спрямована на перетворення всього метаболічного середовища організму в адаптивні реакції на тканинному та клітинному рівнях, що призводить до структурних, біохімічних та функціональних модифікацій. Існує велика взаємодія механізмів зондування поживних речовин та нервової та ендокринної аферентної та еферентної сигналізації.
Глюкагон, 29-амінокислотний пептид, що виділяється з α-клітин підшлункової залози, є важливим регулятором гомеостазу глюкози, протирегулятором інсуліну, і виділяється в ситуаціях низького вмісту глюкози в плазмі. Він стимулює вихід печінкової глюкози шляхом посилення печінкового глікогенолізу та глюконеогенезу за допомогою свого канонічного шляху cAMP/PKA, сприяючи фосфорилюванню та алостеричній зміні ключових метаболічних ферментів та ядерних факторів (наприклад, CREB, білок, що зв’язує елемент цАМФ). Таким чином, він відіграє вирішальну роль на ранній фазі адаптації до голоду (Таблиця 1).
Вісь AMPK-SIRT1 інтегрує безліч гормональних та харчових сигналів (наприклад, глюкагон, лептин, адипонектин, глікоген та вільні жирні кислоти) і вбудована в складну саморегулюючу мережу, яка має на меті обмежити загальні енергетичні витрати в період голоду (Рисунок 6 ). Він має плейотропний внутрішньоклітинний ефект, що призводить до швидких змін за рахунок фосфорилювання, зумовленого кіназою AMP, та алостеричних змін основних метаболічних ферментів, таких як ацетил-КоА карбоксилаза (синтез жирних кислот), гормоночутлива ліпаза (гідроліз тригліцеридів) та піруватдегідрогеназний комплекс (окислення піруват у циклі Кребса). Середньо- та довгострокові адаптаційні механізми набувають чинності як наслідок транскрипційних модифікацій метаболічних ферментів за допомогою фосфорилювання та деацетилювання ядерних рецепторів, що перебувають за течією (наприклад, FOXO, PPAR), та транскрипційних корегуляторів (PCG-1α). Крім того, деацетилювання залишків лізину допомагає SIRT1 збільшити ступінь ущільнення хроматину, що призводить до прямого пригнічення транскрипційної активності.
- Сільське господарство комах - огляд тем ScienceDirect
- MacConkey Agar - огляд тем ScienceDirect
- Мальтодекстрин - огляд тем ScienceDirect
- Lactobacillus - огляд тем ScienceDirect
- Герпетичний стоматит - огляд тем ScienceDirect