Макроелементи в парентеральному харчуванні: амінокислоти
Анотація
Правильна кількість та якість амінокислот (АА), що надходять пацієнтам на парентеральне харчування (ПН), зменшує втрату м’язової маси, може зберегти або навіть збільшити її, що має значні клінічні переваги. Доступно декілька промислових сумішей PN, щоб спеціалісти з харчування могли вибрати продукт, найбільш близький до потреб пацієнта. У деяких випадках існує можливість персоналізувати суміші в лікарняній аптеці, що повністю відповідає індивідуальним харчовим потребам пацієнтів із ПН. У цьому оглядовому огляді йдеться про розчини АА, що використовуються в сумішах PN. Також повідомляється про фізіологію, методи розрахунку потреб у АА та потреби в АА та енергії, запропоновані науковими рекомендаціями для кожного типу пацієнтів.
1. Вступ
При ПН поживні речовини вводять внутрішньовенно; у більш фундаментальному стані будівельного блоку через периферичну або центральну вену. Для приготування інфузійної суміші використовуються стерильні розчини амінокислот (АК), глюкози, ліпідів, води, електролітів, мікроелементів та вітамінів. Суміші PN визначаються як "стандартні", якщо їх промислово готують із фіксованим складом та розфасовують (або інакше називають "готовими до використання"), або "персоналізують", якщо їх складають у лікарняній аптеці для конкретних харчових потреб одного пацієнт [13] та пацієнти з особливою недостатністю органів (тобто обмеження об’єму при серцевій недостатності, електролітний баланс при хронічній нирковій недостатності); крім того, персоналізовані суміші ПН часто потрібні для важкохворих та/або важко катаболічних пацієнтів, як для пацієнтів з доброякісною хронічною кишковою недостатністю та недоношених дітей [13]. У цьому оглядовому огляді йдеться про розчини АА, що використовуються в сумішах PN. Також повідомляється про фізіологію, методи розрахунку потреб АА, а також АА та енергетичні потреби, запропоновані науковими рекомендаціями щодо типу пацієнтів.
2. Амінокислоти: Фізіологія
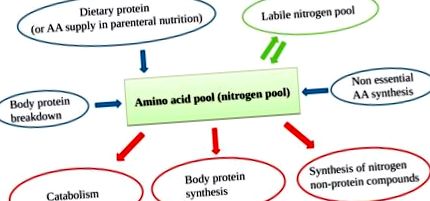
Пул амінокислот (АА) містить АА, що виникають із джерела їжі, розщеплення білка, несуттєві АА (НЕАА), що синтезуються в печінці, та лабільний азотний пул. Оскільки організм не може зберігати білки, відбувається постійний оборот АА з постійним входом АА, що балансує вихід АА.
Адекватна доступність усіх EAA (що надходять і з розщеплення білка) посилює синтез білка, визначаючи анаболічний стан [17] (рис. 2).
Основна рециркуляція AA (EAA) при обороті білка. Повідомлені одиниці є довільними, щоб пояснити різницю між анаболічним та катаболічним станами за наявності або відсутності зовнішнього надходження АА.
Важливо врахувати, що, хоча і необхідні для синтезу білка, НЕАА не можуть діяти як пусковий механізм, на відміну від ЕАА. З цієї причини ефективність даного споживання азоту пов’язана з ЕАА, а не із загальним вмістом АА [18]. Більше того, надмірна пропозиція NEAA (без адекватної ціни EAA) виключно посилить катаболізм.
3. Амінокислотні розчини для парентерального харчування
М’язова атрофія (досить складна у зворотному порядку), що складається з виснаження м’язової тканини з поперечно-смугастими волокнами, спричинює слабкість, втрату рухової функції аж до саркопенії та кахексію [19]. Збереження м’язової маси - одна з головних цілей ПН; внутрішньовенна інфузія розчинів АА зберігає позитивний азотний баланс і сприяє синтезу м’язового білка. Стандартні розчини AA для PN містять EAA, деякі NEAA (для досягнення необхідної кількості азоту), а іноді і деякі CEAA. У конкретних клінічних станах, таких як розлади АА (наприклад, вроджені помилки в метаболізмі деяких АА), недоношених та критично хворих пацієнтів можуть знадобитися спеціалізовані розчини АА [20]. У нещодавніх роботах ми показали, що комерційно доступні стандартні суміші PN, навіть з однаковим загальним вмістом АА, мають дуже різні співвідношення EAA/AA, і, зокрема, малоймовірний профіль EAA (Таблиця 1 та Таблиця 2 та [21]).
Таблиця 1
Відсоток EAA від загальної кількості АА у декількох комерційно доступних стандартних розчинах амінокислот IV.
| Відсоток EAA від загальної кількості AA | 44.4 | 52.4 | 74,9 | 58.4 | 41.2 | 50,8 | 49.3 |
АА: амінокислота; EAA: незамінна амінокислота; IV: внутрішньовенно.
Таблиця 2
Відсоток EAA від загальної кількості АА у кількох повноцінних, все-в-одному парентеральних сумішах, комерційно доступних в Італії.
| Відсоток EAA від загальної кількості AA | 51.2 | 43.3 | 48.6 | 45.7 | 51.1 |
АА: амінокислота; EAA: незамінна амінокислота; IV: внутрішньовенно.
Хоча всі оцінені суміші у звичайній дозі 1 г/кг маси тіла на добу відповідають дозам EAA для здорових осіб без стресу, запропонованих Всесвітньою організацією охорони здоров'я (ВООЗ), Продовольчою та сільськогосподарською організацією ООН (ФАО) та Університет ООН (UNU), в більшості випадків їх вміст EAA був недостатнім, щоб гарантувати значне збільшення м’язової маси у пацієнтів з ПН; таким чином, для отримання ефективної дози ЕАА було б необхідно значно збільшити добову дозу загальних АА. У сумішах АА для ПН ЕАА повинні становити щонайменше 50% від загальної кількості АА, і, зокрема, вміст лейцину, ізолейцину та метіоніну повинен перевищувати встановлений поріг для отримання приросту м’язової маси у пацієнтів із ПН [21].
Ідеального рішення АА, здатного задовольнити харчові потреби всіх пацієнтів, які потребують ПН, не існує; дійсно, дуже часто його потрібно персоналізувати відповідно до окремих потреб. Останнім часом наявність двох NEAA (тирозину та цистеїну) у сумішах EAA видається вирішальним [22]. Тирозин є NEAA лише для печінки (і частково для нирок), тоді як він є EAA для всіх інших органів/тканин, у яких відсутня фенілаланінгідроксилаза, фермент, що перетворює фенілаланін у тирозин. З цієї причини додавання тирозину до інших EAA може підвищити ефективність синтезу тирозину.
Кілька дієтичних АА метаболізуються або перетворюються в інші в кишечнику або печінці під час першого проходження. Дослідження на тваринах показують, що кишечник в основному використовує харчові АА для специфічного синтезу білка, а не ті, що забезпечуються системним кровообігом [23]. За PN, кишечник обходить, що спричиняє зниження системної доступності деяких АА, що, нарешті, призводить до їх підвищеної парентеральної потреби. Таким чином, виявляється, що парентерально введені фенілаланін та метіонін перетворюються у тирозин та цистеїн, відповідно, меншою мірою, ніж ті, що потрапляють всередину. Зокрема, пацієнтам з нирковою недостатністю та недоношеним немовлятам, здається, потрібні збагачені тирозином суміші. Хронічна ниркова недостатність пов’язана із втратою нирковою активністю фенілаланінгідроксилази, що пояснює знижену конверсію фенілаланіну у тирозин [24]. Для недоношених немовлят незрілість ферментної системи обумовлює необхідність додавання тирозину до сумішей для ПН [25]. На жаль, тирозин погано розчиняється у воді; отже, кількість, додана в суміші PN, обмежена.
Цистеїн, доданий до сумішей EAA, значно знижує токсичність метіоніну. Цистеїн синтезується з метіоніну з виробленням гомоцистеїну як метаболічно токсичного обов’язкового проміжного продукту. Ді Буоно та ін. [26] припустив, що дієтичний цистеїн може зменшити екзогенну потребу в метіоніні у чоловіків. Ці результати підтверджують існування ефекту збереження цистеїну у людини. Амінокислоти, що містять сірку, безпечніші, якщо забезпечують збалансоване стехіометричне співвідношення метіоніну та цистеїну. Таким чином, вони направляють попит на фолієву кислоту і мінімізують вироблення гомоцистеїну, отримане метаболізмом метіоніну, щоб задовольнити потреби в цистеїні. Добавка цистеїну (у подвійній дозі порівняно з метіоніном) до сумішей EAA дозволяє уникнути перевантаження гомоцистеїном.
4. Специфічна для хвороби суміш АА
Щодо спеціалізованих сумішей AA, дослідження Plauth et al. [27] запропонував використовувати стандартні розчини АА для печінкових енцефалопатій I та II ступеня та адаптовані до печінки з III по IV ступінь. Ці останні спеціалізовані суміші АА містять велику кількість АА з розгалуженим ланцюгом (ВСАА) та менші дози ароматичних АА (фенілаланін та тирозин), метіонін та триптофан. Однак дослідження ефективності BCAA у лікуванні печінкової енцефалопатії дали суперечливі результати. Відповідно, керівні принципи, запропоновані Товариством медицини критичної допомоги (SCCM) та Американським товариством парентерального та ентерального харчування (ASPEN) [28], повідомляють, що немає доказів того, що збагачені BCAA препарати покращують результати лікування пацієнтів у порівнянні зі стандартними цілими -білкові у важких хворих із захворюваннями печінки.
Внутрішньою кислотністю сумішей АА часто нехтують [38]: метаболічний ацидоз (у короткостроковій перспективі) [39,40] та метаболічне захворювання кісток (довгостроковий) [41,42] можуть бути наслідком надмірного екзогенного введення та/або масивного ендогенного виробництво нелетких кислот. Екзогенні нелеткі кислоти походять від неорганічних кислот, що додаються до сумішей ПН для підтримки їх фізико-хімічної стабільності. Виробництво ендогенних нелетких кислот в основному відбувається за рахунок метаболізму деяких АА (цистеїну, метіоніну, лізину, гістидину, аргініну). Кислотне навантаження після введення суміші ПН можна виправити, додавши потрібні дози органічних кислот або їх солей, таких як ацетат, глюконат, аспартат або цитрат [38].
5. Потреба в білках
Людський організм може відповідати низькому споживанню поживних речовин без негативних наслідків у певних межах [48]. Як уже зазначалося, білки в організмі зазнають великого обороту (безперервний розпад і синтез); амінокислоти, отримані в результаті розщеплення білків, переробляються для нового синтезу або невблаганно окислюються або вилучаються (рис. 2). У разі зменшення надходження білка (або АА) відбувається швидке та більш ефективне повторне використання ендогенних АА із зниженою швидкістю окислення ЕАА. Через деякий час відбувається зменшення синтезу і розщеплення білка. За допомогою цих механізмів організм до певних меж пристосовується до зменшеного споживання АА, зменшуючи втрати азоту. Після так званих “обов’язкових втрат азоту”, незважаючи на продовження режиму, що не містить білків, неможливо додатково обмежити втрати азоту [49,50,51,52]. Обов’язкові втрати азоту можна виміряти у осіб, які отримують дієту без білка після короткого періоду адаптації (зазвичай 4–5 днів). Ці втрати були оцінені, як показано в таблиці 3 [53]:
Таблиця 3
Втрати азоту за типом виведення та на кг маси тіла у здорових дорослих пацієнтів.
- Домашнє парентеральне харчування (HPN) у пацієнтів з ускладненнями післябаріатричної хірургії -
- Гіпокалорійне домашнє парентеральне харчування та параметри харчування у пацієнтів після баріатричного лікування
- Скинути передсвяткове харчування HEAL - 13 листопада 2019 року! Здорове харчування Активний спосіб життя ™
- Послуги харчування та дієти в Меріленді
- Як; s Ваше дієтичне протизапальне харчування для оптимального харчування Карін Шенкс, доктор медичних наук