Ліраглутид, лептин та їх комбінований вплив на годування: зменшення споживання добавок за допомогою загальних внутрішньоклітинних механізмів сигналізації
Скотт Е. Каноскі
1 Відділ біологічних наук Університету Південної Каліфорнії
Чжи І Онг
2 Кафедра психології Університету Пенсільванії
Саманта М. Фортін
3 аспірантура з неврології, Університет Іллінойсу в Чикаго
Елізабет С. Шлесінгер
2 Кафедра психології Університету Пенсільванії
Харві Дж. Гриль
2 Кафедра психології Університету Пенсільванії
Анотація
Агоністи глюкагоноподібного пептиду-1 (GLP-1R) та лептин надають анорексигенні ефекти. У поєднанні інгібуючі ефекти споживання та зниження ваги більші, ніж будь-яке лікування, однак механізми незрозумілі.
Матеріали і методи
Вплив ліраглутиду (аналог GLP-1 тривалої дії) та спільного лікування лептином, доставлених у низьких або помірних дозах підшкірно (SC) або до 3-го шлуночка відповідно, на сукупний прийом, режим прийому їжі та експресію внутрішньоклітинної сигналізації на гіпоталамусі білки [фосфорильований перетворювач сигналу та активатор транскрипції-3 (pSTAT3) та білка тирозинфосфатази-1B (PTP1B)] досліджували у худих щурів.
Результати
Комбінація низьких доз ліраглутиду (25 мкг/кг) та лептину (0,75 мкг) додатково зменшує кумулятивне споживання їжі та масу тіла, результат, опосередкований переважно завдяки значному зменшенню частоти прийому їжі, якого не було при застосуванні жодного препарату. Лікування лише ліраглутидом також зменшує обсяг їжі; ефект, не посилений при одночасному застосуванні лептину. Помірні дози ліраглутиду (75 мкг/кг) та лептину (4 мкг) досліджували окремо, зменшуючи частоту прийому їжі, сукупне споживання їжі та масу тіла; лише ліраглутид зменшив розмір їжі. У поєднанні ці дози додатково не посилювали анорексигенні ефекти жодного лікування. Іммуноблот ex vivo показав підвищений рівень pSTAT3 в тканині гіпоталамусу після одночасного лікування ліраглутидом і лептином, ефект більший, ніж лікування лише лептином. Крім того, SC ліраглутид знижував експресію PTP1B (негативний регулятор сигналізації рецепторів лептину), виявляючи потенційний механізм посиленої відповіді pSTAT3 після одночасного прийому ліраглутид-лептину.
Висновки
У сукупності ці результати забезпечують нові поведінкові та молекулярні механізми, що лежать в основі адитивного зменшення споживання їжі та маси тіла після комбінованого лікування ліраглутидом-лептином.
Вступ
Механізми поведінки, за допомогою яких агоністи лептину та GLP-1R поєднуються для зменшення годування, невідомі. Периферичне лікування екзендіном-4 у резус-макак зменшує годування за рахунок придушення розміру їжі, не впливаючи на частоту прийому їжі (18). У гризунів периферичний екзендін-4 зменшує як розмір їжі, так і частоту прийому їжі (19), тоді як введення екзендіну-4 в вентральну тегментальну область (VTA) (20) або в вентральний гіпокамп (21) зменшує споживання через специфічне зменшення їжі розмір. Подібним чином, периферичне лікування ліраглутидом зменшує споживання їжі за рахунок зменшення розміру їжі у міні-свиней (8).
Як і GLP-1R, активація LepRbs зменшує споживання їжі, принаймні частково, за рахунок зменшення розміру їжі. Хронічне лікування периферичним лептином зменшує кількість їжі з мінімальним впливом на частоту прийому їжі (22, 23). Подібним чином, лептинодефіцитні миші (24) та щури з вірусно-опосередкованим хронічним LepRb «нокдауном» у нейронах NTS (25) споживають більше їжі без істотно зміненої частоти прийому їжі порівняно з контролем. На відміну від цих висновків, гостре введення лептину ICV зменшує частоту прийому їжі у щурів лише з мінімальним впливом на розмір їжі (26). Невідомо, чи виникають адитивні аноректичні ефекти спільного прийому GLP-1R та LepRb за рахунок зменшення обсягу їжі, частоти прийому їжі або того й іншого. У цьому дослідженні вивчається сукупний прийом їжі, маса тіла та характер прийому їжі низьких та помірних комбінацій доз периферичного (SC) ліраглутиду та центрального (3-а ICV) лептину у щурів.
Матеріали і методи
Предмети
Дорослі самці щурів Sprague-Dawley (річка Чарльз; 325-450 г під час експериментальних процедур), які утримувались індивідуально під зворотним 12-годинним циклом світло/темрява (освітлення 10:00 год.) Принаймні 2,5 тижні перед процедурами, мали вільний доступ до чау (LabDiet; 5001) та води, за винятком випадків, коли зазначено. Усі процедури відповідали та отримали схвалення Інституційного комітету з догляду та використання тварин Університету Пенсільванії.
Хірургія
Під кетаміном (90 мг/кг), ксилазином (2,7 мг/кг) та ацепромазином (0,64 мг/кг) знеболюють та знеболюють (Metacam 2 мг/кг), направляючі канюлі (Plastics One; 26-мірна) цементують на череп за допомогою ювелірів гвинти імплантували його кінчик, стереотаксично розташований на 2,0 мм над 3-м шлуночком за такими координатами: 2,0 мм каудально до брегми, 7,7 мм вентрально до поверхні черепа, на середній лінії. Анатомічні позиції 3-х місць ін'єкції ICV оцінювали 1 тиждень після операції шляхом вимірювання глікемічного ефекту, зумовленого цитоглюкопенією, опосередкованого симпато-наднирковими залозами в результаті 210 мкг (2 мкл) 5-тіо-D-глюкози (29).
Процедури
Вживання їжі, схеми прийому їжі та аналіз маси тіла
Їжу видаляли за 30 хв до першої ін'єкції, і щури отримували 3-ї ін'єкції ICV (1 мкл) лептину (Національна програма з гормонів та пептидів) або носія (NaHCO3). П’ятнадцять хвилин потому кожна щур отримала ін’єкцію SC (1 мл/кг) ліраглутиду (подарунок Novo Nordisk, Багсверд, Данія) або транспортного засобу (стерильний фізіологічний розчин), яка сталася безпосередньо перед вимкненням світла. Фармакологічні дослідження використовували внутрішньодисциплінарний дизайн, лікування обробляли 3-4 дні. Дози були підібрані в межах від низького до помірного для зменшення споживання їжі на основі кривих реакції дози для периферичного ліраглутиду (30) та лептину ICV (31). Сукупне споживання вимірювали за допомогою автоматизованої системи годівлі (DiaLog Instruments). Щури, що проживали в індивідуальному поселенні, мали доступ до чашки з їжею в ланцюзі навантажувальної комірки, який зв’язувався з інтерфейсом та комп’ютером із спеціальним програмним забезпеченням (LabVIEW, National Instruments). Вагу харчової чашки вимірювали кожні 10 секунд, дозволяючи оцінити параметри їжі. Прийом їжі визначався як епізод годування, в якому було введено принаймні 0,25 г, з критерієм припинення прийому їжі як початком паузи при прийомі всередину> 10 хв, як описано раніше (25, 32). Дані об’єктивно розраховувались за допомогою власного макросу Microsoft Excel.
Аналіз ex vivo імуноблот pSTAT3 та PTP1B
Для імуноблот-аналізу pSTAT3 проводили фармакологічну обробку (чотири групи, n = 6-7 на групу), з тими ж параметрами часу введення, що описані вище, з використанням дози лептину 6,0 мкг (ICV) та дози 50 мкг/кг ліраглутид (SC). Відповідно до нашої попередньої роботи, яка поєднувала поведінковий підхід та підходи ex vivo (32, 33), для аналізу сигналізації ex vivo використовували більш високі дози порівняно з аналізом поведінки з метою оптимізації здатності виявляти активовані внутрішньоклітинні сигнальні шляхи. Через 45 хвилин після ін'єкцій SC (1 год після ін'єкцій ICV) щурів забивали шляхом обезголовлення. Мозок швидко видаляли, а гіпоталамус екстрагували, заморожували в ізопентані і зберігали при -80 ° C. Для імуноблот-аналізу PTP1B (n = 9 на групу) щурів забивали 45 хвилин після ін’єкцій SC.
Гіпоталамічні тканини гомогенізували в радіоімунопреципітаційному аналізі (RIPA). Гіпоталамічні лізати піддавали SDS-PAGE і переносили в мембрани PVDF для імуноблот-аналізу, як описано раніше. Імунореактивність візуалізували за допомогою посиленої хемілюмінесценції (BioRad; Chemidoc XRS). Фосфорильовані та загальні антитіла до STAT3 (клітинна сигналізація; розведення 1: 1000) використовували для оцінки активності pSTAT3, нормалізованої до загальної STAT3. Експресія білка PTP1B (Санта-Крус; розведення 1: 500) нормалізувалася до контролю навантаження β-актину. Кількості визначали з використанням денситометричного аналізу в програмному забезпеченні (Image J; Національний інститут охорони здоров’я).
Дані та статистичний аналіз
Всі статистичні аналізи поведінкових заходів використовували дисперсійний аналіз повторних вимірювань (ANOVA; окремий аналіз, проведений для кожного моменту часу) з використанням препарату ICV та SC як факторів. Коли були виявлені суттєві основні ефекти будь-якого з препаратів, для порівняння індивідуальних методів лікування використовувались постхок-тести Ньюмана-Кельса. Імуноблот-аналізи аналізували за допомогою одностороннього ANOVA. Рівень альфа для значущості становив 0,05. Статистичний аналіз проводили за допомогою програмного забезпечення Statsoft (Statistica V10).
Результати
Низькодозова комбінація: кумулятивний прийом їжі, дельта-маса тіла та режим харчування
Раніше повідомлялося, що адитивний ефект внутрішньоочеревинного введення лептину та GLP-1 на споживання їжі та масу тіла досягається переважно при поєднанні низьких доз (12). Відповідно до цього висновку, ми виявили, що пригнічуючий прийом та ефект зниження ваги комбінованого лікування ліраглутид-лептин у помірних дозах (4 мкг лептину, 75 мкг/кг ліраглутиду) не були більшими порівняно з будь-яким лікуванням окремо. Цілком можливо, що ефекти прийому і ваги тіла як лептину, так і ліраглутиду в цих дозах досягли нижнього ефекту, тим самим обмежуючи подальше зменшення споживання їжі та маси тіла. Однак у нашій попередній роботі зменшення споживання їжі, спричинене високою дозою 4-го ICV лептину (20 мкг), було додатково посилено 4-м ICV-екзендіном-4 (15), припускаючи, що аноректичні ефекти високих доз центрального лептину можуть бути додатково посилюється активацією GLP-1R, коли обидва препарати надходять у задній мозок. Цікаво, що нинішні результати також показали, що інгібуючий ефект прийому 4 мкг ICV лептину сам по собі опосередковується зменшенням частоти прийому їжі без впливу на розмір їжі. Ці дані відрізняються від даних після хронічного лікування периферичним лептином, що зменшує обсяг їжі з мінімальним впливом на частоту прийому їжі (22, 23).
Гострий вплив лептину на параметри їжі після доставки ICV переднього мозку, наскільки нам відомо, повідомлялося лише в двох інших дослідженнях (26, 35). Відповідно до сучасних результатів, Zorilla та його колеги повідомили про незначний вплив лептину ICV на розмір їжі, тоді як ефекти зменшення частоти прийому їжі спостерігалися при дозах лептину в межах від 1 до 6,25 мкг, але не при 0,3 мкг лептину. У цьому дослідженні використовувався інтервал точки зупинки між паузами між їжею та інтервалами між їжею (інтервал відповіді; IRI) 5 хв для визначення кінця прийому їжі, тоді як у цьому дослідженні застосовувався 10-хвилинний критерій IRI, обидва з яких широко прийнята в літературі, заснована на великих поведінкових спостереженнях та аналізі виживання журналів (26, 36-39). З іншого боку, в іншому дослідженні, що використовувало IRI протягом 30 хвилин, повідомлялося про зменшення розміру їжі без зменшення частоти прийому їжі після прийому лептину ICV. Таким чином, суперечливий висновок Flynn et al. може базуватися на використанні набагато довшого ІРІ (30 хв) порівняно з нашим дослідженням (10 хв) та дослідженням Зорілли та його колег (5 хв). Потрібна подальша робота, щоб визначити, чи, на відміну від гострого лікування, хронічний лептин ICV чинить більш потужний вплив на розмір їжі порівняно з частотою прийому їжі, як це спостерігалося раніше після хронічного введення пептичного лептину.
SC-ліраглутид надійно зменшує споживання їжі та масу тіла як у худих, так і у викликаних дієтою щурів із ожирінням (DIO) (30, 40-43) та зменшує споживання їжі у ожирених міні-свиней за рахунок зменшення розміру їжі. Про вплив ліраглутиду SC на схему прийому їжі у щурів, наскільки нам відомо, раніше не повідомлялося. Тут ми показуємо, що помірна доза гострого ліраглутиду SC (75 мкг/кг) зменшила як частоту прийому їжі, так і розмір їжі. У попередніх дослідженнях ефект активації GLP-1R на схему прийому їжі, як видається, залежить від шляху та місця введення (18-21, 44, 45), причому більш потужні ефекти, як правило, спостерігаються для розміру їжі порівняно із зменшенням частоти прийому їжі. Беручи до уваги, що гострий ліраглутид зменшує споживання їжі за рахунок активації периферичного та центрального GLP-1R після периферичного введення (41, 46), можливо, що ефекти прийому їжі, що спостерігаються в цьому дослідженні, опосередковані дією на периферії централізовано, або обидва. Можливо також, що неспецифічні ефекти (наприклад, нудота) сприяли впливу ліраглутиду (як окремо, так і в поєднанні з лептином) режиму прийому їжі, враховуючи, що за деяких умов аналоги GLP-1 виробляють умовне вивчення уникання смаку (30, 47).
Ми досліджували внутрішньоклітинні сигнальні шляхи, що беруть участь у комбінованій активації LepRb та GLP-1R в гіпоталамусі, де рецептори як лептину, так і GLP-1 в значній мірі виражені (48, 49). Ефект пригнічення споживання сигналів LepRb частково опосередковується шляхом JAK-STAT, де лептин зв'язується з LepRb і призводить до фосфорилювання кінази-2 Janus (pJAK2) і STAT3 (pSTAT3) (50). pSTAT3 також підвищується після активації запальних цитокінів [наприклад, рецептори інтерлейкіну (IL) -1, IL-6] та центральна сигналізація IL-1 та IL-6 сприяють центральній анорексії, індукованій GLP-1 (28). Наші результати показали, що лептин ICV підвищував сигналізацію про гіпоталамус pSTAT3, і цей ефект значно посилювався при одночасному застосуванні SC-ліраглутиду. Однак ми не спостерігали збільшення pSTAT3 лише після введення SC ліраглутиду, результат, який відрізняється від недавнього дослідження, яке повідомило про збільшення рівня гіпоталаму pSTAT3 після ICV Ex-4 (28). Можливо, що різний шлях введення (SC проти ICV), аналог GLP-1 (ліраглутид проти Ex-4) або застосована відносна сила дози могли сприяти цій різниці.
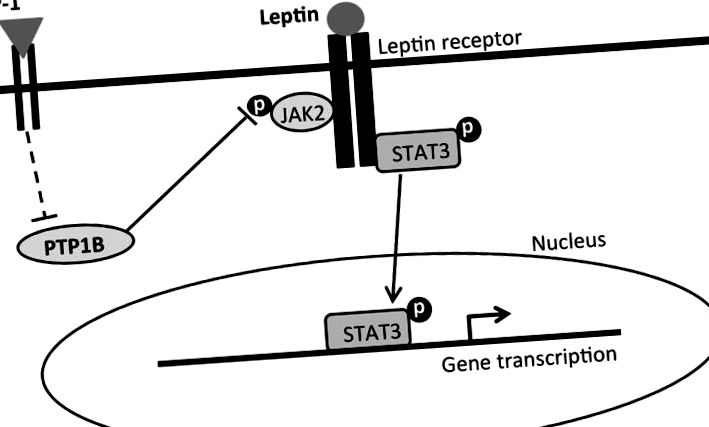
Спрощений запропонований огляд внутрішньоклітинних сигнальних механізмів, що опосередковують пригнічуючий прийом та ефект зниження ваги комбінованого лікування лептином-ліраглутидом. Лептин зв'язується з довгою формою рецептора лептину (LepRb), який активує білок кінази Janus 2 (JAK2) і призводить до фосфорилювання різних залишків тирозину та перетворювача сигналу та активатора транскрипції-3 (pSTAT3). pSTAT3 транслокується в ядро для опосередкування транскрипції генів, пов’язаних із споживанням їжі та контролем маси тіла. GLP-1, з іншого боку, зв'язується з рецептором GLP-1 та інгібує PTP1B за прямим або непрямим шляхом (ламані лінії). PTP1B зазвичай дефосфорилює JAK2 і деактивує його. Таким чином, інгібування PTP1B дезінгібує pJAK2. Дезінгібування pJAK2 за допомогою активації GLP-1R, разом з активацією передачі сигналів LepRb, призводить до комбінаторного збільшення pSTAT3, який пропонується опосередковувати посилене придушення споживання та ефекти одночасного прийому ліраглутиду та лептину при зниженні маси тіла.
Сучасні результати визначають PTP1B як один із механізмів, за допомогою якого одночасне введення ліраглутиду та лептину збільшує pSTAT3. Ми також визнаємо можливість інших альтернативних шляхів, що опосередковують посилений ефект гальмування споживання та зниження ваги комбінованого лікування ліраглутид-лептин. Наприклад, експресія мРНК фактора росту фібробластів 21 (FGF21), фактора росту, важливого для регуляції гомеостазу глюкози та ліпідів, збільшується в печінці після периферичного введення ліраглутиду (63, 64). FGF21 підвищує чутливість до лептину у мишей DIO (65), і метаболічні ефекти FGF21, частково, централізовано опосередковані (66). Отже, можливо, індуковане ліраглутидом збільшення FGF21 також сприяє посиленій передачі сигналів гіпоталамусу LepRb (підвищений pSTAT3) після гострого одночасного прийому ліраглутид-лептину. В якості альтернативи, це комбінаторне підвищення рівня pSTAT3 може також опосередковуватися збільшенням експресії LepRb в результаті лікування ліраглутидом. Однак цей передбачуваний механізм менш вірогідний, враховуючи, що субхронічне лікування периферичним ліраглутидом не змінює експресію LepRb в ARH щурів DIO (59). Тим не менше, ці гіпотези залишаються широко дослідженими.
Результати цього дослідження показують, що лептин ICV та SC-ліраглутид у поєднанні з меншими, але не помірними дозами збільшують споживання їжі та зменшують вагу тіла як окремого препарату. Цей адитивний ефект прийому їжі після комбінованого прийому базувався на значному зменшенні частоти прийому їжі, що не спостерігалось у відповідь на одне лікування. У поєднанні з цими поведінковими ефектами ми вперше показали, що SC ліраглутид підвищує активізацію лептину pSTAT3 в нейронах гіпоталамусу, ефект, який може бути частково заснований на опосередкованому ліраглутидом зниженні експресії гіпоталамусу PTP1B. Потрібні подальші дослідження, щоб вивчити, чи є ці ефекти споживання комбінацій лептином та ліраглутидом при зниженні маси тіла при наявності інших шляхів введення, тривалого хронічного введення та зберігаються на моделях гризунів DIO.
Подяка
Ми дякуємо наступним особам за помітний внесок: д-р Кендра Бенс, Дерек Циммер, Поллі Ван ден Берг, Дженніфер Гілберт, Джеффрі Чен та Ембер Альхадефф.
- Побічні ефекти монуролу загальні, важкі, тривалі
- Довгострокові наслідки збільшення споживання білка після втрати ваги на вміст внутрішньопечінкових ліпідів та
- Побічні ефекти кетаміну загальні, важкі, довгострокові
- Лігніни та їх похідні з благотворним впливом на здоров'я людини
- Побічні ефекти мізопростолу Поширені, важкі, тривалі