Кополімеризація заміщеного фенілселенідом малеіміду зі стиролом та поведінка його окислювального виведення
Пов’язані дані
Анотація
Селенвмісний мономер монофенілмалеїмід селенід (МСМ) синтезували та кополімеризували зі стиролом (St) з використанням оборотної полімеризації ланцюгового додавання-фрагментації (RAFT). Отримані сополімери з контрольованою молекулярною масою та вузьким молекулярно-масовим розподілом. Структура кополімеру характеризувалася ядерним магнітним резонансом, матричним допоміжним лазерним десорбцією/іонізацією часу прольоту (MALDI-TOF) мас-спектром, інфрачервоною спектроскопією Фур'є-перетворення (FT-IR) та ультрафіолетово-видимою спектроскопією (UV-vis ) спектроскопія. Сополімер може окислюватися H2O2, утворюючи вуглець-вуглецеві подвійні зв'язки в межах основного ланцюга завдяки унікальній чутливості селенідних груп у присутності окисників. Така зміна структури призвела до цікавого посилення випромінювання фотолюмінесценції, пов'язаного з концентрацією.
1. Вступ
Насправді, селенсодержащіе фрагменти можуть бути усунені при м'яких умовах. Юкі та ін. продемонстрували, що функціоналізований на кінці селенід полімер може бути окислений до відповідного полімеру з кінцевим селеноксидом, і вони дотримувались цього методу шляхом елімінації, отримуючи полімер, що містить подвійний зв'язок у кінцевих групах [10]. У 2016 році Dai et al. отримав високорегіоселективний карбонаселеновий стирол у присутності H2O2 [11]. Ця реакція є ефективним методом для синтезу цільових алкенів за допомогою елімінації селеноксиду, синтезу та хіральних вуглеводнів, які містять арильний фрагмент у стереогенному атомі вуглецю, якщо використовується хіральний селеновий регент.
Селено-опосередкована радикальна полімеризація (SeRP) широко застосовується як метод, що застосовується для отримання селенвмісних полімерів [20,21]. Однак повідомлень про радикальну полімеризацію вінілових мономерів, що містять селенідний фрагмент, було небагато. Ймовірно, це було пов’язано з сильною взаємодією селенового стому із вільними радикалами [22,23]. У 1996 р. Юкі та співавт. повідомили про новий тип селенвмісних вінілових мономерів (п-метилселеностірену та п-фенілселеностірену), які можуть полімеризуватися з азодій-ізобутиронітрилом (AIBN) або пероксидом бензоїлу (БПО), щоб отримати відповідні полімери [24]. У 2017 році Пан та співавт. продемонстрував селенид-вмісний мономер для отримання динамічних ковалентних зшитих полімерів [25]. Цей мономер може одночасно діяти як сомономер, зшиваючий пристрій, ініціатор та посередник.
На основі опису літератури в цьому документі ми підготували селензмісний мономер малеїміду монофеніл малеїмід селенід (МСМ), який міг кополімеризуватися зі стиролом шляхом оборотної полімеризації ланцюгового додавання-фрагментації (RAFT) (схема 1а). Успішно отримані сополімери з контрольованим молекулярно-масовим розподілом. Крім того, завдяки розщепленню слабкого селеновуглецевого зв’язку, молекулярна частка сополімеру була зменшена при обробці H2O2, а потім подвійні зв’язки вуглець-вуглецеві утворювались в остові окисленого сополімеру (схема 1b). Ця процедура забезпечує нового кандидата для отримання зшитого полімеру з використанням внутрішніх вуглець-вуглецевих подвійних зв'язків як зшивального агента. Крім того, для окисленого сополімеру інтенсивність випромінювання ФЛ спектральної області при 460 нм може бути підвищена як у твердому стані, так і в розчині.
2. Матеріали та характеристика
2.1. Матеріали
Стирол (St, Sinopharm Chemical Reagent, Шанхай, Китай, 99%) очищали, пропускаючи через короткі колонки Al2O3 перед використанням. Дифенилдиселенід (DPDS) [26], 2-ціанопроп-2-іл-1-дитионафталат (CPDN) [27,28] та N-бутилмоноброммалеймід [29] були синтезовані відповідно до літературних процедур. 2,2-азобізізобутиронітрил (AIBN, Sinopharm Chemical Reagent, Китай, 98%) очищали перекристалізацією з етанолу. Інші реагенти були придбані у Sinopharm Chemical Reagent Co., Ltd. і використовувались без подальшого очищення.
2.2. Характеристика
2.3. Синтез моноселеномалеіміду (МСМ)
До розчину DPDS (1,56 г, 5 ммоль) у 50 мл C2H5OH-DMF (3: 2) додавали NaBH4 (0,15 г, 4 ммоль) в атмосфері азоту при кімнатній температурі. Після 30 хв перемішування при 0 ° С додавали N-бутилмоноброммалеімід (1,16 г, 5 ммоль). Розчин перемішували протягом 30 хв. Реакційну суміш екстрагували дихлорметаном (3 × 40 мл) і промивали водою. Органічний шар сушили над безводним сульфатом магнію і концентрували. Залишок піддавали колонковому хроматографічному розділенню (силікагель, [гексан]/[етилацетат] = 20/1, об/об), отримуючи 0,81 г (66% вихід) монофенилмалеіміду селеніду (МСМ). ЯМР 1Н (300 МГц, CDCl3, δ, м.д.) (Малюнок S1): 7,66–7,64 (м, 1H), 7,63–7,61 (м, 1H), 7,50–7,38 (m, 3H), 5,86 (s, 1H) ), 3,51 (t, J = 7,2 Гц, 2Н), 1,63-1,50 (м, 2H), 1,31 (m, 2H), 0,92 (t, J = 7,3 Гц, 3H). ЯМР 13 C (75 МГц, CDCl3, δ, м.д.) (Малюнок S2): δ = 169,76 (1C), 169,01 (1C), 150,22 (1C), 135,88 (2C), 130,26 (2C), 130,04 (1C), 125,48 (1С), 123,90 (1С), 38,01 (1С), 30,63 (1С), 19,96 (1С), 13,55 (1С). ЯМР 77 Se (600 МГц, CDCl3, δ, ppm) (Малюнок S3): δ = 387,51 (1Se).
2.4. Загальні процедури для оборотної полімеризації ланцюга додавання-фрагментація (RAFT) полімеризації стиролу та ЧСЧ
Полімеризацію проводили в запеченій пробірці Шленка під захистом аргону. Що стосується молярного співвідношення з [St] 0/[MSM] 0/[CPDN] 0/[AIBN] 0 = 200/200/2/1, MSM (2,67 г, 8,62 ммоль), St (1,0 мл, 8,63 ммоль) ), CPDN (23,3 мг, 0,086 ммоль) та AIBN (7,1 мг, 0,043 ммоль) додавали в пробірку. Додавали толуол (50 мкл) і використовували як внутрішній стандарт для розрахунку ЯМР 1 Н. Невелику порцію суміші збирали для визначення вихідного співвідношення мономерів за допомогою 1 H ЯМР. Розчин тричі дегазували шляхом заморожування-відтавання. Потім реакційну пробірку купали в масляній бані, встановленій при 70 ° C. Конверсію мономеру визначали методом ЯМР 1 H спектроскопії. Через заздалегідь визначений час частину полімеризаційної суміші безпосередньо розчиняли в CDCl3 для 1 H ЯМР-аналізу для визначення відповідної конверсії мономеру. За весь процес полімеризації вміст толуолу не змінювався, тому інтеграл толуолу в ЯМР 1 Н міг бути легко використаний як внутрішній стандарт для оцінки конверсії мономерів шляхом порівняння інтегрального значення подвійних зв'язків із значенням толуол. Типовий спектр показаний на малюнку S4. Залишкову суміш розчиняли в ТГФ і осаджували в надлишку метанолу. Після фільтрування сополімер сушили у вакуумі при 30 ° С протягом 24 годин.
2.5. Окислення сополімеру з використанням H2O2 як окислювача
Окислення проводили в ампулі об'ємом 2 мл із сополімером (35 мг, зразок у таблиці 1, запис 4) у ТГФ (1 мл) та окислювали H2O2 (45 мкл, 30% об./Об.) При кімнатній температурі протягом 3 год. Згодом розчин осаджували в метанолі. Після фільтрування сополімер сушили у вакуумі при 30 ° С протягом 24 годин.
Таблиця 1
Реверсивна полімеризація ланцюга додавання-фрагментація ланцюга (RAFT) St та моноселеномалеїміду (МСМ) при різних мольних співвідношеннях a .
| 1 | 200/6/2/1 | 2.0 | 20 | 100 | 2000 рік | 1.28 |
| 2 | 200/20/2/1 | 2.5 | 51 | 100 | 2600 | 1,35 |
| 3 | 200/60/2/1 | 10 | 27 | 25 | 2500 | 1.43 |
| 4 | 200/200/2/1 | 9,0 | 34 | 27 | 3100 | 1,62 |
| 5 | 0/200/2/1 | 24,0 | Н.А. | - | - | - |
Умови полімеризації: VSt = 1,0 мл, Vтолуол = 50 мкл, під захистом аргону, 70 ° C; b Розраховано на основі 1 Н ЯМР вихідних експериментальних зразків шляхом порівняння інтеграції одного вінілового протону залишкового мономеру з інтеграцією вихідного мономеру з толуолом як внутрішнього стандарту; c Визначено за допомогою GPC з полістиролом як стандарт.
3. Результати та обговорення
3.1. Сополімеризація St та MSM
Малеімід - це добре відомий електронодефіцитний мономер, який продемонстрував погану здатність до гомополімеризації та сприяв кополімеризації з багатим електронами мономером. Тут малеімід, заміщений селенідом, МСМ, був сополімеризований зі стиролом. RAFT-полімеризацію використовували для цілей синтезу полімерів з контрольованою молекулярною масою поряд з вузьким молекулярно-масовим розподілом. Результати полімеризації при різних мольних співвідношеннях St до MSM були зведені в Таблицю 1. Як показано в таблиці 1, кополімеризацію St та MSM можна проводити за допомогою полімеризації RAFT, використовуючи CPDN в якості агента RAFT та AIBN як ініціатора при 70 ° C. Можна отримати полімери з вузьким молекулярно-масовим розподілом. Однак розподіл молекулярної маси (Đ) кінцевого сополімеру збільшувався із зменшенням молярного співвідношення [St] 0/[MSM] 0, що може бути обумовлено реакційною здатністю селеніду з радикалом [30]. Крім того, у разі відсутності сомономера St (таблиця 1, запис 5), навіть після 24 годин часу полімеризації не було отримано полімеру, що вказує на те, що МСМ важко гомополімеризуватися.
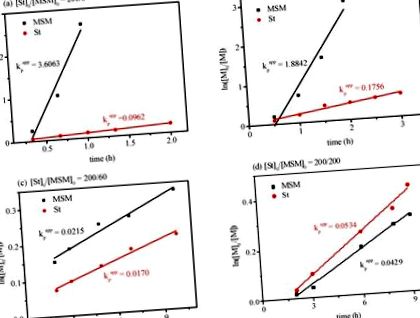
Щоб глибоко зрозуміти поведінку RAFT-кополімеризації St та MSM, досліджували кінетику полімеризації з різними молярними співвідношеннями. Результати показані на малюнку 1. Результати показали, що вся кінетика полімеризації передавала лінійні графіки. Такі результати показали, що протягом періоду полімеризації концентрація радикалів, що розповсюджуються, залишалась приблизно постійною. "Жива"/контрольована особливість може також проявлятися іншими результатами. Малюнок S5 (середньочислова молекулярна маса та розподіл молекулярної маси (Đ) змінюються залежно від загальної конверсії мономеру) показав добрі лінійні залежності між молекулярною масою та загальною конверсією мономеру. Криві GPC отриманих полімерів при різних співвідношеннях подачі (рис. S6) демонстрували унімодальні профілі у всіх випадках, підтверджуючи, що отримані полімери утворюються шляхом кополімеризації МСМ та St, а не як суміш двох гомополімерів. Можна помітити, що загалом рівень споживання ЧСЧ зростав із збільшенням молярного відношення [St] 0/[MSM] 0.
Кінетичні графіки реверсивної кополімеризації ланцюгової передачі (RAFT) додавання та фрагментації з різними молярними співвідношеннями, (a) [St] 0/[MSM] 0 = 200/6; (b) [St] 0/[MSM] 0 = 200/20; (c) [St] 0/[MSM] 0 = 200/60; (d) [St] 0/[MSM] 0 = 200/200, VSt = 1,0 мл, Vtoluene = 50 мкл, температура 70 ° C.
- Повна стаття Вплив фруктового оцту на пошкодження печінки та окислювальний стрес у щурів з високим вмістом жиру
- Хронічна циклічна вага підвищує рівень окисного пошкодження ДНК у молочній залозі самок щурів, яких годували
- Вживання авентрамідів, одержуваних з вівса, зменшує збільшення ваги, окислювальний стрес,
- Знайти найкраще) Top Fat Burner для чоловіків 28-денна втрата ваги - табір Комо
- Дієтичні таблетки Glam D огляд Dorfschmiede Freienseen