Клінічні та лабораторні прояви мутації гена протромбіну у жінок репродуктивного віку
А. П. Момот
1 Алтайське відділення FSBI, Національний дослідницький центр гематології, м. Барнаул, Росія
М. Г. Ніколаєва
2 Акушерсько-гінекологічний факультет з курсом додаткової професійної освіти ФГБУ вищої освіти Алтайського державного медичного університету, м. Барнаул, Росія
Н. Н. Ясафова
3 Алтайське відділення ФГБУ, Національний науковий центр гематології Міністерства охорони здоров'я Російської Федерації, м. Барнаул, Росія
М. С. Зайнуліна
4 Санкт-Петербурзький державний фінансований заклад, "Пологовий будинок № 6 імені професора В.Ф. Снегірєва ”, кафедра акушерства, гінекології та репродуктивної медицини, Перший Санкт-Петербурзький державний медичний університет, Санкт-Петербург, Росія
К. А. Момот
3 Алтайське відділення ФГБУ, Національний науковий центр гематології Міністерства охорони здоров'я Російської Федерації, м. Барнаул, Росія
І. А. Тараненко
3 Алтайське відділення ФГБУ, Національний науковий центр гематології Міністерства охорони здоров'я Російської Федерації, м. Барнаул, Росія
Анотація
Мета дослідження
Дослідити зв'язок активності протромбіну (фактор II) з урахуванням мутації протромбіну G20210A з його клінічними проявами як тромботичні ускладнення.
Матеріали і методи
Проведено проспективне клінічне когортне дослідження 290 жінок репродуктивного віку. Визначено дві когортні групи: дослідну групу із 140 пацієнтів з мутацією протромбіну G20210A генотипу та контрольну групу 150 жінок з генотипом G20210G.
Результати
Карета мутації протромбіну G20210A пов'язана з ризиком тромботичних ускладнень порівняно з диким типом G20210G (RR = 17,1; p Ключові слова: мутація гена протромбіну, мутація протромбіну G20210A генотип, венозні та артеріальні тромбози, активність протромбіну
Вступ
Незважаючи на значний прогрес у клінічній практиці та фармакології, тромботичні події будь-якої локалізації залишаються основною причиною смертності та інвалідності в розвинених країнах і становлять глобальну медичну та соціальну проблему1,2. Встановлено, що 6–20% підтверджених тромботичних подій обумовлені мутацією протромбіну G20210A, 3–5, яка характеризується автосомно-домінантним успадкуванням і проявляється в заміні нуклеотиду гуаніну (G) нуклеотидом аденіну (A) у положенні 20210. Через підвищену незначну експресію гена рівень та активність протромбіну, кодованого геном, може бути в 1,5–2 рази вище норми.3 Протромбін, або фактор II, відноситься до факторів згортання крові, що залежать від вітаміну К, будучи попередником ключа коагуляційний фермент, тромбін. 6,7
Мутація протромбіну G20210A виявлена у 1–6% населення, 8,9 збільшуючи ризик венозного тромбозу на 2–4,10
Як дійшли висновку експерти, гетерозиготний носій мутації протромбіну G20210A розглядається як фактор “низького ризику” розвитку венозних тромбоемболічних ускладнень (VTEC), 11–14 встановлюючи ізольований відносний ризик тромботичних ускладнень як OR = 2–3,15, 16 Однак, з урахуванням додаткових факторів, величина тромбогенного ризику значно варіюється. Повідомляється, що комбіновані гормональні контрацептиви (КГК) збільшують ризик венозних тромбоемболічних ускладнень (ВТЕК) для носіїв мутації протромбіну G20210A на 16,17–20, а гормональна терапія в клімактеричному періоді збільшує ризик ТГВ на 2–4,19,21–23. це, ряд авторів показали, що ризик розвитку VTEC під час вагітності та після пологів у пацієнтів з мутацією протромбіну G20210A становить АБО 3–15 порівняно з часом поза вагітністю.
Таким чином, ризик тромбозу у носіїв мутації протромбіну G20210A можна вважати кумулятивним і залежати від тимчасових (відносно контрольованих) факторів, таких як вагітність та введення естрогену, що містять ліки.27 Проте, незважаючи на статистично значущу зв'язок між мутацією протромбіну G20210A та ризик тромбозу при встановленні додаткових факторів ризику (введення ХГС, МГТ та вагітність), неможливо передбачити ймовірність тромботичних подій.
Раніше ми провели дослідження, спрямоване на вивчення зв'язку між фенотипом лабораторії мутацій Лейдена та ризиком тромбозів у жінок репродуктивного віку. 28,29 Дослідження тривало 9 років і включало динамічне спостереження когорти 500 FV Leiden G1691A (FVL G1691A) носії мутації. Встановлено, що у соматично здорових пацієнтів генотип FVL G1691A не впливав на ризик тромбозів і був порівнянним з таким у звичайних хворих на зиготу [RR 1,5; 95% ДІ 0,03–76,5; р = 0,8269]. З додатковими факторами ризику (супутні захворювання, травми, ХГС, вагітність) ризик VTEC становив 9,3 [RR 9,3; 95% ДІ 4,7–18,5; р 0,05) та етнічної приналежності: досліджувана група становила 92,9% кавказької раси, контрольна група - 91,9% кавказької раси (р> 0,05). Період спостереження для обох груп становив не менше 6 років.
Критерії включення до дослідницької групи:
Каретка мутації протромбіну G20210A (GenBank 176930.0009);
Від 18 до 45 років.
Критерії включення контрольної групи були такими ж, як і для досліджуваної групи, але пацієнти не були носіями мутації протромбіну G20210A.
Критерії виключення з навчальної групи:
аутоімунні захворювання, включаючи антифосфоліпідний синдром;
фактор V мутація Лейдена (GenBank 612309.0001);
зниження функціональної активності антитромбіну III, білків С або S.
Дослідження було схвалено місцевим комітетом з етики ФСБІ ВО ВНЗ АМНУ МОЗ Росії (протокол №5 від 25.06.12). Відповідно до нещодавнього перегляду Гельсінкської декларації Всесвітньої медичної асоціації, перед дослідженням всі жінки дали свою поінформовану згоду на використання їх біологічного матеріалу.
Наявність мутації протромбіну G21210A було виявлено методом ПЛР з використанням реагентів компанії Litekh (Росія). Матеріалом дослідження була геномна ДНК людини, виділена з лейкоцитів периферичної крові. Аналіз базувався на методі полімеразної ланцюгової реакції в режимі реального часу (ПЛР у реальному часі) з використанням конкуруючих зондів TagMan, комплементарних поліморфним ділянкам ДНК. У всіх пацієнтів активність протромбіну перевіряли з використанням дефіцитної у факторі II плазми, реагенту Tromborel S та автоматичного коагулометра BCS XP (Siemens, Німеччина). Активність протромбіну у пацієнтів досліджуваної групи тестували 3–9 разів протягом усього періоду спостереження. У випадку пацієнтів з VTEC враховувався результат до тромбозу.
Статистика
Статистичну обробку даних проводили за допомогою статистичного програмного пакету MedCalc версії 17.9.7 (ліцензія BU556-P12YT-BBS55-YAH5M-UBE51). Варіаційні ряди перевіряли на нормальний розподіл за допомогою W-тесту Шапіро-Вілка. Лабораторні значення представлені як діаграми розсіяння з ділянками коробки (ділянка коробки та вуса). Графік коробки представляє медіану (Me) - середину вибірки, показану у вигляді маркера на внутрішній лінії кожного поля; інтерквартильний діапазон - інтервал між 25-м та 75-м процентилями, що містить центральні 50% спостереження зразка, показаний у вигляді коробки; 25-й та 75-й процентилі (нижній та верхній квартилі), що містять чверть найнижчого та чверть найвищого значень у зразку, показані у вигляді прямих ліній (вусів), що виходять із коробки. Верхня вуса тягнеться від верхньої межі коробки до максимального значення. Нижня вуса йде від нижньої межі коробки до мінімального значення. Діаграма розсіювання, що представляє всі точки даних, накладається на графік вікна.
Для порівняння рівнів активності протромбіну у двох незалежних зразках був використаний непараметричний статистичний U-тест Манна-Уітні. Для визначення прогностичного значення індексу активності протромбіну для розвитку тромбозів у носіїв мутації протромбіну G20210A використовували криву ROC з подальшим розрахунком AUC.
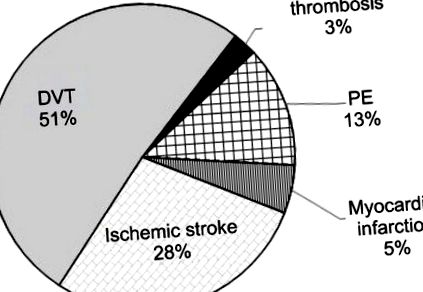
Структура тромбозу за локалізацією у жінок (у віці 18–45 років) з мутацією каретки протромбіну G20210A.
Скорочення: ТГВ, тромбоз глибоких вен; ТЕЛА, легенева емболія.
У 66,7% (26 із 39) випадків спостерігалося, що тромбози мали венозну локалізацію, тоді як середній вік виникнення гострого тромбозу становив 30,7 ± 4,3 року. Артеріальні тромбози у формі гострого інфаркту міокарда та ішемічного інсульту діагностували у 33,3% випадків (13 із 39), середній вік пацієнтів цієї групи становив 31,8 ± 3,8 року. Таким чином, можна зробити висновок, що вік, у якому відбувається тромботична подія з мутацією протромбіну G20210A, є порівнянним (р> 0,05) як для артеріальної, так і для венозної локалізації.
Для того, щоб визначити потенційні фактори ризику, що ініціюють розвиток тромботичної події, ми провели порівняльний аналіз демографічних та клінічних характеристик анамнезу пацієнтів як у досліджуваній, так і в контрольній групах (Таблиця 1).
Таблиця 1
Характеристика пацієнтів у групах порівняння
| Вік | 18–35 років | 101 (72,1) | 112 (74,7) | 0,9 | 0,5216–1,4801 | 0,6268 |
| > 35 років | 39 (27,9) | 38 (25,3) | 1.1 | 0,6756–1,9171 | 0,6251 | |
| Кавказька раса | 130 (92,9) | 138 (92,0) | 1.1 | 0,4723–2,7057 | 0,7831 | |
| ІМТ (кг/м 2) | 0,5 | |||||
| Одна минула доставка | 50 (35,7) | 59 (39,3) | 0,9 | 0,5322–1,3796 | 0,525 | |
| Дві минулі поставки | 50 (35,7) | 40 (26,7) | 1.5 | 0,9262–2,5201 | 0,097 | |
| Три або більше минулих поставок | 9 (6,4) | 16 (10,7) | 0,6 | 0,2456–1,3481 | 0,2032 | |
Аналіз показав, що пацієнти у групах порівняння є порівнянними за віком, більшості з яких є 18–35 років. Індекс маси тіла в групах також був однаковим. Додаткова вага (ІМТ> 25) була виявлена у 27,9% носіїв мутації протромбіну G20210A та у 24% жінок із типом дикої мутації протромбіну G20210G, що не представляє статистичної різниці. Для контролю народжуваності ХГК приймали 20,7% жінок у досліджуваній групі та 20,0% пацієнтів у контрольній групі (p = 0,88), 109 (77,9%) пацієнтів у групі носіїв мутації протромбіну G20210A та 115 (76,7 %) жінок у контрольній групі мали пологи в анамнезі. За паритетом доставки не було статистично значущої різниці між респондентами групи порівняння. Примітно, що сімейний анамнез, обтяжений тромбозами до 50-річного віку, у носіїв мутації протромбіну G20210A був виявлений у 20,0% випадків, що статистично значно частіше, ніж у дикій групі типу G20210G - 4,7% [OR5.1; 95% ДІ 2,2–12,1; p = 0,0002].
Загалом порівняльний аналіз потенційних факторів ризику, що викликають тромботичні події, показав, що пацієнти в групах порівняння порівнянні за основними аналізованими параметрами, за винятком сімейної історії тромбозів, що свідчить про спадкову схильність (у нашій ситуації мутація протромбіну G20210A). Ми не змогли оцінити коефіцієнт «куріння» у групах порівняння, оскільки деякі респонденти відмовились відповісти на це питання.
З метою виявлення потенційних факторів ризику, що викликають тромботичні події у носіїв мутації протромбіну G20210A, всередині групи був проведений єдиний факторний аналіз за вказаними факторами ризику (табл.
Таблиця 2
Демографічні та клінічні характеристики анамнезу пацієнтів у досліджуваній групі залежно від особистого тромботичного анамнезу
Причинні фактори, що передували тромботичним подіям у пацієнтів досліджуваної групи.
При детальному вивченні було встановлено, що з 13 (33%) випадків гострого тромбозу мали місце носії мутації протромбіну G20210A на ХГС, у одного 39-річного пацієнта був діагностований гострий інфаркт міокарда, а у двох (24 та 33 років) при ішемічному інсульті. Вісім досліджень показали локалізацію венозного тромбозу у поєднанні з ХГС у глибоких венах великогомілкової кістки (середній вік 31,0 ± 2,4 року), а в двох випадках діагностовано ПЕ (25 та 39 років). В процесі лікування трьом пацієнтам імплантували порожнистий фільтр. Слід зазначити, що ХГК призначали виключно з метою контрацепції.
Під час вагітності було діагностовано 10 тромботичних подій (25,6% з 39 епізодів). У двох випадках це був ішемічний інсульт, діагностований у першому триместрі вагітності; у 8 випадках це був тромбоз, локалізований в області глибокої вени гомілки, який розвинувся у 5 пацієнтів через 2-3 дні після пологів та у 3 пацієнтів протягом першого та другого триместру.
У 13 дослідженнях (33,3% з 39 епізодів тромбозів) з носієм мутації протромбіну G20210A причину тромбозу встановити не вдалося. У 4 пацієнтів з гострим ідіопатичним тромбозом спостерігався епізод ретромбозу на ХГС протягом першого року (n = 2) та під час вагітності (n = 2).
Показники активності протромбіну з тромботичною подією та без неї у жінок з мутацією протромбіну G20210A та з диким типом G20210G. Медіани активності протромбіну в групах зіставляли за допомогою непараметричного статистичного U-критерію Манна-Уітні.
Позначення: медіана - маркер; поле - інтервал між 25-м та 75-м процентилями, що містить центральні 50% спостережень уривку; вуса - значення, що відповідають 25-му та 75-му процентилям.
Беручи до уваги отримані дані, було проведено аналіз ROC для визначення критичного порогового значення активності протромбіну (%) для прогнозування розвитку тромбозу у носіїв мутації протромбіну G20210A незалежно від локалізації тромбозу (рис.4).
Модель кривої ROC для прогнозування розвитку тромботичних подій за активністю протромбіну (%) у носіїв мутації протромбіну G20210A.
Площа під кривою (AUC) індексу активності протромбіну була визначена як 0,904 (95% ДІ: 0,825–0,955) з рівнем значимості за p Creanga AA, Berg CJ, Syverson C, et al. Смертність від вагітності у Сполучених Штатах, 2006-2010 рр. Акушерський гінеколь. 2015 рік; 125 (1): 5–12. doi: 10.1097/AOG.0000000000000564 [PubMed] [CrossRef] [Google Scholar]
- ГЕНЕТИЧНІ ФАКТОРИ РИЗИКУ ТРОМБОФІЛІЇ У ЖІНОК РЕПРОДУКТИВНОГО ВІКУ, ЯКІ ПРОЖИВАЮТЬ У КРАСНОДАРСЬКІЙ ОБЛАСТІ
- Особливості клінічного перебігу пролактиноми у жінок ECE2019 21-го Європейського конгресу Росії
- Французькі жінки Дон; t Жиріть (після немовляти) - Поради щодо життя та кохання
- Безкоштовна профілактика безсимптомної бактеріурії у хворих на цукровий діабет жінок із діабетом
- Труднощі з харчуванням думають клінічні психологи