Кінетична молекулярна теорія
Кінетична молекулярна теорія
Обговорені на сьогодні експериментальні спостереження за поведінкою газів можна пояснити простою теоретичною моделлю, відомою як кінетична молекулярна теорія. Ця теорія базується на наступних постулатах або припущеннях.
- Гази складаються з великої кількості частинок, які поводяться як тверді сферичні предмети у стані постійного, випадкового руху.
- Ці частинки рухаються по прямій, поки не зіткнуться з іншою частинкою або стінками контейнера.
- Ці частинки набагато менше відстані між частинками. Тому більша частина об'єму газу - це порожній простір.
- Між частинками газу, а також між частинками та стінками контейнера немає сили притягання.
- Зіткнення частинок газу або зіткнення зі стінками ємності є абсолютно еластичними. Жодна енергія газової частинки не втрачається при зіткненні з іншою частинкою або зі стінками ємності.
- Середня кінетична енергія колекції частинок газу залежить від температури газу і нічого іншого.
Припущення, що лежать в основі кінетичної молекулярної теорії, можна проілюструвати за допомогою пристрою, показаного на малюнку нижче, який складається із скляної пластини, оточеної стінками, встановленими поверх трьох вібраційних двигунів. Жменька сталевих кулькових підшипників розміщена поверх скляної пластини для представлення частинок газу.
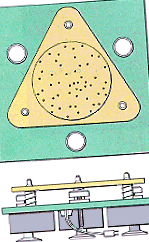 |
Коли двигуни ввімкнені, скляна пластина вібрує, що змушує кулькові підшипники рухатися постійно, випадково (постулат 1). Кожна кулька рухається по прямій, поки не зіткнеться з іншою кулькою або зі стінками контейнера (постулат 2). Хоча зіткнення часті, середня відстань між кульковими підшипниками набагато більша за діаметр кульок (постулат 3). Між окремими кульковими підшипниками або між кульковими підшипниками та стінками контейнера немає сили притягання (постулат 4).
Зіткнення, що відбуваються в цьому апараті, сильно відрізняються від зіткнень, які виникають при падінні гумової кульки на підлогу. Зіткнення гумової кульки з підлогою є нееластичними, як показано на малюнку нижче. Частина енергії кулі втрачається кожного разу, коли вона потрапляє на підлогу, поки врешті не скотиться до зупинки. У цьому апараті зіткнення абсолютно еластичні. Кулі мають так само багато енергії після зіткнення, як і раніше (постулат 5).
Будь-який об’єкт, що рухається, має a кінетична енергія що визначається як половина добутку його маси, помноженої на його швидкість у квадраті.
У будь-який час деякі кулькові підшипники на цьому апараті рухаються швидше, ніж інші, але система може бути описана середньою кінетичною енергією. Коли ми збільшуємо "температуру" системи, збільшуючи напругу на двигунах, ми виявляємо, що середня кінетична енергія кулькових підшипників збільшується (постулат 6).
Кінетична молекулярна теорія може бути використана для пояснення кожного з експериментально визначених газових законів.
Зв'язок між P та n
Тиск газу виникає внаслідок зіткнення частинок газу зі стінками ємності. Кожного разу, коли частинка газу потрапляє на стінку, вона діє на стінку силою. Збільшення кількості частинок газу в ємності збільшує частоту зіткнень зі стінками і, отже, тиск газу.
Закон Амонтоні (PT)
Останній постулат кінетичної молекулярної теорії стверджує, що середня кінетична енергія газової частинки залежить лише від температури газу. Таким чином, середня кінетична енергія частинок газу зростає, коли газ стає теплішим. Оскільки маса цих частинок постійна, їх кінетична енергія може зростати лише в тому випадку, якщо середня швидкість частинок зростає. Чим швидше ці частинки рухаються, потрапляючи на стіну, тим більшу силу вони діють на стіну. Оскільки сила за зіткнення стає більшою із збільшенням температури, повинен збільшуватися і тиск газу.
Закон Бойля (P = 1/v)
Гази можуть стискатися, оскільки більша частина об’єму газу - це порожній простір. Якщо ми стискаємо газ, не змінюючи його температури, середня кінетична енергія частинок газу залишається незмінною. Швидкість руху частинок не змінюється, але ємність менша. Таким чином, частинки переміщаються з одного кінця контейнера на інший за коротший проміжок часу. Це означає, що вони частіше б’ються об стіни. Будь-яке збільшення частоти зіткнень зі стінками повинно призводити до збільшення тиску газу. Таким чином, тиск газу стає більшим, оскільки об'єм газу стає меншим.
Закон Чарльза (V T)
Середня кінетична енергія частинок газу пропорційна температурі газу. Оскільки маса цих частинок постійна, частинки повинні рухатися швидше, оскільки газ стає теплішим. Якщо вони рухатимуться швидше, частинки будуть надавати більшу силу на контейнер кожного разу, коли потраплять на стінки, що призводить до збільшення тиску газу. Якщо стінки ємності гнучкі, він буде розширюватися, поки тиск газу ще раз не збалансує тиск атмосфери. Тому об'єм газу стає більшим із збільшенням температури газу.
Гіпотеза Авогадро (V N)
Зі збільшенням кількості частинок газу частота зіткнень зі стінками ємності повинна зростати. Це, в свою чергу, призводить до збільшення тиску газу. Гнучкі контейнери, такі як аеростат, будуть розширюватися, поки тиск газу всередині аеростата знову не збалансує тиск газу зовні. Таким чином, об’єм газу пропорційний кількості частинок газу.
Уявіть, що сталося б, якби до симулятора молекулярної динаміки додати шість кулькових підшипників різного розміру. Загальний тиск збільшився б, оскільки було б більше зіткнень зі стінками контейнера. Але тиск через зіткнення оригінальних кулькових підшипників і стінок контейнера залишиться незмінним. У контейнері так багато порожнього місця, що кожен тип кулькових підшипників так само часто потрапляє на стінки контейнера в суміші, як це було тоді, коли на скляній пластині був лише один вид кульових підшипників. Отже, загальна кількість зіткнень зі стіною в цій суміші дорівнює сумі зіткнень, які мали б місце, коли кожен розмір кульового підшипника присутній сам по собі. Іншими словами, загальний тиск суміші газів дорівнює сумі парціальних тисків окремих газів.
Деякі фізичні властивості газів залежать від ідентичності газу. Одну з цих фізичних властивостей можна побачити, коли вивчається рух газів.
У 1829 р. Томас Грем використовував апарат, подібний до того, що показаний на малюнку нижче, для вивчення дифузія газу - швидкість змішування двох газів. Цей апарат складається зі скляної трубки, герметично закритої на одному кінці штукатуркою, яка має отвори, достатньо великі, щоб газ міг проникати в трубу або виходити з неї. Коли трубка наповнена газом H2, рівень води в трубці повільно підвищується, оскільки молекули H2 всередині трубки виходять через отвори в гіпсі швидше, ніж молекули в повітрі можуть потрапити в трубку. Вивчаючи швидкість, з якою змінювався рівень води в цьому апараті, Грем зміг отримати дані про швидкість змішування різних газів з повітрям.
Грем виявив, що швидкості дифузії газів обернено пропорційні квадратному кореню їх густини.
З часом ці стосунки стали відомими як Закон дифузії Грем.
Щоб зрозуміти важливість цього відкриття, ми повинні пам’ятати, що рівні обсяги різних газів містять однакову кількість частинок. Як результат, кількість молей газу на літр при певній температурі та тиску є постійною, що означає, що щільність газу прямо пропорційна його молекулярній масі. Отже, закон дифузії hamрема можна також записати наступним чином.
Подібні результати були отримані, коли Грем вивчав норму випіт газу, це швидкість, з якою газ витікає через отвір у вакуум. Швидкість витікання газу також обернено пропорційна квадратному кореню або щільності, або молекулярної маси газу.
Закон випиту Грема можна продемонструвати за допомогою апарату на малюнку нижче. Товстостінну колбу фільтра відсмоктують за допомогою вакуумного насоса. Шприц наповнюють 25 мл газу, і час, необхідний для виходу газу через голку шприца в евакуйовану колбу фільтра, вимірюють секундоміром.
Як ми можемо бачити, коли дані, отримані в цьому експерименті, зображені на малюнку нижче, час, необхідний для виходу 25 мл зразків різних газів у вакуум, пропорційний квадратному кореню молекулярної маси газу. Швидкість витікання газів тому обернено пропорційна квадратному кореню молекулярної маси. Спостереження Грема щодо швидкості дифузії (змішування) або витікання (виходу через отвір) дозволяють припустити, що відносно легкі частинки газу, такі як молекули H2 або атоми He, рухаються швидше, ніж відносно важкі частинки газу, такі як молекули CO2 або SO2.
Кінетична молекулярна теорія може бути використана для пояснення результатів, отриманих Грем, коли він вивчав дифузію та витікання газів. Ключем до цього пояснення є останній постулат кінетичної теорії, який передбачає, що температура системи пропорційна середній кінетичній енергії її частинок і нічому іншому. Іншими словами, температура системи зростає тоді і тільки тоді, коли відбувається збільшення середньої кінетичної енергії її частинок.
Отже, два гази, такі як H2 та O2, при однаковій температурі повинні мати однакову середню кінетичну енергію. Це можна представити наступним рівнянням.
Це рівняння можна спростити, помноживши обидві сторони на два.
Потім його можна переставити, щоб отримати наступне.
Отримання квадратного кореня з обох сторін цього рівняння дає співвідношення між відношенням швидкостей, з якими рухаються два гази, і квадратним коренем відношення їх молекулярних ваг.
Це рівняння є модифікованою формою закону hamрема. Це передбачає, що швидкість (або швидкість), з якою рухаються молекули газу, обернено пропорційна квадратному кореню їх молекулярних ваг.
Обчисліть середню швидкість молекули Н2 при 0 ° С, якщо середня швидкість молекули О2 при цій температурі становить 500 м/с.
- Теорія та практика цифр фармацевтичної технології; lis Tank; нівт; р
- Трамп просуває безпідставну теорію змови прихильника про те, що Клінтон пов’язана із самогубством Епштейна -
- Термогравіметричний аналіз та кінетичне дослідження піролізу репрезентативних медичних відходів
- Теорія великого вибуху, як вони виглядали в першому епізоді та зараз
- Божевільна теорія змови Авріл Лавін, яка запалила Twitter