Кетонові тіла при епілепсії
Мелані А. МакНеллі
1 Медична школа університету Джона Гопкінса, Балтимор, MD 21205, США
Адам Л. Хартман
2 Неврологічний факультет, Медичний факультет Університету Джона Хопкінса, Балтимор, MD 21205, США
Анотація
Судоми, стійкі до стандартних ліків, залишаються основною клінічною проблемою. Одним із недостатньо використаних варіантів для пацієнтів із стійкими до ліків нападами є дієта з високим вмістом жиру та низьким вмістом вуглеводів. Дієта отримала свою назву, базуючись на спостереженні, що пацієнти, які споживають цю дієту, виробляють кетонові тіла (наприклад, ацетоацетат, β-гідроксибутират та ацетон). Хоча точні механізми дієти невідомі, кетонові тіла припускають, що вони сприяють протисудомному та протиепілептичному ефектам. У цьому огляді обговорюються протисудомні властивості кетонових тіл та кетогенна дієта (включаючи GABAergic та глутаматергічні ефекти). Через важливість метаболізму кетонового тіла на ранніх етапах життя також обговорюється вплив кетонових тіл на розвиток нейронів in vitro. Розуміння того, як кетонові тіла впливають, допоможе оптимізувати їх використання при лікуванні епілепсії та інших неврологічних розладів.
Вступ
Епілепсія є руйнівним і широко розповсюдженим захворюванням, яким страждає близько 1% населення США і принаймні 50 мільйонів людей у всьому світі (Hauser & Kurland 1975, Hirtz et al. 2007, Kobau et al. 2008). Незважаючи на те, що розроблено цілий ряд протиепілептичних препаратів, вони залишаються нездатними контролювати напади приблизно у 30% пацієнтів з епілепсією (Kwan & Brodie 2000). Деякі з цих пацієнтів є кандидатами на хірургічну резекцію аномальної тканини (наприклад, мезіально-скроневий склероз), але можливості обмежені для пацієнтів без таких уражень. Щоб допомогти цим пацієнтам з нехірургічною нерозв'язною епілепсією, в 1920-х роках була розроблена дієта з низьким вмістом вуглеводів і вуглеводами, відома як кетогенна дієта, щоб імітувати корисні ефекти голодування на контроль нападів (Hartman & Vining 2007). Багато клінічних досліджень підтвердили його сприятливу дію, рандомізоване дослідження показало зменшення судом на 75% у дітей на кетогенній дієті протягом трьох місяців (Neal et al. 2008). Однак, хоча досліджено багато можливостей, механізми, за допомогою яких кетогенна дієта надає свої протисудомні ефекти, залишаються невідомими. Розкриття цих механізмів дозволить вдосконалити його клінічне використання, а також визначити нові цілі для подальшого розвитку терапії.
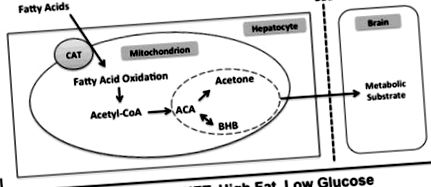
Кетогенна дієта з високим вмістом жирів і низьким вмістом вуглеводів викликає зміну метаболічної активності гепатоцитів. За цих умов цикл Кребса не може використовувати високий рівень ацетил-КоА, що утворюється з жиру. Залишок ацетил-КоА перетворюється в ацетоацетат кетонового тіла. Два додаткові кетонові тіла, ацетон та β-гідроксибутират, отримують з ацетоацетату шляхом спонтанного розкладання та ферментативного перетворення з β-гідроксибутиратдегідрогеназою відповідно. Потім три кетонові тіла вивільняються з гепатоциту, перетинають гематоенцефалічний бар’єр і можуть здійснювати свій вплив на мозок. Абревіатури: CAT, карнітин-ацилкарнітнін транслоказа; ACA, ацетоацетат; BHB, β-гідроксибутират; BBB, гематоенцефалічний бар’єр.
Кетонові тіла: протисудомні властивості
Кетонові тіла: можливі механізми дії
Обговорені раніше дослідження in vivo свідчать про те, що кетонові тіла мають протисудомні властивості. Виник ряд теорій, що пояснюють знижений поріг судом у цих моделях. Глутамат та γ-аміномасляна кислота (ГАМК), відповідно, є основними збудливими та гальмівними нейромедіаторами мозку. Обговорювалось, як кетонові тіла впливають на рівень цих нейромедіаторів та їх рецепторів, їх рецепторну активність та обробку. Також з’являються нові теорії щодо впливу кетонових тіл на потенціал мембран нейронів, збудливість нейронів та активні форми кисню. Тут представлений огляд поточних даних, що оцінюють ці еволюціонуючі гіпотези.
VGLUTs
Інші нейромедіатори, транспортери та рецептори
Інші нейромедіаторні системи, які зазвичай не враховуються при епілепсії, також виявляються необхідними для протисудомної дії кетогенної дієти. Дані щодо ефекту норадреналіну включають відсутність захисної дії кетогенної дієти проти судомного фторотилу у мишей-нокаутів бета-гідроксилази дофаміну, які не можуть синтезувати норадреналін (Szot et al. 2001). Докази необхідності нейромедіації аденозину були показані, коли миші з мутацією рецепторів аденозину А1 не були захищені від повторних нападів після лікування кетогенною дієтою (Masino et al. 2011). Кетогенна дієта також зменшила фермент метаболізму аденозину, аденозинкіназу. Інші нейромедіатори не досліджені настільки ретельно.
Канали KATP
Цикл Кребса та ланцюг транспорту електронів
Одна з теорій багатогранного впливу кетогенної дієти полягає в тому, що вона може оптимізувати функцію циклу Кребса з подальшим впливом на функцію нейронів. Логічною відправною точкою для цієї теорії є те, що ацетил КоА (один із продуктів кетогенезу) є основним субстратом циклу Кребса (рис. 1). Після циклу Кребса β-гідроксибутират покращував окисно-відновну активність та зменшував загибель клітин у дофамінергічних клітинах SH-SY5Y після впливу токсину ротенону комплексу I (Имамура та ін., 2006). Здається, для β-гідроксибутирату потрібен інтактний комплекс II для надання його сприятливих ефектів у двох різних моделях нейродегенерації, включаючи модель токсину складного ІІ (3-нітропропіонова кислота) та модель миші SOD1-G93A для аміотрофічного бічного склерозу (хвороба Лу Геріга) (Tieu et al. 2003, Zhao et al. 2006). Зовсім недавно Кім та співавт. показав на зрізах гіпокампа, що коктейль з β-гідроксибутирату та ацетоацетату зберігав синаптичну активність після впливу ротенону або 3-нітропропіонової кислоти, хоча існували деякі регіональні диспропорції (тобто різні реакції навіть у межах одного зрізу), які були відзначені під час впливу кетонів на останні (Kim do et al. 2010). Причина відмінностей між двома дослідженнями 3-нітропропіонової кислоти незрозуміла.
Також було показано, що кетогенна дієта індукує транскрипцію деяких мРНК субодиниць ланцюга транспортного ланцюга (Bough et al. 2006). Збільшена кількість субодиниць ланцюга транспорту електронів може збільшити «запаси енергії» нейронів, і насправді кетогенні дієти збільшують рівень АТФ у мозку в деяких (але не у всіх) дослідженнях на гризунах (DeVivo et al. 1978, Bough et al. 2006, Nylen et 2009, Kim do et al. 2010). Останній гіпотезою є те, що підвищений рівень АТФ може стабілізувати потенціал нейрональної мембрани за рахунок посилення функції Na + -K + -АТФаз (Bough & Rho 2007). Хоча телеологічно задовільні, описані тут події не були повністю пов’язані експериментально ні на нормальних, ні на епілепсійних моделях тварин. Тим не менше, окремі експерименти вказують на потенційне значення циклу Кребса та функції ланцюга транспортного ланцюга у впливах кетонових тіл.
Незрілі та розвиваються нейрони
Антиоксидантний ефект
Кетонові тіла також можуть мати антиоксидантну дію. Виробництво активних форм кисню, спричинене впливом глутамату, пригнічується кетоновими тілами у первинних культурах нейрокортикальних нейронів щурів (Maalouf et al. 2007). Здається, механізм включає окислення NADH, а не опосередкований глутатіоном антиоксидантний ефект. І навпаки, кетогенна дієта (а не кетонові тіла) може змінити метаболізм глутатіону через фактор транскрипції Nrf2 (Milder et al. 2010). Кетонові тіла також захищають від загибелі клітин після впливу на зрізи неокортикалу перекисом водню (Kim do et al. 2007). Крім того, кетонові тіла запобігають індукованому перекисом водню погіршенню довготривалого потенціювання гіпокампа (Maalouf & Rho 2008). Отже, на додаток до впливу на нейромедіацію, ці дані свідчать про те, що кетонові тіла можуть бути нейропротекторними щодо активних форм кисню, що утворюються в невропатологічних станах.
Висновки
Можливі протисудомні ефекти кетонових тіл на мозок. (1) Збільшений синтез ГАМК за рахунок зміни циклу глутамату в циклі глутамат-глутаміну або зміною реакції нейронів на ГАМК у рецепторах ГАМК. (2) Зниження вивільнення глутамату шляхом конкурентного інгібування везикулярних транспортерів глутамату. (3) Інші нейромедіатори, включаючи норадреналін та аденозин. (4) Підвищена гіперполяризація мембранного потенціалу через канали KATP, можливо, опосередкована передачею сигналів рецептора GABAB. (5) Зменшення виробництва активних форм кисню внаслідок впливу глутамату. (6) Транскрипція субодиниці електронного транспортного ланцюга. Скорочення: A1R, аденозиновий рецептор; Cl, хлорид; GLN, глутамін; ГЛУ, глутамат; ГАМК, γ-аміномасляна кислота; GABABR, бета-рецептор γ-аміномасляної кислоти; ГАМКАР, альфа-рецептор γ-аміномасляної кислоти; VGLUT, везикулярний транспортер глутамату; АФК, активні форми кисню.
Подяка
За підтримки Програми наукових співробітників медичного інституту Говарда Хьюза (MAM), K12NS001696, K08NS070931 та премії вченого клініциста (Медична школа Університету Джона Хопкінса) (ALH). Автори не мають конфлікту інтересів для розголошення.
- Як наші тіла протистоять схудненню
- Кето-дієта при епілепсії Що потрібно знати WTOP
- СУЧАСНЕ ЛІКУВАННЯ НАРКОТЕЙКОЇ ЕПІЛЕПСІЇ, ДОСТУПНОЇ У РОСІЙСЬКОЇ АЙВАЗЯНСЬКОЇ Епілепсії та пароксизмальної
- Як елітні артисти балету заправляють свої тіла між виставами - Business Live
- Важливі дієтичні втручання для лікування епілепсії FX