Інтерлейкін-6 індукує втрату жиру при кахексії раку, сприяючи ліполізу і побурінню білої жирової тканини
Анотація
Передумови
Кахексія раку - це прогресуючий та багатофакторний метаболічний синдром, що характеризується втратою жирової тканини та скелетних м’язів. Пропонується ліполіз білої жирової тканини (WAT) та трансдиференціація білого до коричневого кольору WAT (підрум’янення WAT), що сприяє атрофії WAT при кахексії раку. Повідомлялося, що хронічне запалення, опосередковане цитокінами, такими як фактор некрозу пухлини альфа (TNF-α) та інтерлейкін-6 (IL-6), сприяє кахексії раку. Однак чи сприяє хронічне запалення раковій кахексії, регулюючи метаболізм WAT та основний механізм залишається незрозумілим.
Методи
У цьому дослідженні ми вперше проаналізували зв'язок між хронічним запаленням та метаболізмом ВАТ у кахектичних хворих на рак шлунку та колоректального раку. У кахектичних мишей, які отримували антитіла до рецептора IL-6, ми з’ясували, чи регулюється IL-6 ліполіз та побуріння WAT.
Результати
Клінічні аналізи показали позитивний значущий зв'язок між сироватковим IL-6 та вільними жирними кислотами (FFA) як на ранній, так і на пізній стадії кахексії раку. Однак TNF-α у сироватці крові позитивно асоціювався з FFA у сироватці крові на ранній, але не на пізній стадії кахексії. WAT-ліполіз був збільшений на ранній та пізній стадії кахексії, тоді як підрум'янення WAT було виявлено лише на пізній стадії кахексії. Антитіло до IL-6-рецептора пригнічувало WAT-ліполіз та побуріння у кахектичних мишей.
Висновки
На основі цих висновків ми робимо висновок, що хронічне запалення (особливо те, що опосередковується IL-6) може сприяти кахексії раку шляхом регулювання ліполізу WAT на ранній стадії кахексії та побуріння на пізній стадії кахексії.
Передумови
Кахексія раку - це синдром марнотратства, що визначається постійною втратою скелетних м’язів та жирової маси, яку неможливо повністю повернути за допомогою звичайної харчової підтримки [1]. Кахексія раку зустрічається приблизно у 80% онкологічних хворих і є основною причиною смерті у 22–30% усіх онкологічних хворих [2, 3]. Кахексія раку значно знижує толерантність до протипухлинної терапії та знижує якість життя [4, 5]. Однак у хворих на рак зазвичай не діагностують кахексію, поки вони не втратять більше 5–7% маси тіла через відсутність ефективних маркерів раннього виявлення [6]. Тому існує гостра необхідність зрозуміти основні механізми ракової кахексії, щоб проінформувати про розробку нових діагностичних та терапевтичних цілей.
Хоча втрата м’язів є ознакою ракової кахексії, основний катаболічний драйвер кахексії раку включає не лише протеолітичний розпад скорочувальних м’язових білків. Виснаження жирової тканини також сприяє руйнівному впливу ракової кахексії [7]. Як повідомляється, втрата жирової тканини пов’язана зі зниженням якості життя та коротким виживанням, незалежно від індексу маси тіла (ІМТ) у хворих на рак, що прогресують [8, 9]. Посилений ліполіз і окислення жиру, знижений ліпогенез, порушення відкладення ліпідів і адипогенезу, а також побуріння білої жирової тканини (ВАТ) можуть бути основою атрофії жирової тканини при кахексії раку [10].
Хронічне запалення, яке опосередковується інтерлейкіном-6 (IL-6) та фактором некрозу пухлини альфа (TNF-α), широко досліджувалось як важливий регулятор втрати жиру при раковій кахексії [3, 10]. Однак зв’язок між запальними цитокінами та ліполізом WAT та побурінням у кахектичних пацієнтів також рідко повідомляється. Чи сприяють запальні цитокіни зниженню жирової тканини при раковій кахексії, прискорюючи ліполіз та коричневіння ВАТ, залишається незрозумілим.
У цьому дослідженні ми виявили WAT-ліполіз та побуріння у підшкірній WAT кахектичних пацієнтів із раком шлунка та прямої кишки. Взаємозв'язок між запальними цитокінами та ліполізом WAT та побурінням також аналізувались у кахектичних пацієнтів. Вплив IL-6 на WAT-ліполіз та побуріння аналізували на кахектичних мишах.
Методи
Пацієнти та збір проб
Підшкірні ВАТ збирали під час хірургічного втручання у пацієнтів з раком шлунка та прямої кишки в лікарні Чжуншань університету Фудань протягом 1 січня 2014 року по 31 грудня 2016 року. Діагнози злоякісного захворювання підтверджувались післяопераційними патологічними дослідженнями. Критерії виключення були такими: 1) пацієнт віком 10% за останні 6 місяців.
Підшкірні ВАТ розрізали на половинки, і один шматок негайно заморозили в рідкому азоті і зберігали при -80 ° С до подальшого аналізу, тоді як іншу половину фіксували в 10% формаліні і вкладали в парафін. Зразки крові всіх пацієнтів відбирали перед операцією та негайно центрифугували при 3000 об/хв протягом 15 хв при 4 ° C. Зразки сироватки зберігали при -80 ° C для подальшого аналізу. Були записані клінічні характеристики кожного пацієнта до операції, включаючи вік, стать та ІМТ.
Експериментальна модель кахексії та методи лікування
Мишей-самців BALB/c (віком 6–8 тижнів) вагою 16–20 г придбали у Шанхайському лабораторному центрі тварин при Китайській академії наук. Мишей утримували при 22 ± 1 ° C з 12-годинним циклом світло/темрява і мали вільний доступ до води та звичайної дієти. Мишей акліматизували в навколишньому середовищі за 1 тиждень до початку дослідження. Всі маніпуляції з тваринами проводились відповідно до керівних принципів та правил використання експериментальних тварин Китайською академією наук. Всі зусилля були зроблені для мінімізації страждань тварин і використання лише тієї кількості тварин, яка необхідна для отримання надійних наукових даних.
Клітини ободової кишки 26/клону 20, які, як повідомляється, індукують сильну кахексію у мишей BALB/c шляхом підшкірного посіву, культивували в Меморіальному інституті Розуелл Парк (RPMI) -1640, доповненому 5% плодовою бичачою сироваткою та 1% пеніцилін-стрептоміцином при 37 ° C у 5% CO2. Мишей випадковим чином розподіляли до трьох експериментальних груп: контрольної групи, групи, що несе пухлину Colon 26, та антитіл до рецепторів проти IL-6 (eBiosciences, CA, USA), які отримували пухлину. У дослідний день 0, 1,0 × 10 6 клітин, суспендованих у 100 мкл забуференного фосфатом сольового розчину (PBS), вводили підшкірно в праву пахву мишей у групі, яка обробляла пухлини та антитіла до рецепторів проти IL-6. В контрольну групу вводили рівний об’єм PBS без пухлинних клітин. У групі, яка отримувала антитіла до рецепторів IL-6, кожна миша отримувала інтраперитонеальну ін’єкцію 10 мкг моноклонального антитіла до рецептора IL-6, розведеного в 200 мкл фізіологічного розчину кожні 2 дні. Контрольна група та групи, що несуть пухлину, отримували 200 мкл PBS. На 16 день мишей забивали через вивих шийки матки. Збирали та зважували підшкірну пахову та епідидимальну ВАТ, міжлопаткову БАТ та шлунково-м’язовий м’яз. Зразки розрізали на половинки, обробили та зберігали, як це було зроблено з людськими зразками ВАТ.
Імуногістохімія та морфологічний аналіз
Підшкірні ВАТ людини та миші, вбудовані в парафін, розрізали на ділянки по 5 мкм. Імунозабарвлення UCP1 всіх тканин проводили, як описано раніше [19]. Коротко, предметні стекла зневоднювали у сортових спиртах та ксилолі. Визначення антигену проводили 0,01 М цитратним буфером при 95 ° С протягом 20 хв при рН 6,0. Слайди інкубували з розведеними первинними антитілами (анти-UCP1, розведення 1: 100) протягом 12 годин. Потім предметні стекла інкубували з біотинільованим вторинним антитілом протягом 1 год, міченим пероксидазою стрептавідином протягом 15 хв, а також підкладкою діамінобензидину та перекису водню хромогену та підсилювачем діамінобензидину протягом 10 хв з наступним фарбуванням гематоксиліном Майєра. Зображення отримували за допомогою об'єктива × 40. Розміри адипоцитів WAT були відстежені та визначені кількісно за допомогою програмного забезпечення ImageJ.
ПЛР-аналіз у реальному часі
Загальну РНК виділяли з підшкірної ВАТ людини та миші за допомогою реагенту TRIzol (Invitrogen, Каліфорнія, США) відповідно до рекомендацій виробника. Концентрації РНК визначали кількісно за допомогою спектрофотометра NanoDrop 2000, а цілісність визначали за допомогою гель-електрофорезу. Комплементарну ДНК синтезували з 1 мкг загальної РНК за допомогою набору для синтезу кДНК (Takara, Далянь, Японія) за протоколами виробника. Аналіз експресії генів проводили за допомогою основного сумішу PrimeScript RT (Takara, Далянь, Японія) в системі реального часу StepOnePlus (Applied Biosystems, CA, USA). Відносні рівні експресії генів розраховували за допомогою 2 -Ct і порівнювали з 18sRNA як внутрішній контроль. Використовувані праймери наведені в таблиці 1.
Визначення сироватки
Концентрації альбуміну, тригліцеридів та вільних жирних кислот у сироватці крові людини визначали у лабораторному відділенні лікарні Чжуншань університету Фудань за допомогою комерційних ферментативних наборів. Концентрації IL-6 та TNF-α у сироватці крові оцінювали за допомогою набору імуноферментного аналізу IL-6 та TNF-α (ELISA) згідно з протоколами виробника.
Вестерн-блот-аналіз
Приготування лізатів загального білка та аналіз вестерн-блот проводили, як описано раніше [19]. Використовували первинні антитіла (розведення 1: 1000) проти Cgi58 і Tbx1 (Abcam, Великобританія). Експресія тубуліну використовувалась як ендогенний контроль.
Статистичний аналіз
Результати виражаються як середнє значення ± стандартна похибка середнього значення (м.д.). Рівні мРНК відповідних генів порівнювали між групами з двостороннім Стьюдентом т тест. Кореляції сироваткової FFA з IL-6 та TNF-α при ранній та пізній стадії кахексії аналізували за допомогою кореляційних тестів Спірмена. Весь статистичний аналіз проводили за допомогою GraphPad Prism 5.0. Статистичну значимість визначали як P
Результати
Клінічна характеристика пацієнтів та зв'язок між запальними цитокінами та ліполізом WAT
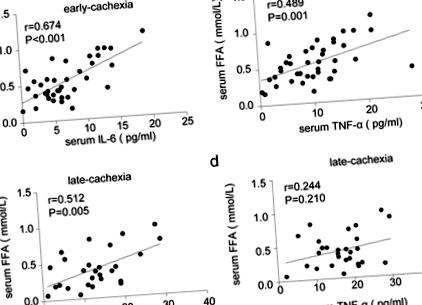
Спочатку ми порівняли клінічні характеристики різних груп пацієнтів у дослідженні. Як показано в таблиці 2, концентрація IL-6 у сироватці крові була вищою у пацієнтів із пізньою стадією кахексії, ніж у тих, хто не мав кахексії та ранньої стадії кахексії. Цікаво, що концентрація TNF-α у сироватці крові була підвищена лише при пізній стадії кахексії. Крім того, сироватковий альбумін та ІМТ значно зменшувались у пацієнтів з кахектичною хворобою на пізніх стадіях. Хоча між трьома групами не було відмінностей у вмісті тригліцеридів у сироватці крові, концентрація FFA у сироватці крові була значно підвищена у кахектичних пацієнтів, особливо на ранній стадії кахексії. Кореляційний аналіз показав достовірно позитивну зв'язок між сироватковим IL-6 та FFA як на ранній, так і на пізній стадії кахексії (рис. 1). Однак сироватковий TNF-α позитивно асоціювався лише з FFA у сироватці крові на ранній, але не на пізній стадії кахексії (рис. 1).
Зв'язок між запальними цитокінами сироватки крові та ліполізом WAT у кахектичних пацієнтів. a Кореляційний аналіз між сироваткою IL-6 та FFA при ранній стадії кахексії (n = 40). b Кореляційний аналіз між TNF-α та FFA у сироватці крові на ранній стадії кахексії (n = 40). c Кореляційний аналіз між сироваткою IL-6 та FFA при пізній стадії кахексії (n = 28). d Кореляційний аналіз між TNF-α та FFA у сироватці крові на пізній стадії кахексії (n = 28)
Ліполіз WAT збільшився як на ранній, так і на пізній стадії кахексії, тоді як підрум'янення WAT було виявлено лише на пізній стадії кахексії
Щоб визначити, чи піддається підшкірній ВАТ людини ліполіз та побуріння, ми досліджували морфологію WAT та експресію UCP1 у підшкірній ВАТ різних груп пацієнтів. У кахектичних спостерігалась очевидна атрофія ВАТ порівняно з некахектичними пацієнтами (рис. 2а). Однак суттєвої різниці у розмірах адипоцитів не виявлено між ранньою та пізньою стадією кахексії раку (рис. 2b). Цікаво, що гени, пов'язані з ліполізом WAT (Atgl, Cgi58, і Hsl) були підвищеними в ранній, але не пізній стадії кахексії (рис. 2в).
Щоб визначити, чи відбулося коричневе забарвлення ВАТ у кахектичних пацієнтів, ми виявили регульовану мРНК UCP1 у пацієнтів із пізньою стадією ракової кахексії порівняно з іншими двома групами (рис. 2в). Імуногістохімія також підтвердила високу експресію білка UCP1 при пізній стадії кахексії раку (рис. 2а). Ми також виявили класичні «бежеві клітини», які характеризувались як UCP1-позитивні та морфологічно за рахунок багатолокулярних відкладень ліпідів, у 6 з 28 кахектичних пацієнтів на пізній стадії. Щоб підтвердити наявність коричневого та коричневого відтінків WAT, ми дослідили кілька встановлених маркерів, пов’язаних з коричневим та бежевим жиром, у підшкірному WAT. Цікаво, що гени, пов’язані з бежевим жиром (Tmem26 і Tbx1), але не гени, пов’язані з коричневим жиром (Єва1 і PDK4) були підвищеними в пацієнтів з пізньою стадією кахексії (рис. 2а).
Крім того, ми виявили значно підвищену концентрацію IL-6 та TNF-α у сироватці крові у 6 пацієнтів із порівняно з 22 пацієнтами без бежевих жирових клітин (дані не наведені), що вказує на те, що IL-6 та TNF-α можуть бути пов’язані з потемнінням WAT.
Антитіло до IL-6-рецептора пригнічувало WAT-ліполіз та побуріння у кахектичних мишей
Обговорення
Ключовою особливістю ракової кахексії є втрата ВАТ через посилений ліполіз адипоцитів та інших механізмів. Враховуючи, що FFA в сироватці крові в основному походить від ліполізу WAT, ми спочатку вивчили зміни рівня FFA у сироватці крові у кахектичних пацієнтів. Цікаво, що рівень FFA у сироватці крові був вищим на ранній, ніж на пізній стадії кахексії, що вказує на те, що WAT-ліполіз може бути домінуючим механізмом при ранній стадії кахексії раку.
Незважаючи на посилений ліполіз WAT, коричневе забарвлення WAT пропонується ще одним фактором, що сприяє атрофії WAT під час кахексії раку [10]. У цьому дослідженні ми вперше повідомляємо про появу забарвлення ВАТ при пізній, але не на ранній стадії ракової кахексії у людей. Результати припускають, що підрум'янення ВАТ може бути кінцевим явищем, яке прискорює атрофію ВАТ при пізній стадії ракової кахексії.
Добре встановлено, що існує зв'язок між кахексією та системним запаленням. Однак механізми та наслідки цієї запальної реакції не ясні. Прозапальні цитокіни (наприклад, TNF-α та IL-6), що утворюються пухлиною або тканиною хазяїна через наявність пухлини, призводять до як системного, так і місцевого запалення при раку [20, 21]. Однак дані про місцеве запалення жирової тканини при раку є суперечливими, повідомляється як про збільшення чи незмінення [22, 23]. Існують також суперечливі результати щодо того, чи підвищений рівень TNF-α у онкологічних хворих із втратою ваги [3]. Випробування антитіл до TNF-α у пацієнтів з раковою кахексією також не показало жодної користі [24]. У нашому дослідженні сироватковий TNF-α збільшувався із зменшенням маси тіла. Однак сироватковий TNF-α позитивно асоціювався з FFA у сироватці крові при ранній, але не пізній стадії кахексії раку, що припускає, що TNF-α може пришвидшити WAT-ліполіз при ранній стадії кахексії раку, зменшивши ефект при пізній стадії кахексії.
На відміну від TNF-α, показано, що рівні циркуляції IL-6 корелюють із втратою ваги у хворих на рак, і що важливо, рівні IL-6 корелюють із зниженою виживаністю [3]. Ми також виявили позитивну зв'язок між сироватковим IL-6 та FFA як на ранній, так і на пізній стадії кахексії, припускаючи, що IL-6 може спричинити втрату ваги при раковій кахексії шляхом прискорення WAT-ліполізу. Однак випробування моноклональних антитіл проти IL-6 у хворих на рак легенів, що втрачають вагу, не показали значного впливу на втрату худої маси тіла [25]. Отже, чи впливає IL-6-індукована втрата ваги при раковій кахексії переважно через ВАТ, але не втрата м’язів потребує подальшого вивчення.
У кількох дослідженнях повідомляється про появу коричневого забарвлення ВАТ на мишачих моделях кахексії раку [18, 26]. Однак чи залишається підрум'янення ВАТ у кахектичних хворих на рак шлунка та прямої кишки, залишається незрозумілим. У цьому дослідженні ми виявили класичні бежеві клітини лише у 6 пацієнтів з пізньою стадією кахексії. Наскільки нам відомо, це перша доповідь про наявність коричневого відтінку ВАТ у великій вибірці хворих на рак шлунка та прямої кишки. Наші результати показують, що коричневе забарвлення ВАТ може не бути загальним явищем у пацієнтів з раковою кахексією. Ми також виявили, що концентрація IL-6 та TNF-α у сироватці крові суттєво підвищена у 6 пацієнтів порівняно з 22 пацієнтами без бежевих жирових клітин, що вказує на те, що IL-6 та TNF-α можуть прискорити забарвлення ВАТ.
Вважається, що втрата жиру, що спостерігається у кахектичних пацієнтів, відбувається внаслідок розпаду жирової тканини (переважно ВАТ) [13]. При раковій кахексії ліполіз та втрата ліпідів можуть відбуватися до певної міри до втрати м’язів [27]. Відповідно до висновків на мишачій моделі раку товстої кишки, яка продемонструвала збільшення опосередкованого протеїнкіназою-А ліполізу на ранній стадії кахексії [28], ми також виявили регульовані гени, пов’язані з WAT-ліполізом, на ранній стадії кахексії раку. Гени, пов'язані з WAT-ліполізом, не регулювались у пізній стадії кахексії, що може пояснити нижчий рівень FFA в пізній стадії порівняно з ранньою стадією кахексії.
Останні дані дозволяють припустити, що існує два різних типи коричневого жиру: класична BAT, отримана з клітин лінії міогенного фактора 5 (myf-5), та позитивні клітини UCP1, які називаються бежевими адипоцитами, що виділяються в білому жирі з лінії, що не стосується myf-5 [ 29, 30]. Колись вважалося, що НДТ присутній лише у гризунів та новонароджених [31]. Однак високо метаболічно активну BAT було виявлено у дорослих людей за допомогою позитронно-емісійного томографічного та комп’ютерного томографічного сканування (PET/CT) [32, 33]. Недавні дані свідчать про те, що BAT людини складаються переважно з бежевих адипоцитів, що вказує на підрум’янення WAT у дорослих людей [11, 34]. У нашому дослідженні маркери бежевих адипоцитів характеризували UCP1-позитивні клітини, виявлені у пізніх кахектичних пацієнтів. Хоча як бежеві, так і коричневі асоційовані з жирами гени були підвищено регульовані у кахектичних мишей, маркери бежевих адипоцитів були значно вищими, ніж маркери коричневих адипоцитів. У сукупності UCP1-позитивні клітини, виявлені в WAT, як у хворих на кахектичний рак, так і у мишей, були бежевими адипоцитами.
У кахектичних мишей раку ми виявили, що інгібування IL-6 суттєво зберігає вагу пахової та епідидимальної ВАТ. Однак ваги BAT та м'язів не суттєво збереглися при інгібуванні IL-6. Ці висновки у поєднанні з пригніченням ліполізу WAT та пов'язаних з побурінням генів у паховій WAT мишей, які отримували антитіла до рецепторів IL-6, дозволяють припустити, що IL-6 може індукувати пахову атрофію WAT, прискорюючи WAT-ліполіз та побуріння. Однак чи існує цей запропонований механізм у людей, потребує подальшого дослідження.
Висновок
Наші результати дають прямі підтверджуючі докази щодо появи коричневого відтінку ВАТ у хворих на кахектичний рак шлунка та прямої кишки. Ми також припускаємо, що IL-6 може індукувати атрофію WAT під час кахексії раку, прискорюючи WAT-ліполіз та побуріння. Ці дані дозволяють припустити, що інгібування IL-6 може бути перспективним підходом для покращення втрати жиру при раковій кахексії, принаймні для хворих на рак шлунка та прямої кишки.
- Навмисне схуднення та ризик раку ніколи не пізно позбутися ваги JNCI Раковий спектр Оксфорд
- Симптом раку легенів Втрата ваги може бути ознакою цього поширеного раку
- Як кава протидіє дії конопель, викликає втрату ваги The Guardian Nigeria News - Нігерія
- У мого зимового білого хом'ячка випадає волосся, животик і він смішно ходить. Його хутро втратив блиск
- Моя дивовижна подорож до схуднення, яка схудла на 117 фунтів хіропрактики з білого дуба