Індукований ожирінням колоректальний рак обумовлений калорійним приглушенням паракринної сигнальної осі гуанілін-GUCY2C
Йєру Е. Лін
1 Кафедра фармакології та експериментальної терапії, Відділ клінічної фармакології, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Франческа Колон-Гонсалес
1 Кафедра фармакології та експериментальної терапії, Відділ клінічної фармакології, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Ерік Бломен
1 Кафедра фармакології та експериментальної терапії, Відділ клінічної фармакології, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Гілберт В. Кім
1 Кафедра фармакології та експериментальної терапії, Відділ клінічної фармакології, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Аманда Айнг
1 Кафедра фармакології та експериментальної терапії, Відділ клінічної фармакології, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Брайан Стокер
1 Кафедра фармакології та експериментальної терапії, Відділ клінічної фармакології, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Джастін Рок
1 Кафедра фармакології та експериментальної терапії, Відділ клінічної фармакології, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Адам Е. Снук
1 Кафедра фармакології та експериментальної терапії, Відділ клінічної фармакології, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Тингтінг Чжан
2 Кафедра фармакології та експериментальної терапії, Відділ біостатистики, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Террі М. Гіслоп
3 Кафедра біостатистики та біоінформатики Університету Дьюка, Дарем, штат Північна Кароліна
Міхал Томчак
4 Відділ гастроентерології, гепатології та ендоскопії та Інститут біомедичних досліджень, Бригама та жіноча лікарня та Гарвардський центр травних захворювань, Гарвардська медична школа, Бостон, Массачусетс
Річард С. Блюмберг
4 Відділ гастроентерології, гепатології та ендоскопії та Інститут біомедичних досліджень, Бригама та жіноча лікарня та Гарвардський центр травних захворювань, Гарвардська медична школа, Бостон, Массачусетс
Скотт А. Вальдман
1 Кафедра фармакології та експериментальної терапії, Відділ клінічної фармакології, Університет Томаса Джефферсона, Філадельфія, Пенсильванія
Пов’язані дані
Анотація
Вступ
Матеріали і методи
Тваринні моделі
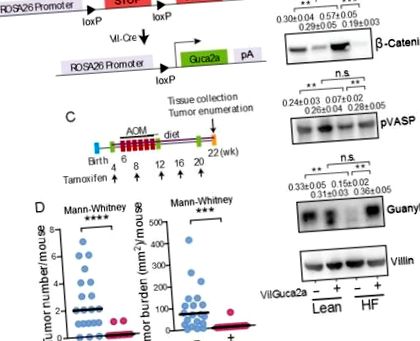
(А) Конструкція для трансгенної експресії гуаніліну в кишечнику. Трансгенна експресія гуаніліну (B) врятувала сигнал GUCY2C, що зменшує дисфункцію епітелію, спричинену ВЧ-дієтою, та (C-D) майже повністю усуває пухлину, індуковану ВЧ-дієтою та AOM у товстій кишці VilGuca2a +, але не контролює VilGuca2a-, мишей. Результати імуноблоту представляють середнє значення ± SEM 5 мишей. VilGuca2a (-), миші C57BL/6, що експресують vil-Cre-ER T2 (дикий тип гуаніліну); VilGuca2a (+), миші C57BL/6, що експресують vil-Cre-ER T2 і несуть трансгенний гуанілін.
Генотипування
Генотип Gucy2c був підтверджений за допомогою ПЛР з праймерами: прямий: 5'-AGGTCATGACGTCACTGCTGGGCC-3 '; реверс: 5'-TGTCCAGTCCTTCCTCCACAG-3 '; неоміцин: 5'-GGTGGGCTCTATGGCTTC-3 '(7). Генотип ROSA-STOP flox -Guca2a підтверджено за допомогою ПЛР з праймерами: вперед: 5'-CCGCCGTTGTTGTTATTGTAG-3 '; реверс: 5'-GTTGTGGTG ATAGGTGGCAAG-3 '. Генотип Villin-Cre-ER T2 був підтверджений за допомогою ПЛР з праймерами: вперед: 5'-GAAAATGCTTCTGTCCGTTTG-3 '; реверс: 5'-ATTGCTGTCACTTGGTCGTG-3 '(9).
Модель колоректального туморогенезу
Для мишей Gucy2c +/+ (Lean, HF) та Gucy2c -/- (Lean) мишам (6 тижнів у віці) азоксиметан (AOM 8 мг/кг; Sigma, Сент-Луїс) вводили щотижня через інтраперитонеальні ін’єкції протягом 6 тижнів. Перераховували пухлини та визначали їх розміри через 8 тижнів після останньої дози АОМ під розсікаючим стереомікроскопом шляхом сліпого аналізу. Навантаження на пухлину на тварину обчислювали як суму площі (діаметр 2) окремих пухлин (7). Для моделі ROSA-STOP flox -Guca2a-vil-Cre-ER T2 та відповідних контролів (рис. 4в) миші сиділи на ВЧ дієті, починаючи з 4 тижнів віку. Тамоксифен (20 мг/кг в/в) вводили кожні 4 тижні для посилення експресії гуаніліну, починаючи з 4 тижнів до перерахування пухлини. Шість доз AOM (10 мг/кг) вводили щотижня, починаючи з 5 тижнів. Перераховували пухлини та визначали їх розміри кількісно у віці 22 тижнів (6, 7). Для мишей Gucy2c +/+ (нежирних, HC) мишам (віком 6 тижнів) вводили AOM (12 мг/кг) щотижня протягом 6 тижнів. Перераховували пухлини та визначали їх розміри в кількісних показниках 12 тижнів після останньої дози AOM. Дози AOM в різних моделях дієти були встановлені в пілотних дослідженнях, щоб забезпечити принаймні
50% захворюваності на пухлину в експериментальних когортах.
Тканини людини
Зразки слизової оболонки товстої кишки людини отримували у пацієнтів, які перенесли хірургічне втручання за протоколом, затвердженим Інституційною комісією університету Томаса Джефферсона (контрольний номер 01.0823).
Культура клітин та лентивірусна інфекція
Підготовка тканин
Слизові шари дистальних відділів товстої кишки миші негайно заморожували в рідкому азоті і зберігали при -80 ° C до аналізу білка або РНК. Для імунозабарвлення зразки фіксували на ніч у 4% формальдегіді при 4 ° C, зневоднювали через ряд сортових промивних ацетону та етанолу та вносили у парафін (6, 7). Парафінові зрізи (5 мкм) були змонтовані (5 зрізів/предметне скло/миша) для імуногістохімічного або імунофлюоресцентного фарбування (7).
РНК-аналіз
Загальну РНК виділяли за допомогою RNeasy Mini Kit (Qiagen, каталог № 74104) відповідно до вказівок виробника. Двоступеневу RT-PCR проводили з використанням реагентів зворотної транскрипції TaqMan ® (Life Technologies, № за каталогом N8080234) та універсальної суміші TaqMan ® (Life Technologies, № за каталогом 4440038) для проведення кількісної RT-PCR за допомогою праймера/зонда GUCA2A для Аналізи експресії генів TaqMan ® (Mm00433863_m1, Hs 00157859_m1) в системі виявлення послідовності ABI 7000 (Прикладні біосистеми) (7, 12). Відносний вираз обчислювали за допомогою методу 2 ΔΔCT із використанням villin1 (Life Technologies, Mm00494146_m1, Hs00200229_m1) як внутрішнього контролю (9).
Імунозабарвлення та імунофлюоресценція
Імуноблот-аналізи
Білок екстрагували та гомогенізували в реагенті M-PER (Thermo Fisher Scientific, каталог No 78501), доповненому інгібіторами протеази та фосфатази (Roche Applied Science, № 05892970001 та 04906837001), а потім піддавали SDS-PAGE та імуноблотингу з використанням антитіл як наступні: актин (Cell Signaling, 4967S), Bip (Cell Signaling, 3177S), β-катенін (Cell Signaling, 8480S), CHOP (Cell Signaling, 2895S), циклін D1 (Cell Signaling, 2978S), eIF2α (Cell Signaling, 9722S), GUCA2A (LSBio, LS-C3244, LS-C166741), гексокіназа II (сигналізація клітин, 2106S), фосфо-AKT (сигналізація клітин, 9271S), фосфо-eIF2α (сигналізація клітин, 3597S), γ-H2AX Signaling, 2577S), Phospho-VASP (Cell Signaling, 3114S), villlin-1 (Cell Signaling, 2369S). Вторинні антитіла були від Santa Cruz Biotechnology. Інтенсивність фарбування специфічних смуг, кількісно визначених за допомогою денситометрії (Kodak), була нормалізована до інтенсивності для вілліну-1. Імунокомплекси були виявлені субстратом SuperSignal West Dura (Thermo Fisher Scientific, № 37071). Середня відносна інтенсивність відображає середнє значення 5
15 окремих тварин на когорту або ≥3 незалежних експерименти з клітинами.
Криві зростання та споживання їжі
П'ять мишей розміщувались разом, кожну мишу зважували щотижня, і слідкували принаймні 20 мишей з кожної когорти. В експерименті з обмеженою дієтою, обмеженого вмістом, 3 мишей утримували разом і зважували 6 мишей з кожної когорти. Для прийому їжі мишей розділяли в окремі клітини з сітчастим підлогою і давали попередньо зважену кількість чау щодня. Всім мишам надавали вільний доступ до води протягом експерименту. Споживання їжі вимірювали щодня протягом 7 днів, щоб встановити середнє споживання їжі.
Статистичний аналіз
(А) ІРНК гуаніліну в товстій кишці людини обернено корелює з ІМТ. (B) ІРНК гуаніліну в товстій кишці від мишей на дієтах з високим вмістом жиру (HF) або пісних. (В) Втрата гуаніліну у мишей на ВЧ дієті пригнічує GUCY2C, посилюючи дисфункцію епітелію. (D) Гуанілін (зелений), β-катенін (червоний) та (E) Ki67 у товстій кишці мишей на нежирних та СН-дієтах. (F) Порівнювали дисфункцію епітелію у мишей дикого типу GUCY2C (+/+) та дефіцитних (-/-) мишей на дієтах з низьким та низьким рівнем здоров'я. (G) Кількість пухлини та (H) навантаження у мишей GUCY2C (+/+) та (-/-) на нежирній або ВЧ дієті, які отримують AOM. Результати імуноблоту представляють середнє значення ± SEM 5 мишей.
Встановлена парадигма припускає, що туморогенез, пов'язаний з ожирінням, спричиненим дієтою, відображає перепрограмування ендокринної, адипокінової та запальної середовища (14-16). Однак дієта з високим вмістом вуглеводів (HC), яка збільшує споживання калорій
(A) Дієти з високим вмістом вуглеводів (HC) та HF пригнічували мРНК гуаніліну в товстій кишці. (B) Дієта HC зменшувала передачу сигналів гуаніліну та GUCY2C, посилюючи дисфункцію епітелію. (C) Миші, які харчуються HC, порівняно з нежирною дієтою, є більш чутливими до індукованого AOM пухлини товстої кишки. (D) ВЧ дієта знижувала передачу сигналів гуаніліну та GUCY2C, посилюючи дисфункцію епітелію, у мишей, стійких до ожиріння, спричиненого дієтою (HF-R). (E) ob/ob на дієті з обмеженим вмістом калорій (10 Ккал/добу на мишу) підтримувала експресію гуаніліну та сигналізацію GUCY2C, без дисфункції епітелію. (F) Дієтичний вплив на експресію гуаніліну, передачу сигналів GUCY2C та дисфункцію епітелію було скасовано шляхом переведення мишей на ВЧ-дієту протягом 20 тижнів на нежирну дієту на 4 тижні (HF-Lean). Результати імуноблоту представляють середнє значення ± SEM 5 мишей.
(A) Висококалорійні дієти викликали транскрипцію (A) та трансляцію (B) маркерів стресу ER у товстій кишці у мишей C57BL/6. (C-D) ER-стрес, індукований 2,5 мкг/мл тунікаміцину (TM) або 500 нМ тапсигаргіну (TSG), збільшував маркери стресу ER і пригнічував гуанілін у клітинах Caco2. (E-F) Введення 1 мг/кг ТМ мишам C57BL/6 підвищувало маркери стресу ER та пригнічувало експресію гуаніліну в товстій кишці. (G-H) Товста кишка мишей Xbp1 ΔIEC демонструвала знижену експресію гуаніліну (зеленого кольору) порівняно з мишами дикого типу (Xpb fl/fl) [β-катенін (червоний)]. (I-J) TUDCA (150 мг/кг перорально через 12 днів) знімав стрес ER та врятував експресію гуаніліну у мишей C57BL/6 на ВЧ-дієті. (K) Інгібування PERK GSK2606414 знімало стрес ER і відновлювало експресію гуаніліну в клітинах Caco2, оброблених TM. (L) PERK siRNA відновила експресію гуаніліну в клітинах HEK 293, оброблених 1,0 мкг/мл ТМ. Результати in vitro представляють середнє значення ± SEM трьох незалежних експериментів, проведених у трьох примірниках. Результати in vivo представляють середнє значення ± SEM 5 мишей, якщо не вказано інше.
Дані спостереження свідчать про те, що пухлина кишечника, пов’язана із ожирінням, відображає пригнічення експресії гуаніліну, яке пригнічує супресор пухлини GUCY2C шляхом оборотної калорійно-залежної індукції стресу ER та розгорнутої білкової реакції в епітеліальних клітинах товстої кишки. Ця гіпотеза була безпосередньо перевірена із використанням генетичної моделі миші, при якій посилена експресія гуаніліну селективно індукується в клітинах епітелію кишечника (рис. 4А) (7). Індукція експресії трансгенного гуаніліну подолала ендогенну супресію гуаніліну та приглушення GUCY2C, відновивши фосфорилювання VASP та нормалізуючи рівень β-катеніну у мишей на ВЧ-дієті (рис. 4В). Важливо, що запобігання втраті експресії гуаніліну та підтримка сигналізації GUCY2C (рис. 4C) майже повністю усувають кишковий туморогенез, пов’язаний із ожирінням, спричиненим ВЧ-дієтою (рис. 4D).
Обговорення
- Вчені розкривають, як дієта з високим вмістом жиру сприяє росту раку прямої кишки
- Пульверизовані хромосоми, пов'язані з раком
- Дієта, збагачена ПНЖК, затримує появу ракової кахексії у щурів з перитонеальним канцерозом
- Звукове зцілення могло б допомогти музиці вилікуватися від раку Сайт мого нездорового блогу
- Ожиріння - гірше за рак, що підтримує освіту АКТИВНЕ партнерство для боротьби з хронічними хворобами