Хронічний вплив дієти з високим вмістом жиру викликає порушення мієліну та регуляцію інтерлейкіну-33 в гіпоталамусі
Хуей-Тін Хуан
1 Департамент наук про життя Коледжу біологічних наук та біотехнологій Національного університету Ченг Кунга, Тайнань, Тайвань
Шен-Фен Цай
2 Відділ клітинної біології та анатомії, Інститут фундаментальних медичних наук, Медичний коледж, Національний університет Ченг Кунга, Тайнань, Тайвань
Хун-Цунг Ву
3 Кафедра сімейної медицини, Національна лікарня університету Ченг Кунга, Медичний коледж, Національний університет Ченг Кунг, Тайнань, Тайвань
Сінь-Інь Хуан
4 Інститут біомедичної інженерії та наномедицини, Національний науково-дослідний інститут охорони здоров'я, Жунань, Міаолі, Тайвань
Хан-Хсуе Ся
1 Департамент наук про життя Коледжу біологічних наук та біотехнологій Національного університету Ченг Кунга, Тайнань, Тайвань
Ю-Мін Куо
2 Відділ клітинної біології та анатомії, Інститут фундаментальних медичних наук, Медичний коледж, Національний університет Ченг Кунга, Тайнань, Тайвань
По-Зе Чен
5 кафедра психіатрії, Національна лікарня університету Ченг Кунга, Медичний коледж, Національний університет Ченг Кунг, Тайнань, Тайвань
Чунг-Ши Ян
4 Інститут біомедичної інженерії та наномедицини, Національний науково-дослідний інститут охорони здоров'я, Жунань, Міаолі, Тайвань
Шун-Фен Ценг
1 Департамент наук про життя Коледж біологічних наук та біотехнологій Національного університету Ченг Кунга, Тайнань, Тайвань
Пов’язані дані
Набори даних цього дослідження доступні у відповідного автора за запитом.
Анотація
Передумови
Гіпоталамічне запалення, включаючи астрогліоз та активацію мікроглії, виникає після прийому дієти з високим вмістом жиру (HFD) у моделей гризунів або у людей із ожирінням. Однак ефект хронічного HFD-харчування на олігодендроцити (OLG) - гліальну популяцію мієліну в центральній нервовій системі (ЦНС) - залишається незрозумілим. У цьому дослідженні ми використовували 8-тижневих самців мишей C57BL/6, яких годували HFD протягом 3–6 місяців, щоб викликати хронічне ожиріння.
Результати
Аналіз візуалізації трансмісійної електронної мікроскопії показав, що цілісність гієталамічного мієліну була порушена після годування HFD протягом 4 та 6 місяців. Більше того, накопичення Iba1 + -мікроглії з амебоїдною гіпертрофічною формою постійно спостерігалося в дугоподібному ядрі мишей, що годувались HFD, протягом усього періоду годування. Інтерлейкін-33 (IL-33), тканинний тривожник при пошкодженні ЦНС, був виявлений із підвищеним рівнем у гіпоталамусі після годування HFD протягом 3 та 4 місяців. Крім того, дослідження in vitro показало, що вплив зрілих OLG на IL-33 порушує структуру клітин OLG разом із зниженням експресії основного білка мієліну.
Висновки
Загалом, наші висновки демонструють, що хронічне годування HFD спричиняє порушення гіпоталамічного мієліну, супроводжуючись регуляцією IL-33 та тривалою активацією мікроглії в гіпоталамусі. Враховуючи, що додавання екзогенного IL-33 було шкідливим для дозрівання OLG, збільшення IL-33 при хронічному годуванні HFD може сприяти індукції порушення гієталамічного мієліну.
Електронний додатковий матеріал
Інтернет-версія цієї статті (10.1186/s12868-019-0516-6) містить додаткові матеріали, доступні для авторизованих користувачів.
Передумови
Ожиріння, спричинене надмірним споживанням їжі та недостатніми витратами енергії, стало основним критичним фактором розвитку серцево-судинних захворювань та метаболічного синдрому. Індуковане ожирінням пошкодження нейронів центральної нервової системи (ЦНС) та цілісності гематоенцефалічного бар'єру (ВГБ) збільшує ризик індукції інсульту та хвороби Альцгеймера [1, 2]. З огляду на те, що гіпоталамус відповідає за регулювання споживання їжі та витрат енергії завдяки дії лептину та інсуліну [3], підтримка в гомеостазі функцій нейронів та глій гіпоталамуса є важливою для запобігання розвитку захворювань, пов’язаних із ожирінням.
Запалення низького ступеня в периферичних тканинах осіб із ожирінням було добре розглянуто [4–7]. Запалення гіпоталамуса також зустрічається у генетично модифікованих тваринних моделей ожиріння або тварин з високим вмістом жиру (HFD) [5, 8–10]. Повідомлялося, що збільшення прозапальних цитокінів та хемокінів (тобто IL-1β, TNF-α та IL-6) спостерігалось у гіпоталамусі у гострий (години) та підгострий (тижні) періоди після годування HFD [11, 12]. Відомо, що активація мікроглії та астроцитів, яку називають гліозом, відіграє вирішальну роль у регуляції індукованої HFD резистентності до лептину та інсуліну в компанії з порушенням енергетичного гомеостазу [11–14]. Втрата олігодендроцитів (OLG), гліальної популяції мієліну в центральній нервовій системі (ЦНС), була виявлена в спинному мозку через 7 тижнів після годування HFD [15]. Тим не менше, мало відомо про реакцію гіпоталамусових OLG на хронічне годування HFD.
Метою цього дослідження було вивчення реакції гіпоталамусових OLG на хронічне годування HFD, використовуючи встановлену нами тварину модель метаболічних розладів, годуючи HFD для індукції резистентності до інсуліну та порушення метаболізму ліпідів [16]. Дослідження вперше показало порушення мікроструктури мієліну в задній бічній ділянці гіпоталамуса в пізніші моменти годування HFD. В якості альтернативи інтерлейкін-33 (IL-33) діє як клітинний сигнал тривоги [17], і повідомляється, що IL-33 є критичним фактором для розвитку РС через інгібування мієлінізації ЦНС [18]. Цікаво, що ми виявили, що IL-33 був підвищений в OLG та астроцитах гіпоталамусу після хронічного годування HFD. У поєднанні з нашим дослідженням in vitro, що вплив зрілих OLG на IL-33 спричиняє пошкодження морфології OLG, результати свідчать про те, що порушення мікроструктури мієліну в гіпоталамусі після годування HFD може бути спричинене частково дією молекул IL-33, збільшеною на хронічне годування HFD.
Результати
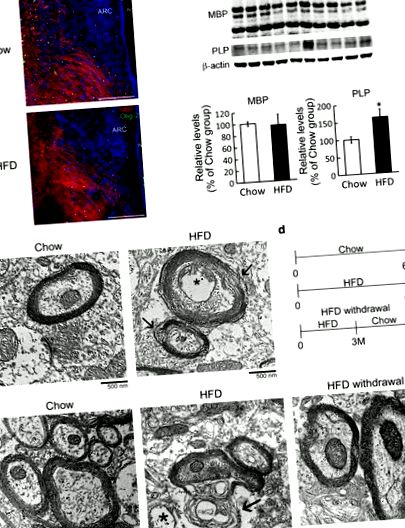
Хронічна зміна мікроструктури гієталамічного мієліну, спричинене годуванням HFD
Порушення структури гієталамічного мієліну, спричинене хронічним годуванням HFD. a Зрізи мозкової тканини, зібрані у мишей, які отримували чау та HFD, годували протягом 4 місяців, а потім піддавали імунофлуоресценції на MBP (червоний) та Olig-2 (зелений). Також було проведено ядерне забарвлення DAPI (синього кольору). b Загальні білки готували з тканин гіпоталамусу, зібраних у тварин, які отримували Chow або HFD протягом 4 місяців, а потім піддавали вестерн-блот-аналізу для вимірювання MBP, PLP та β-актину (контроль навантаження). Було проведено кількісне визначення рівня гіпоталамуса MBP та PLP, нормалізованого відносним рівнем β-актину. Результати представлені як середнє значення ± SEM (n = 5 тварин на кожен момент часу). * p 1 e, стрілки). Оскільки цілісність структури мієліну в гіпоталамічній області менше постраждала від годування HFD через 3 місяці (додатковий файл 1: Рис. S2), ми були наступними, щоб вивчити, чи скасування HFD в цей момент може запобігти порушенню структури мієліну в гіпоталамусі . Таким чином, ми провели експерименти, на яких мишей у групі, яка виводила HFD, годували HFD протягом перших 3 місяців, а потім - Chow ще 3 місяці (рис. 1, d). Вага їх тіла значно зменшилася після того, як їх дієту змінили на чау (додатковий файл 1: рис. S3A). Більше того, їх споживання води та споживання їжі набагато пізніше повернулися до рівня групи Чау (Додатковий файл 1: Рис. S3B та C). Крім того, структура мієліну в гіпоталамічній тканині, отриманій із групи, яка відводить HFD, була такою ж компактною, як і в групі Чоу (рис. 1, е). Ці результати показують, що хронічне годування HFD може пошкодити мікроструктуру мієліну гіпоталамусу, і це порушення можна запобігти, змінивши HFD на звичайний раціон у попередній момент часу.
Активація мікроглії в ARC гіпоталамусу шляхом хронічного живлення HFD
IL-33 індукує морфологічні зміни олігодендроцитів. a Зрілі OLG піддавали впливу 10 нг/мл IL-33 протягом 24 год, а потім піддавали імунофлуоресценції (червоний) з використанням анти-MBP разом із ядерним протифарбовим фарбуванням DAPI (синій). Взаємозв’язана мережа процесів OLG разом з невеликою формою клітини постраждала після впливу IL-33 (стрілки). Складна мережева форма OLG в контрольній культурі позначена наконечниками стрілок. Крім того, кількісно визначали MBP + -OLG у культурах, оброблених носієм та IL-33. Розмір клітин MBP + -OLG вимірювали за допомогою програмного забезпечення для аналізу NIH ImageJ. b Загальні білки отримували з культур, оброблених носієм та IL-33. Зразки піддавали вестерн-блот-аналізу для вимірювання MBP. Дані представлені як середнє значення ± SEM трьох незалежних експериментів. ** p + -OLG у гіпоталамусі ожиріних мишей не було очевидним, цікаво додатково визначити механізми, що впливають на пошкодження структури гієталамічного мієліну та метаболічний дисбаланс гіпоталамусних OLG при хронічному ожирінні. Крім того, відновлення функції нейронів поряд із збереженням цілісності мієліну шляхом відміни HFD необхідно додатково розкрити.
Висновки
Підводячи підсумок, це перше дослідження, яке продемонструвало, що порушення гієталамічного мієліну та підвищення регуляції гліо-похідного IL-33 були пов’язані з ожирінням, спричиненим HFD. Наше майбутнє дослідження полягає в аналізі ролі IL-33 у гіпоталамічному нейропатогенезі, пов’язаному з хронічним годуванням HFD.
Методи
Тварини
Усі експерименти на тваринах проводились відповідно до рекомендацій ARRIVE (Animal Research: Reporting In Vivo Experiments). Догляд та використання тварин було затверджено Національним комітетом з догляду та використання тварин університету Ченг Кунга, Тайнань, Тайвань (номер затвердження IACUC: 106060). Вісім тижнів самців мишей C57BL/6 (19,91 ± 0,29 г) були отримані з Національного лабораторного тваринного центру університету Ченг Кунга (http://www.ncku.edu.tw/animal/eng/nckulac.html) і поміщені в окремі клітини (пара в клітці) із вільним доступом або до звичайного раціону (лабораторна дієта для гризунів # 5001; LabDiet, Сент-Луїс, Міссурі, США) або HFD (дієта для очищення гризунів # 58Y1; США). Мишей годували звичайною дієтою або HFD (Додатковий файл 1: Таблиця S1) протягом певних періодів часу (3, 4 та 6 місяців). HFD містить 61,6% ккал з жирів, 18,1% з білків і 20,3% з вуглеводів. Тварин розміщували (2 тварини в клітці) у стандартних кімнатних умовах (кімнатна температура: 23 ± 2 ° C; вологість: 58 ± 2%; 12-годинний цикл світло/темрява) з вільним доступом до їжі та води за умови необхідності. Тварин забивали в різні моменти часу (додатковий файл 1: Таблиця S1), шляхом внутрішньочеревної (внутрішньовенної) ін’єкції Zoletil 50 (Virbac Taiwan Co., Ltd; 5-кратне розведення у фізіологічному розчині, 0,05–0,06 мл/10 г).
Підготовка первинних клітин-попередників олігодендроцитів (OPC)
Вестерн-блот-аналіз
Клітини лізували в буфері для лізису (1% тритонХ-100, 0,05% Твін-20 у PBS), що містить коктейль інгібітора протеази (Thermo Scientific, Cat # 78443). Тканини гіпоталамуса видаляли у тварин і лізували за допомогою реагенту для екстракції білка тканини T-PER (Thermo Scientific, Cat # 78510), що містить коктейль-інгібітор протеази. 100 мкг загальних білків завантажували на 10 або 15% SDS-PAGE і переносили на нітроцелюлозну мембрану. Нітроцелюлозні мембрани імуноблотували протягом ночі при 4 ° C первинними антитілами (табл. 1). Потім мембрану інкубували із вторинними антитілами, кон'югованими з пероксидазою, протягом 60 хв при кімнатній температурі. Імунореактивні білки виявляли за допомогою регенту ECL та візуалізували за допомогою плівок Super RX-NC (Фудзі, Японія). Підсилений хемілюмінесцентний субстрат Western Lightning ® Plus-ECL був від PerkinElmer Life Sciences (Бостон, Массачусетс, США).
Таблиця 1
Список антитіл у дослідженні для імунофлюоресценції або вестерн-блот-аналізу
- Хронічна дієта з низьким вмістом вуглеводів з високим вмістом жиру має мінімальний вплив на кислотно-основний стан в еліті
- Вплив дієти з високим вмістом білка на відновлення глистів, ріст і розподіл ехіностоми капронової у
- Вплив нутріцевтиків, багатих антиоксидантами, на гістологічні зміни внаслідок індукованої дієти з високим вмістом жиру
- Вплив дієти з високим вмістом насичених жирів та без крохмалю на підфракції ліпідів у сироватці крові у пацієнтів з
- Повна стаття Миші C57BL6JRj для літніх людей не страждають ожирінням під впливом дієти західного типу