Жовчогінні властивості Baccharis spicata Екстракти надземних частин у самців щурів Вістар
Анотація
Вступ
Інтерес до природних методів лікування різко зріс у міських умовах для лікування незначних та хронічних захворювань. Зростання продажів рослинних ліків також зумовлений сприйняттям того, що споживання натуральних продуктів буде безпечним. Однак таке сприйняття не завжди відповідає дійсності, оскільки «природне» не є синонімом «нешкідливого». Крім того, трав'яні фальсифікації або неправильна ідентифікація становлять реальну проблему та прихований ризик для здоров'я.
Вакхари L. species, Asteraceae, відомі в народі як “каркея”, широко доступні в природі, і вони надзвичайно використовуються та комерціалізуються. Надземні частини їх традиційно використовувались для виправлення порушень роботи травної системи (Hieronymus 1882). У Росії виявлено кілька фенольних кислот та флавоноїдів Вакхари видів (Рамос Кампос та ін., 2016, серед інших). Екстракти та чисті компоненти цих видів виявляли різну біологічну активність (Oliveira et al. 2005; de Oliveira et al. 2012; Rodriguez et al. 2013, 2016). Настої з п’яти каркедж, з них три, тобто.,Baccharis articulata (Лам.) Перс., B. crispa Шпренг., І B. тримера (Менше.) DC., Як виявилося, збільшує відтік жовчі (BF) у щурів Wistar (Cifuente et al. 2010). Тримера Baccharis був включений до Бразилейри (2010) та Національного списку лікарських рослин, що представляють інтерес, у бразильській системі Único de Saúde (SUS) (Renisus List 2009), тоді як B. articulata і B. crispa є офіційними препаратами в Farmacopea Nacional Argentina (1978). Однак відомо, що інші Вакхари види використовуються замість офіційних наркотиків. Аналіз комерційних зразків показав це Baccharis spicata (Лам.) Застава. часто використовується для заміни трьох посадових осіб Вакхари (Barboza et al. 2001).
Baccharis spicata також відомий як “carqueja” і використовується як лікарська рослина в Південній Америці (Zardini 1984; Barboza et al. 2009). Сімоне та ін. (2004) та Retta et al. (2009) заявили, що їх надземні частини використовувались як сечогінний та травний засіб у народній медицині. Похідні фенолу (Oliveira et al. 2004; Rodriguez et al. 2016), а саме похідні флавоноїдів рутину та кофеїлхініну (Agudelo et al. 2016), були зареєстровані в екстрактах цього виду. Показано, що кофеоїлхінові кислоти є основними сполуками, відповідальними за гепатопротекторні властивості деяких лікарських рослин (Basnet et al. 1996; Azzini et al. 2007).
Маленькі гризуни - ідеальні моделі для вивчення впливу рослинних препаратів на функцію печінки шляхом оцінки швидкості жовчовивідних потоків. З іншого боку, вимірювання сироваткових маркерів функції печінки та нирок може бути використано для оцінки того, чи впливає лікарський препарат рослинного походження на інші відповідні фізіологічні параметри (Cifuente et al. 2010; Gonzalvez et al. 2017). Фармакологічне та токсикологічне обстеження, а також ботанічний та фітохімічний аналізи необхідні для підтвердження ефективності та потенційних ризиків для здоров'я B. spicata екстракти.
Беручи до уваги ці дані, жовчогінна активність сирого етанолового екстракту утворює надземні частини та похідні фракції з B. spicata було проаналізовано в цій роботі. Крім того, було проведено хімічне дослідження для оцінки контролю якості рослинних препаратів.
Матеріали і методи
Рослинний матеріал
Повітряні частини Baccharis spicata (Lam.) Baill., Asteraceae, були зібрані з квітами та ідентифіковані в Аргентині, Провінція Санта-Фе, департамент Сан-Лоренцо, місто Рольдан, на 32 ° 54 ′ 04 ″ пд. Ш., 60 ° 54 ′ 26 ″ пд., 24/III/2014, і визначена Родрігесом М.В. (Номер ваучера UNR MVR 2045). Один екземпляр B. spicata був зданий на зберігання в Гербарій Національного університету Росаріо (номер ваучера UNR М.В. Родрігес No 2045).
Рослинні екстракти та розділення
Сушені надземні частини B. spicata (600 г) екстрагували етанолом при кімнатній температурі, концентрували у роторному випарнику і називали Bstot. Bstot (10 мг) розчиняли в етанолі: H2O (5: 5) і послідовно розподіляли з n-гексан, хлороформ, етиловий ефір та етилацетат. Для подальших досліджень решту водної фракції (Bsaq) сушили ліофілізацією, а етилацетатну фракцію концентрували при зниженому тиску (Bsea).
Хроматографічний аналіз
Аналізи ВЕРХ/DAD ВЕРХ проводили на приладі Agilent Series 1200 із використанням колони Phenomenex® C18 (Luna, 250 мм × 4,6 мм; 5 мкм) в тих же градієнтних умовах, що описані Aboy et al. (2012).
Аналіз ВЕРХ-МС проводили з використанням системи серії Ultimate 3000 RSLC (Dionex –Thermo Scientific, Waltham, MA, USA), оснащеної джерелом нагрітої електророзпилювальної іонізації (H-ESI II) в тих же умовах, описаних Aboy et al. (2012). MS були досягнуті за допомогою ESI в позитивному режимі, при напрузі капіляра при 5000 В, температурі джерела 360 ° C і температурі розчинення 310 ° C за допомогою азоту в якості небулайзерного газу.
Аналіз HPTLC проводили з використанням системи HPTLC CAMAG (Муттенц, Швейцарія), оснащеної автоматичним пробовідбірником (ATS4). Зразки наносили на силікагель 60F254 TLC та розробили в ADC2 із насиченістю камери (20 хв) та відносною вологістю 33%. Пластину було виявлено під ультрафіолетом за допомогою програмного забезпечення Vision CATS (CAMAG).
Тварини та лікування
Годували самців щурів Wistar (300–350 г) ad libitum з нормальним стандартним харчуванням і водою, і підтримується протягом 12 годин світло-темного періоду. Експериментальні протоколи проводились відповідно до «Посібника з догляду та використання лабораторних тварин» (Національний інститут охорони здоров’я, Публікація № 86–23, 1985, переглянутий 1996) та затверджений Місцевим комітетом з догляду та використання тварин (Дозволи 393/2015 та 217/2018, FBioyF, UNR). Тварин розподілили випадковим чином на шість груп (n = По 5).
Група позитивного контролю отримувала внутрішньовенну болюсну ін'єкцію таурохолатом (TC; Sigma-Aldrich) при 8 мкмоль/100 г маси тіла (Marrone et al. 2016). Контрольна група (C), отримана шляхом видалення носія кожного екстракту, та три інші групи отримували Bstot у дозі 50 (Bstot50), 100 (Bstot100) або 200 (Bstot200) мг/кг маси тіла на день протягом трьох днів поспіль. Дві інші групи отримували зонд фракціями Bsaq та Bsea у дозі 100 мг/кг маси тіла, дотримуючись того ж плану, що описаний вище.
Експериментальні процедури
Хірургічні процедури проводили на 4-й день. Тварин знеболювали одноразовою дозою кетаміну/ксилазину (100 та 3 мг/кг маси тіла відповідно) і підтримували в цій умові протягом усього експерименту. Після середнього розрізу черевної порожнини загальну жовчну протоку канюлювали, і жовч збирали у попередньо зважені пробірки кожні 10 хв протягом 40 хв. В кінці кожного експерименту тварин евтаназували знекровленням, а печінку видаляли та зважували.
Визначення потоку жовчі та концентрації жовчних солей
Потік жовчі (мкл/хв г ваги печінки) оцінювали за допомогою гравіметрії, припускаючи щільність жовчі 1 г/мл. Концентрацію жовчних солей оцінювали за допомогою процедури 3α-гідроксистероїддегідрогенази (Talalay 1960). Жовчний вихід жовчної солі розраховували за концентрацією BS та значеннями BF.
Сироваткові маркери функції печінки та нирок
Концентрацію креатиніну в сироватці крові та активність лужної фосфатази (ALP), аланіну та аспартатамінотрансфераз (ALT та AST відповідно) визначали за допомогою комерційних наборів (своєрідний подарунок від Wiener Lab., Росаріо, Аргентина).
Вестерн-блот-аналіз
Отримували печінкові лізати і визначали концентрацію білка за методом Лоурі (Lowry et al. 1951). Вестерн-блот-дослідження проводили, як описано раніше в нашій лабораторії (de Luján Alvarez et al. 2002), використовуючи очищене спорідненістю кролика холестерину 7α-гідроксилаза (CYP7A1, ab106060, Abcam, Cambridge, UK) антитіло та відповідне кон'юговане з пероксидазою вторинне антитіло. Білкові смуги були виявлені системою виявлення ECL та визначені кількісно за допомогою денситометрії за допомогою програмного забезпечення Gel-Pro Analyzer (Media Cybernetics, Silver Spring, MD, США). Рівне навантаження та перенесення білка перевіряли шляхом виявлення β-актину (Sigma-Aldrich) та фарбування мембран Понсо S.
Гістологія
Зразки печінки та нирок експериментальних груп фіксували у 10% v/v розчин формаліну і вкладений у парафін, що легко плавиться. П'ять мікронних зрізів фарбували гематоксилін-еозином. Зрізи нирок також фарбували PAS.
Статистичний аналіз
Результати виражаються як середнє значення ± SE. Значимість відмінностей перевіряли одностороннім ANOVA; у випадку значимості також застосовували тест Тукі. Відмінності вважалися значними, коли стор значення було
Результати і обговорення
Хімічний аналіз B. spicata екстракт надземної частини та фракції проводили за допомогою ВЕРХ, в якій виявляли переважно сині флуоресцентні смуги, ймовірно відповідні карбоновим кислотам (рис. S1A). Смуги, ко-мігруючі з хлорогеновою кислотою (T1 Rf
0,4) та 3,5-дикафеоїлхінової кислоти (T2 Rf
0,85) також були виявлені. Ці фракції були додатково проаналізовані відповідно до ВЕРХ-аналізу на кофеїнохінінові кислоти (CQA) у B. тримера раніше розроблений Aboy та співавт. (2012). У кількох звітах описані підходи ВЕРХ для аналізу CQA. Вибрано ацетонітрил замість рухомої фази на основі метанолу, оскільки він показує найкращу пікову роздільну здатність (дані не наведені). На малюнку S1 показані хроматограми, отримані для Bstot (рис. S1B), Bsea та Bsaq (рис. S1C та D, відповідно). Для останніх фракцій спостерігали еквівалентні УФ-спектри, що вказують на CQA як основні сполуки, але на хроматограмі Bstot був виявлений додатковий сильний пік. Уздовж усього піку, виявленого DAD, чистоту похідних CQA визначали спектральним аналізом. Процес фракціонування полегшив виявлення CQA. Піки 1 і 2 представляли той самий іон при m/z 355 [M + H] +, що відповідає монокафеоїлхіновій кислоті (MQA) (рис. S2A).
Відповідно до попередніх звітів (Simões-Pires et al. 2005), послідовність елюції піків 1 і 2 збіглася з 3-О та 5-О-кофеїлхінової кислоти. Експерименти з коефіцієнтною рівнею ВЕРХ зі стандартними зразками виявили обидва сполуки у водній фракції. Відповідно до наших результатів, Agudelo et al. (2016) також описали наявність 5-О-кофеїлхінової кислоти та 3,4-; 3,5- і 4,5-дикафеоїлхінової кислоти в B. spicata. На основі цих результатів, на послідовності елюції та УФ-спектрах, типових для хлорогенних кислот, а також на тому ж іоні м/з 517 [M + H] +, отримані в нашій роботі (рис. S2B), ці дикафеолхінінові кислоти (DQA) можуть відповідати пікам 3, 4 і 5 (рис. S1).
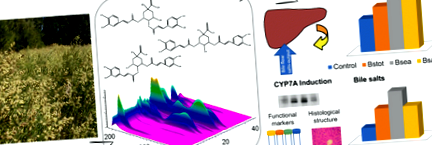
Деякі автори повідомляють про жовчогінну діяльність MQA та DQA, припускаючи, що вони діють синергічно (Wegener and Fintelmann 1999; Benedek et al. 2006). Також приписується жовчогінний ефект Вакхари spp. (Cifuente et al. 2010) і може бути пов’язана із вмістом похідних складних ефірів ефіру, але такі ефекти не досліджувались у B. spicata. Тому ми оцінювали жовчогінну активність у різних дозах Bstot (50, 100 та 200 мг/кг) у щурів Wistar. Щури, які отримували Bstot, продемонстрували дозозалежне збільшення рівня BF у досліджуваному діапазоні концентрацій порівняно з контрольною групою, демонструючи значні відмінності при 100 та 200 мг/кг (рис. 1а). Вихід BS також індукувався Bstot в залежності від дози. Відповідно до спостережуваного збільшення рівня BF, вихід БС значно збільшився при 100 і 200 мг/кг (Bstot50 45,72 ± 5,72, Bstot100 78,66 ± 19,37 * і Bstot200 104,15 ± 13,24 * нмоль/хв/г печінки) (рис. 1б) . Як і очікувалось, позитивна контрольна група щодо холерезису при введенні ТК продемонструвала значне збільшення як рівня BF, так і виходу БС [BF (мкл/хв/г печінки) контроль, 1,56 ± 0,05; ТК, 1,87 ± 0,04 *; Вихід BS (нмоль/хв/г печінки) Контроль, 33,11 ± 3,10; ТК, 128,80 ± 10,20 *; *стор Рис. 1
- Вплив параметрів лиття під тиском на зносостійкі властивості алюмінієвого сплаву A390 SpringerLink
- Затвердіння епоксидної смоли DER-331 гексакісом (4-ацетамідофенокси) циклотрифосфазеном та властивості
- Використання дієтичних добавок з антиоксидантними властивостями для підвищення фізичної працездатності
- Виготовлення мікрореакційних клітин з урахуванням властивостей журналу American Chemical
- Фрейд мав рацію ... Про витоки аномальної поведінки SpringerLink