Харчове програмування розвитку гіпоталамусу: критичні періоди та вікна можливостей
S G Bouret
1 Науково-дослідний інститут Сабана, Програма неврології, Дитяча лікарня Лос-Анджелес, Університет Південної Каліфорнії, Лос-Анджелес, Каліфорнія, США
2 Inserm, Дослідницький центр Жана-П'єра Оберта, U837, лабораторія Нейробеза, Університет Лілль 2, Лілль, Франція
Анотація
Вступ
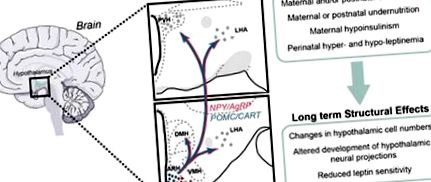
Програмування розвитку шляхів, пов’язаних з апетитом гіпоталамуса. Програмування розвитку нервових систем гіпоталамуса перинатальним середовищем представляє можливий механізм, за допомогою якого зміни в харчуванні матері та/або постнатального періоду схиляють потомство до ожиріння. Розвиток ARH, який містить підмножину нейронів, присвячених метаболічній регуляції, таких як нейрони, що експресують NPY та AgRP, та нейрони, що містять POMC, представляється надзвичайно чутливим до змін у харчовому середовищі. Структурні дефекти спостерігались у гіпоталамусі тварин, що зазнали змін у харчовому середовищі, таких як зміна кількості клітин, порушення в утворенні аксональних зв’язків та ослаблена чутливість до лептину. Ці ефекти, як видається, певною мірою опосередковані ненормальною секрецією лептину та/або сигналізацією у критичні періоди внутрішньоутробного та/або постнатального розвитку.
Через важливість гіпоталамуса в регуляції харчового та енергетичного балансу, припускають, що порушення розвитку гіпоталамусу протягом перинатального життя можуть призвести до порушення метаболічної функції протягом усього життя (див. Посилання 6, 7, 10, 15, 16, 17 для огляду ). У цьому огляді узагальнено зміни у розвитку та структурі, які спостерігались у гіпоталамусі у відповідь на зміни у ранньому харчовому та гормональному середовищі. Крім того, ми обговорюємо, як зміни різноманітного набору нервових систем гіпоталамуса можуть мати стійкий вплив на регуляцію апетиту та енергетичного балансу.
Критичні періоди для розвитку гіпоталамуса
Часові лінії розвитку гіпоталамуса. Формування функціонального гіпоталамуса відбувається у дві основні фази: визначення кількості клітин, що включає нейрогенез, та формування функціональних ланцюгів, що включає ріст аксонів та формування функціональних синапсів. У гризунів, людей та NHP нейрогенез в основному відбувається на початку та до середини гестації. Значне значення післяродового росту аксона гіпоталамуса у гризунів відрізняється від такого у людей та НГП, де нейронні проекції гіпоталамуса майже повністю розвиваються протягом внутрішньоутробного життя.
Разом ці дані вказують на те, що гіпоталамус гризунів розвивається у двох різних середовищах: внутрішньоутробному середовищі, в якому визначається кількість клітин, та позаутробному середовищі, в якому встановлюється зв'язок нейронів гіпоталамуса. На відміну від них, гіпоталамус людини та NHPs розвивається переважно протягом внутрішньоутробного життя. Ці дані також свідчать про те, що порушення розвитку гіпоталамуса у ці важливі періоди розвитку може призвести до серйозних структурних та функціональних аномалій гіпоталамуса.
Пренатальний вплив
Ожиріння матері/годування з високим вмістом жиру
Здатність ожиріння матері змінювати проліферацію клітин у розвивається гіпоталамусі нещодавно була показана у гризунів. Годування з високим вмістом жиру у щурів збільшує проліферацію гіпоталамусових клітин і призводить до збільшення кількості орексигенних нейронів у PVH та LHA, 38 включаючи галанін, енкефалін, динорфін, меланін-концентруючий гормон та нейрони орексину. Загалом дослідження гризунів показали, що несприятливий вплив обезогенного середовища для матері подібний до кількості клітин гіпоталамусу, коли вони виникають або під час виношування, або під час виношування та лактації. Наприклад, у нащадків матерів із ВЧС, які перехресно виховуються з контрольними матерями під час лактації, спостерігаються подібні зміни кількості орексигенних клітин та результатів метаболізму в порівнянні з щенятами, яких вирощують матері з ВЧС під час вагітності та лактації. 38
Оскільки багато тваринних моделей ожиріння матері пов'язані з гіперглікемією та резистентністю до інсуліну, може бути важко визначити, чи аномалії розвитку цуценят, народжених із ожирінням, спричинені змінами в раціоні маток, чи вони виникають як наслідок материнського діабет. Маніпуляції з рівнем глюкози без змін у дієті можуть бути здійснені експериментально шляхом введення стрептозотоцину, який є токсином бета-клітин підшлункової залози. Використовуючи модель тваринного на стрептозотоцині, ми нещодавно виявили, що у цуценят, які народжуються у нечутливих діабетичних дамб, зменшується щільність дугоподібних орексигенних (AgRP) та анорексигенних (aMSH) волокон, що містять PVH. 46 Ці дані показують, що діабет матері сам по собі також може спричинити довгострокові структурні зміни в гіпоталамусі.
Пренатальне недоїдання/змінений ріст
Ряд звітів також зосереджував увагу на наслідках недоїдання матері на розвиток гіпоталамуса. Було підтверджено кілька моделей затримки перинатального росту на гризунах, таких як гризуни, народжені на дамбах, які або мали обмеження калорій (CR), або білок (PR) під час вагітності та лактації. Нащадки, які народжуються та вирощуються матерями з CR або PR, мають низьку вагу при народженні та демонструють повільний ріст протягом періоду попереднього відлучення. На відміну від цього, цуценята, які народилися на дамах CR або PR, але вирощені годуючими матерями, які годувались за бажанням, демонструють швидкий ріст наздоганянь протягом першого постнатального тижня. 47, 48, 49 Хоча дорослі тварини, народжені від недоїдаючих матерів, мають нормальну масу тіла, вони гіперфагічні, непереносимі глюкозою і мають підвищену чутливість до ДІО. 47, 49, 50
На відміну від годування з високим вмістом жиру у матері, недоїдання матері пов’язане зі зменшенням кількості орексигенних нейронів у гіпоталамусі нащадків, включаючи зменшення нейронів NPY-IR в ARH. 51 Однак, чи ця зміна кількості нейрональних клітин є результатом зменшення нейрогенезу та міграції клітин, або збільшення кількості клітин, що зазнають апоптозу, ще слід дослідити. Тим не менше, спостереження про те, що товщина кортикальної пластинки зменшується у плодів PR-дамб, підтверджує думку про те, що недоїдання матері зменшує проліферацію клітин протягом ембріонального життя. 52 Крім того, різні гени, що беруть участь у розвитку мозку, включаючи гени проліферації та диференціювання клітин, регулюються материнським PR. Більше того, на астроцитогенез, який безпосередньо слідує за нейрогенним періодом, впливає материнська дієта. Після відлучення у нащадків PR-матерів зменшується кількість астроцитів та зменшується співвідношення глія-нейрон. 53 Ці висновки особливо актуальні через повідомлення про роль гліальних клітин у розвитку мозку та синаптичній пластичності. 54
Вплив новонароджених на дефіцит поживних речовин впливає на зв'язок гіпоталамусу з аксонами. Щільність нервових волокон AgRP- та POMC-IR у ПВХ зменшена у гризунів, які народжуються на дамах CR або PR. 49, 55 Крім того, для тварин з відставанням у внутрішньоутробному розвитку терміни росту наздоганяючих факторів є важливим фактором, що визначає постнатальний розвиток гіпоталамуса. Зростання на початку наздоганяння покращує аномальну організацію нейронних проекцій гіпоталамуса і є дуже корисним для маркерів розвитку мозку, включаючи маркери адгезії клітин та подовження аксона, тоді як пізнє зростання наздоганянь викликає більш шкідливі ефекти нейророзвитку в гіпоталамусі. 49
Постнатальний вплив
Постнатальне переїдання
Через важливість розвитку постнатального органу, включаючи гіпоталамус, у гризунів були розроблені тваринні моделі постнатального метаболічного програмування, спрямованих конкретно на постнатальний період. Одним із підходів, який виявився надзвичайно плідним для вивчення післягодового перегодовування, є зменшення розміру підстилки. Щенята, вирощені в невеликих послідах (SL), демонструють прискорене зростання протягом періоду попереднього відлучення. Відповідно, щенята, вирощені в СЛ, демонструють більшу масу тіла вже у віці 2 тижнів, і ці тварини залишаються важчими протягом усього життя. 56, 57, 58 Крім того, тварини, що перегодовуються після пологів, демонструють прискорене та посилене збільшення ваги при годуванні HFD. 57
Постнатальне перегодовування може впливати на різні процеси розвитку гіпоталамуса, включаючи визначення кількості клітин гіпоталамуса та зв’язок нейронів. Щури, вирощені в SL, виявляють більшу кількість нейронів, що продукують орексигенний нейропептид-галанін у PVH. 59 Крім того, постнатальне перегодовування впливає на реакцію нейронів на нейропептиди. Наприклад, було показано, що нейрони PVH хронічно перегодованих цуценят демонструють знижену електрофізіологічну реакцію на дугоподібні нейропептиди, такі як NPY, AgRP, aMSH та CART. 60 Повідомлялося також про порушення розвитку нейронних проекцій ARH у тварин, вирощених у СЛ. Хронічне післяпологове переїдання зменшує переростання аксонів AgRP та aMSH до PVH. 58
Постнатальне недоїдання
Лептин як потенційний гормональний механізм, за допомогою якого перинатальне харчування програмує розвиток гіпоталамуса
Вікна можливостей
Відомо, що фізичні вправи зменшують масу тіла у людей із ожирінням, включаючи людей та гризунів. 69 Що примітно, лише 3 тижні вправ після відлучення є достатніми для зменшення споживання їжі та повільного набору ваги у щурів DIO, і було показано, що ці ефекти зберігаються через 10 тижнів після припинення вправ. Таким чином, короткий вплив фізичних вправ на ранніх стадіях життя може мати стійкий сприятливий вплив на обмін речовин у щурів DIO. 68 Однак, коли ожирілі щури піддаються фізичним навантаженням у зрілому віці, втрата ваги, спричинена фізичними вправами, є тимчасовою, і вага відновлюється після припинення вправи. 70 Ці дані додатково ілюструють важливість часу втручання.
Взяті разом, ці дані показують, що безпосередній період після відлучення та перипубертатне життя є важливими періодами для розробки інтервенційних досліджень, спрямованих на покращення та, сподіваємось, зворотне метаболічне неправильне програмування плода та/або новонародженого.
Висновок
Зараз добре прийнято, що порушення процесів нейророзвитку може призвести до захворювання в подальшому житті. Дослідження протягом останніх десятиліть дали цінну інформацію про роль перинатального харчування у схильності до розвитку захворювань у дорослому житті, включаючи ожиріння. Зараз є чіткі докази того, що зміни харчування протягом критичних періодів життя можуть також погіршити розвиток нервових систем гіпоталамуса, які беруть участь у регулюванні енергетичного балансу. Одним із ключових механізмів метаболічного програмування гіпоталамуса є сигналізація про лептин під час перинатального розвитку. Підходи, спрямовані на поліпшення та розширення нейротрофічних ефектів лептину після критичних періодів новонароджених, дали б змогу більш ефективним стратегіям сприяти правильному підключенню гіпоталамуса та могли б забезпечити нові терапевтичні можливості.
Подяка
Я дякую членам моєї лабораторії за їх активну участь у дослідженнях, обговорених у цьому огляді. Дослідження в моїй лабораторії фінансуються за рахунок грантів Національного інституту охорони здоров’я (грант DK84142), „Fondation pour la Recherche Médicale“ та Інституту Данон, інтегрованого проекту ЄС 7 РП (Угода про грант № 266408, „Full4Health“), та "Національна агенція з вивчення" (гранти ANR-08-JCJC-0055-01 та ANR-11-BSV1-021-02).
Примітки
Автор не заявляє конфлікту інтересів.
- Харчова підтримка дітей під час критичної хвороби Європейське товариство педіатрії та новонароджених
- Розробка веб-сайту про харчову мудрість; Електронна комерція - ДРУГИЙ ЗАХІД - Дизайн веб-сайтів; Розвиток,
- Переможці конкурсу Placemat 2015-16 - Послуги з розвитку харчування
- Роль раннього гормонального та харчового досвіду у формуванні поведінки годування та гіпоталамусу
- Харчові та функціональні властивості фініків Огляд критичних оглядів у галузі харчової науки та