Гострий тепловий стрес активує запальний сигнал у свинячих окисних скелетних м’язах
Шанті Ганесан
1 Департамент наук про тварин, Університет штату Айова, Еймс, Айова,
Ольга Володіна
1 Департамент наук про тварин, Університет штату Айова, Еймс, Айова,
Сара С. Пірс
1 Департамент наук про тварин, Університет штату Айова, Еймс, Айова,
Ніколас К. Габлер
1 Департамент наук про тварин, Університет штату Айова, Еймс, Айова,
Ленс Х. Баумгард
1 Департамент наук про тварин, Університет штату Айова, Еймс, Айова,
Роберт П. Роудс
2 Відділ наук про тварин і птиці, штат Вірджинія, Технологія, Blacksburg, Virginia,
Джошуа Т. Селсбі
1 Департамент наук про тварин, Університет штату Айова, Еймс, Айова,
Анотація
Вступ
Тривалий гіпертермічний вплив, здається, суттєво контрастує з терапевтичною гіпертермією, під час якої коротка (приблизно 30 хв) гіпертермія послаблює атрофію м’язів (Naito et al. 2000; Selsby and Dodd 2005), посилює ріст м’язів (Selsby et al. 2007; Takeuchi et al. . 2014) та підтримує чутливість до інсуліну (Gupte et al. 2011). Тривала гіпертермія також відрізняється від змін, що відбуваються в моделях теплового удару, які часто тривають приблизно 2 години і можуть включати компонент фізичного навантаження. Зокрема, інтерлейкін-6 (IL-6) сильно індукується в м'язах під час теплового удару і виявляється цитозахисним для ряду систем органів (Welc et al. 2012), однак він притупляється протягом 12 годин гіпертермічного впливу ( Ганесан та ін. 2016). Більше того, тепловий удар, здається, індукує запальний сигнал через AP-1, але не NF-κB (Welc et al. 2013b), тоді як більш тривалий гіпертермічний вплив активує як AP-1, так і NF-κB (Ganesan et al. 2016).
Матеріали і методи
Тварини та навчальний дизайн
Усі процедури були розглянуті та схвалені Інституційним комітетом з догляду та використання тварин Університету штату Айова (протокол №2‐12‐7307-S). Детальний експериментальний дизайн та фенотипічні дані були раніше опубліковані (Pearce et al. 2014). Коротко кажучи, 32 свинки із середньою масою тіла 63,8 ± 2,9 кг були випадковим чином віднесені до чотирьох груп. Контрольних свиней (n = 8) утримували в термонейтральних умовах протягом 6 год (0 год. Теплового стресу; 21 ° С;
Вологість 70%), тоді як тварини з інших груп піддавалися дії теплового стресу (37 ° C;
40% вологості) протягом 2 год (n = 8), 4 год (n = 8) або 6 год (n = 8). Дозвільний доступ до кормів та води був забезпечений для всіх тварин, а раціон відповідав вимогам Підкомітету з питань харчування свиней, Комітету з питань харчування тварин, Комітету з питань сільського господарства та Національної дослідницької ради (1998 р.) Щодо свинарства та управління свинями. Температуру та вологість навколишнього середовища реєстрували кожні 5 хв за допомогою реєстратора даних (Lascar ® EL ‐ USB ‐ 2 ‐ LCD, Erie, PA). Ректальну температуру, частоту дихання та споживання корму реєстрували кожні дві години. Після того, як обробка навколишнього середовища була закінчена, тварин перебивали передозуванням барбітурату та знекровленням, а червоний м’яз напівсухожил (STR) негайно збирали і зберігали при -80 ° C. STR був обраний для аналізу, оскільки ми раніше виявляли високий ступінь гіпертермічної дисфункції, тоді як біла гліколітична частина ST порівняно стійка до гіпертермії.
Екстракція білка та імунохімія
Таблиця 1
Антитіла та розведення, що використовуються для імуноблотингу
| Білок теплового шоку (HSP70) | 1: 1000 | 1: 2000 | Enzo Life Sciences: C95F3A ‐ 5 |
| Білок теплового шоку (HSP60) | 1: 750 | 1: 2000 | Технологія стільникової сигналізації: 12165 |
| Білок теплового шоку (HSP90) | 1: 1000 | 1: 3000 | Технологія стільникової сигналізації: 4874 |
| Активовані стресом протеїнкінази (SAPK)/c ‐ червня N ‑ кінази (JNK) | 1: 1000 | 1: 3000 | Технологія стільникової сигналізації: 9251 |
| фосфо-SAPK/JNKThr183/Tyr185 | 1: 1000 | 1: 2000 | Технологія стільникової сигналізації: 9251 |
| Ядерний фактор каппа-підсилювач легкого ланцюга активованих В-клітин (NF-κB р65) | 1: 5000 | 1: 3000 | Технологія стільникової сигналізації: 8242 |
| фосфо-NF-κB p65 Ser536 | 1: 1000 | 1: 1000 | Технологія стільникової сигналізації: 3033 |
| Ядерний фактор каппа-альфа-кіназа субодиниця альфа (IKKα) | 1: 1000 | 1: 2000 | Технологія стільникової сигналізації: 2682 |
| Ядерний фактор підсилювача гена легкого поліпептиду каппа в інгібіторі В-клітин, альфа (IKBα) | 1: 2000 | 1: 2000 | Технологія стільникової сигналізації: 9242 |
| Фактор некрозу пухлини альфа (TNFα) | 1: 2000 | 1: 2000 | Технологія стільникової сигналізації: 3707 |
| Інтерлейкін-6 (ІЛ-6) | 1: 500 | 1: 2000 | Технологія стільникової сигналізації: 12153 |
| Інтерлейкін ‐ 1β | 1: 500 | 1: 2000 | Технологія стільникової сигналізації: 12242 |
| Янус Кіназа (JAK1) | 1: 1000 | 1: 2000 | Технологія стільникової сигналізації: 3341 |
| Янус Кіназа (JAK2) | 1: 1000 | 1: 2000 | Біотехнологія Санта-Крус: SC294 |
| Перетворювач сигналу та активатор транскрипції (STAT3) | 1: 1000 | 1: 3000 | Технологія стільникової сигналізації: 4904 |
| фосфо-STAT3 Tyr705 | 1: 750 | 1: 1000 | Технологія стільникової сигналізації: 9131 |
виділення мРНК та RT-qPCR
Таблиця 2
Послідовності для праймерів RT ‐ qPCR
| 18С | ctctagataacctcgggccg | gtcgggagtgggtaatttgc | 60,0 |
| ІЛ ‐ 2 | ggtgcacctacttcaagctc | ctccctccagagctttgagt | 64.4 |
| ІЛ ‐ 6 | agatgccaaaggtgatgcca | ctcagggtctggatcagtgc | 65,7 |
| ІЛ ‐ 1β | ccaaagagggacatggagaa | ttatatcttggcggcctttg | 62.2 |
| ІЛ ‐ 8 | gaaatcacaggatgcccagt | tgcaagttgaggcaagaaga | 61,8 |
| ІЛ ‐ 10 | tgtgccctatggtgttcaac | ctttgtcacactccggaagc | 59.7 |
| ІЛ ‐ 15 | tcctggagttacgcgtcatt | ttttcctccagctcctcaca | 62.2 |
| TNFα | gcccttccaccaacgttttc | tcccaggtagatgggttcgt | 66,9 |
Статистичний аналіз
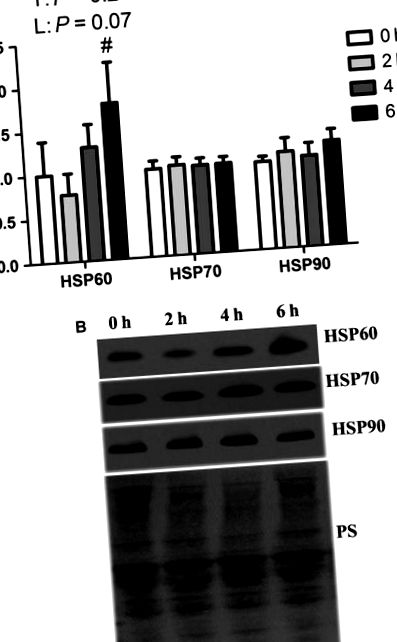
Вплив короткочасного теплового стресу на білки теплового шоку в окислювальних скелетних м’язах. Відносну кількість білка HSP 60, HSP 70 та HSP 90 вимірювали за допомогою вестерн-блот (A). Репрезентативні плями включені (B). Пляма Понсо S (PS) використовували як контроль навантаження. Значення середні ± SE; n = 8/група. # Вказує на значну різницю порівняно з 2 год теплового стресу, P 2 A і B). IKKα фосфорилює IKBα, ендогенний інгібітор NF ‐ κB, і призводить до його подальшої деградації. Рівень білка IKBα був подібним між групами. Загальний вміст білка NF κκ збільшився приблизно на 40% через 6 годин теплового стресу порівняно з усіма іншими групами, які були подібними між собою (P 2 A і B). Рівень протеїну фосфорильованого NF κB був однаковим між групами. Відносна кількість загального та фосфорильованого NF κκ в ядерній фракції також була однаковою між групами (рис. 2 C та D).
- Чи готові ви до літа Управління харчуванням може перемогти жаркий стрес Національний фермер свиней
- Гостре дієтичне обмеження діє через сигналізацію TOR, PP2A та Myc для посилення вродженого імунітету в
- Гостра дієта з високим вмістом жиру підвищує рівень глутаматергічної сигналізації в дорсальному руховому ядрі блукаючого
- Дієта з високим вмістом білка, не ізольована BCAA, пов’язана з індексом маси скелетних м’язів у пацієнтів
- Моніторинг хронічного та гострого стресу за допомогою електрофізіологічних сигналів від PNAS надниркових залоз