Гомеостатичний та гедонічний сигнали взаємодіють у регулюванні споживання їжі 1–3
Анотація
Вступ
У галузі медицини термін наркоманія застосовується лише до таких наркотиків, як зловживання алкоголем та кокаїном. Незважаючи на те, що останнім часом поняття харчової залежності приділяється значній увазі популярних засобів масової інформації, насправді в медичній науці немає діагнозу харчової залежності. На відміну від залежності від зловживання наркотиками, набагато менше відомо про поведінкові та нейробіологічні наслідки багаторазового впливу дуже смачних продуктів. Враховуючи потребу в їжі для життя, багато дискусій було зосереджено на визначенні терміна харчова залежність. Для цілей цієї дискусії ми використовуємо спрощене, але корисне визначення харчової залежності як «втрату контролю над споживанням їжі». [Для повного обговорення визначення харчової залежності читача направляють на чудовий огляд Роджерса та Сміта (1).] Використовуючи зловживання наркотиками як модель, ми порівнюємо нейрональну регуляцію споживання їжі зі споживанням наркотиків та обговорюємо потенціал для того, щоб їжа сприймала звикання.
Гедонічні аспекти залежності від речовин та споживання їжі
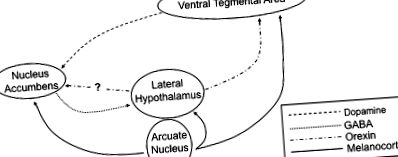
Численні докази у гризунів та людей зараз підтримують теорію, згідно з якою як зловживання наркотиками, так і споживання смачної їжі сходяться на спільному шляху в лімбічній системі для опосередкування мотивованої поведінки (2,3). Значна частина цієї роботи зосереджена на мезолімбічному дофаміновому шляху, оскільки всі поширені наркотики зловживають посиленням передачі сигналів дофаміну з нервових кінцівок, що беруть початок у вентральній тегментальній ділянці (VTA) 5, на нейрони в ядерному нагромадженні (також званий вентральним стриатумом) ( Рис. 1 ). Вважається, що посилена передача дофамінергічних засобів відбувається або безпосередньою дією на дофамінергічні нейрони (стимулятори, нікотин), або опосередковано через інгібування GABAergic інтернейронів у VTA (алкоголь, опіати) (2,3). Також до участі в опосередкуванні медикаментозної активації нейронів дофаміну VTA є пептидний нейромедіатор орексин, який експресується популяцією бічних нейронів гіпоталамуса, які широко іннервують більшу частину мозку, включаючи VTA (4–6).
Схематичне зображення нейронних ланцюгів, які регулюють харчування. Дофамінергічні нейрони, що беруть початок у проекті VTA, до нейронів в ядрі акуменсу вентрального смугастого тіла. Латеральний гіпоталамус отримує вхідні дані від GABAergic проекцій з nucleus accumbens, а також меланокортинергічних нейронів від Arc гіпоталамуса. Крім того, меланокортинові рецептори знаходяться також на нейронах VTA та в ядрі акумулятора.
Природні винагороди, такі як їжа, стимулюють подібні реакції в межах мезолімбічного шляху дофаміну. Презентація смачної їжі індукує потужне вивільнення дофаміну в ядро акумен (3). Вважається, що цей викид дофаміну координує багато аспектів спроб тварини отримати їжу, включаючи посилене збудження, психомоторну активацію та умовне навчання (запам'ятовуючи пов'язані з їжею стимули). Механізм, за допомогою якого їжа стимулює передачу сигналів дофаміну, незрозумілий; однак, схоже, рецептори смаку не потрібні, оскільки миші, у яких відсутні рецептори солодкого, все ще здатні розвивати сильну перевагу до розчинів сахарози (7). Одна з можливостей полягає в тому, що нейрони орексину можуть активуватися під час годування, з подальшим вивільненням орексину безпосередньо стимулюючи дофамінові нейрони VTA (8).
Нещодавно було підтверджено значення мезолімбічного шляху дофаміну в захворюваннях людини. Stoeckel та співавт. повідомлялося, що у жінок з нормальною вагою фотографії енергетично щільної їжі стимулювали значне збільшення активності спинного хвоста, області спинного смугастого тіла. Навпаки, жінки з ожирінням, представлені знімками високоенергетичної їжі, продемонстрували підвищену активацію в декількох лімбічних регіонах, включаючи орбітофронтальну та префронтальну кори, мигдалини, спинну та черевну смугасту тканину, інсулу, передню зону кори головного мозку та гіпокамп (9). Ця різниця в активації свідчить про те, що особи, що страждають ожирінням, могли змінити оцінку харчової винагороди, що призвело до відхиленої мотивації споживати високоенергетичну їжу.
Як і слід було очікувати, тривала активація лімбічної системи зловживанням наркотиками призводить до клітинних та молекулярних адаптацій, які частково служать для підтримки гомеостазу в передачі сигналів дофаміну (2). У межах дофамінергічних нейронів VTA хронічне вживання наркотиків пов’язане зі зменшенням базальної секреції дофаміну, зменшенням розміру нейронів та підвищенням активності тирозингідроксилази (ферменту, що обмежує швидкість у біосинтезі дофаміну), а також зв’язуючого білка елемента відповіді фактора транскрипції. (КРЕБ) (2,10). У нейронах-мішенях стриатуму хронічне вживання наркотиків підвищує рівень CREB, а також інший фактор транскрипції, deltaFosB, обидва з яких змінюють реакцію нейронів на передачу сигналів дофаміну (2). Вважається, що ці адаптації є важливими для відхиленої мотивації отримання наркотичних засобів, що спостерігається у пацієнтів із залежністю. Наприклад, підвищення рівня deltaFosB у смугастому тілі підвищує чутливість до корисних наслідків зловживання наркотиками, такими як кокаїн та морфін, та підвищує стимулюючу мотивацію до їх отримання (2).
Подібні клітинні та молекулярні зміни були описані у гризунів, які піддаються дії дуже смачних страв. Миші, які піддавались дієті з високим вмістом жиру протягом 4 тижнів, а потім різко переходили до менш смачної напівочищеної дієти, демонстрували зниження рівня активного CREB в смугастому тісті до 1 тижня після перемикання (11). Ці висновки узгоджуються з роботою Barrot et al. (12), який повідомив, що зменшення активності CREB у вентральному смугастому тілі збільшує перевагу як до розчину сахарози (природна винагорода), так і до морфію, добре охарактеризованого наркотичного засобу. Крім того, миші, які зазнали дієти з високим вмістом жиру протягом 4 тижнів, виявляли значне підвищення рівня deltaFosB в ядрі accumbens (11), подібно до змін, що спостерігалися після впливу наркотиків (2). Крім того, підвищена експресія deltaFosB у цій області мозку посилює підсилену їжею реакцію операнта, демонструючи чітку роль deltaFosB у підвищенні мотивації для отримання харчових винагород (13). У сукупності ці дослідження демонструють, що лімбічні регіони відчувають подібні нейроадаптації після впливу винагороди як їжі, так і наркотиків, і що ці адаптації змінюють мотивацію отримання обох типів винагороди.
Гомеостатичні аспекти прийому їжі
На відміну від гедонічних аспектів годівлі, які зосереджуються на винагороді, пов’язаній із споживанням їжі, гомеостатичний контроль годування пов’язаний насамперед з регулюванням енергетичного балансу. Більша частина цієї роботи зосереджена на циркулюючих гормонах, які передають інформацію про рівень периферичної енергії в мозок. Два найважливіших периферичних гормони - лептин і грелін. Лептин синтезується білою жировою тканиною, і його рівень збільшується пропорційно жировій масі. Серед його численних дій високий рівень лептину сильно пригнічує споживання їжі та стимулює обмінні процеси, щоб розсіяти надмірні запаси енергії (14). На відміну від них, грелін - це пептид шлунку, рівень якого підвищується у відповідь на негативний енергетичний баланс і стимулює споживання їжі та накопичення енергії (14).
Хоча рецептори лептину та греліну широко виражені у всьому тілі та центральній нервовій системі, дугоподібне ядро (Arc) гіпоталамуса має особливе значення, враховуючи його добре відому роль у регулюванні харчування та метаболізму (15). В межах дуги рецептори лептину експресуються у двох різних підгрупах нейронів (рис. 1). Перший виражає пептидний нейромедіатор про-опіомеланокортин (POMC) та кокаїн-амфетамінову транскрипт (CART). Сигналізація рецепторів лептину стимулює активність нейронів POMC/CART і пригнічує годування, одночасно збільшуючи швидкість метаболізму. По-друге, активація рецептора лептину пригнічує другий набір нейронів, які експресують нейропептид Y (NPY) та пов'язаний з гуті пептид (AgRP); ці нейрони зазвичай збільшують споживання їжі. Таким чином, нейрони POMC/CART та нейрони NPY/AgRP справляють протилежний вплив на споживання їжі та споживання енергії. Таким чином, лептин є потужним супресором харчування, стимулюючи анорексигенні нейрони POMC/CART, одночасно пригнічуючи дію нейронів проапетиту NPY/AgRP (15). На відміну від них, рецептори греліну експресуються переважно на нейронах NPY/AgRP в межах дуги; активація сигналізації греліну стимулює ці нейрони і сприяє харчуванню (14).
Вплив стресу на годування
- Вплив тяги до їжі та споживання калорій на індекс маси тіла (ІМТ) змінюється протягом 18 місяців
- Знання рекомендованого споживання калорій та впливу калорій на вибір їжі серед канадців
- Стратегії годування матері та споживання їжі дитиною з урахуванням ваги та демографічного впливу
- Як реєструвати споживання їжі за допомогою MyFitnessPal - Поділитися основами Digital Citizen
- Нездорова їжа Майже половина дітей; Вживання калорій - ABC News