Годування важких хворих правильною сироваткою: мислити нестандартно. Особистий погляд
Анотація
Атрофія скелетної м’язової маси є майже універсальною проблемою у тих, хто пережив важкі захворювання, і пов’язана зі значною короткостроковою та довгостроковою захворюваністю. На відміну від звичайної практики, надання білка/амінокислот у вигляді безперервної інфузії значно обмежує синтез білка, тоді як періодичне годування максимально стимулює синтез скелетних м’язів. Крім того, білок на основі сироватки (з високим вмістом лейцину) збільшує синтез м’язів у порівнянні з соєвим або казеїновим білком. Окрім несприятливого впливу на синтез скелетних м’язів, безперервне годування є нефізіологічним та має несприятливий вплив на метаболізм глюкози та ліпідів та роботу шлунково-кишкового тракту. Я пропоную, щоб критично хворим пацієнтам годували періодично сумішшю на основі сироватки, і що такий підхід, ймовірно, буде пов’язаний із кращим контролем глікемії, меншим стеатозом печінки та більшим збереженням м’язової маси. Ця стаття забезпечує наукову основу для мого підходу до періодичного годування важкохворих пацієнтів.
Огляд
Люди, які пережили важку хворобу, страждають від помітного виснаження м’язів, на відновлення якого можуть знадобитися роки. Втрата м’язової маси пов’язана з м’язовою слабкістю, тривалою механічною вентиляційною підтримкою, втомою та затримкою відновлення [1–3]. Цей розлад відомий як важка міопатія (CIM) або слабкість у відділенні інтенсивної терапії (ICUAW) [1–3]. CIM характеризується дифузною некротизуючою міопатією, що супроводжується атрофією клітковини, жировою дегенерацією м’язових волокон та фіброзом [4]. Безліч факторів, швидше за все, відіграють певну роль у стимулюванні CIM, включаючи бездіяльність м’язів, запалення, клітинний енергетичний стрес, кортикостероїди, гіперглікемію, нервово-м’язові блокатори та неадекватну харчову підтримку [2, 4]. CIM надзвичайно поширений у тих, хто пережив реанімацію, про що повідомляється приблизно в 46% випадків [5]. Геррідж та ін. спостерігали за 109 вижилими ГРДС протягом 5 років після виписки з реанімації [6, 7]. Усі пацієнти повідомляли про поганий функціональний статус із проксимальною слабкістю та втомою при виписці. За 1 рік відстань, пройдена за 6 хвилин, становила 66% від прогнозованої, яка зросла до 76% від прогнозованої через 5 років [7].
Розпад м’язів під час гострої хвороби
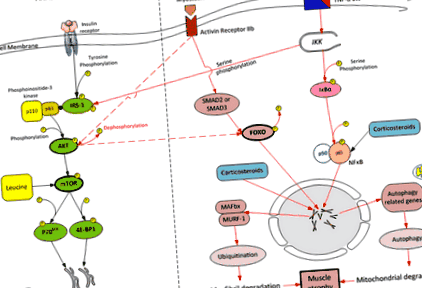
Спрощений огляд анаболічного та катаболічного шляхів скелетних м’язів.AKT = протеїнкіназа b; FOXO-1 = вилка класу O-1; IRS-1 = субстрат рецептора інсуліну-1; MAFBx = атрофія м’язів f-box-1; MURF-1 = білок м’язового безіменного пальця 1; NF κB = нуклеарний коефіцієнт κB; IKK = інгібітор ядерного фактора κB кінази; IκB = інгібітор ядерного фактора κB; 4E-BP1 = еукаріотичний фактор ініціювання (eIF) 4E, що зв’язує білок 1; P70 S6K = 70-кДа рибосомний білок S6 кіназа; mTOR = ціль рапаміцину у ссавців; TNF-α = фактор некрозу пухлини-α
При критичних захворюваннях втрата м’язової маси виникає внаслідок дисбалансу між м’язовим протеолізом та синтезом білка, протеоліз пригнічує неадекватну синтетичну реакцію [13]. Протеоліз опосередковується кількома клітинними сигнальними мережами, але переважним протеолітичним шляхом, що активується в моделях атрофії м’язів, є система убиквітин-протеасома [14–16]. Дві м'язоспецифічні E3-лігази, що належать до комплексу убиквітин-протеасома, м'язовий РІНГ-палець 1 (MuRF1) та м'язова атрофія F-box (MAFbx), визначені ключовими регуляторами опосередкованого протеасомами розпаду білка [4, 17– 19]. Форкхед O (FOXO) - це сімейство транскрипційних факторів, яке відіграє важливу роль у виснаженні м’язів, насамперед за рахунок збільшення експресії MuRF-1 та MAFbx [20, 21]. FOXO активується (дефосфорилюється) внаслідок запалення та сепсису.
Путхучеари та його колеги продемонстрували зменшення площі поперечного перерізу прямої стегнової кістки на 17% у важкохворих після 10 днів ШВЛ [13]. Втрата м'язової маси була найбільшою у тих, хто страждав від мультисистемної недостатності, і зростала із збільшенням тривалості перебування. У цьому дослідженні модель внутрішньоклітинного передавання сигналів продемонструвала посилений розпад м’язів та зниження синтезу. Воллерсхайм та його колеги досліджували динаміку деградації міозину у пацієнтів, яким потрібна механічна вентиляція легенів протягом принаймні 15 днів [4]. Ці автори продемонстрували знижену експресію генів ізоформ важкої ланцюга міозину зі значно підвищеною експресією мРНК MuRF-1, MAFbx та FOXO-1. Костянтин та ін. повідомляв про подібні висновки; крім того, ці автори повідомляють про широке дефосфорилювання (інактивацію) білків, що регулюють активацію фактора ініціації трансляції та синтез білка (AKt1, mTOR, 4E-BP1) та підвищену експресію міостатину [22].
Активізація синтезу м’язів та роль лейцину
Кінетика синтезу м’язових білків
На синтетичну реакцію м’язів та ефект „м’язової повноти” впливають фізичні навантаження, вік, тип введеного білка та анаболічний/катаболічний стан людини [8]. Зниження синтезу м’язів білків, що абсорбує м’язи, що називається „анаболічною резистентністю” є загальним явищем старіння і частково може пояснити саркопенію літніх людей [8, 52]. Збільшені дози білка та високоякісного білка (сироватки) подолають вікову анаболічну резистентність [53]. Доза 20 г сироваткового білка потрібна для максимальної швидкості синтезу міофібрилярних м’язів у спокійних та вправлених м’язах молодих чоловіків, які тренуються на опір [54], а 40 г - у літніх людей [55]. Нерухомість [56–58], сепсис [59–61] та запалення [62] призводять до анаболічної резистентності. Варі продемонстрував, що високі дози лейцину збільшують синтез м’язових білків і долають анаболічну резистентність на моделі мишачого сепсису [63].
Важливо підкреслити, що кінетика синтезу м’язових білків, порівняння періодичного та постійного надходження білка та впливу сироваткової суміші на основі сироватки та казеїну на синтез білка не вивчались у критично хворих пацієнтів. Однак, хоча величина синтетичної відповіді у критично хворих пацієнтів може бути притуплена порівняно зі здоровими людьми, немає жодних фізіологічних підстав вважати, що стереотипна схема синтезу м'язів, зафіксована у здорових людей та моделей тварин, не повинна застосовуватися до критично хворих хворий пацієнт. У бойових військах для оптимального функціонального відновлення рекомендується дозування білка щонайменше 20 г високоякісного білка кожні 4–5 год (під час неспання) [64]. Хоча оптимальна доза білка та стратегія дозування у важкохворих пацієнтів невідома, я припускаю, що підхід, подібний до підходу бойових військ, може обмежити втрату м'язів у цих пацієнтів.
Клінічні дослідження не можуть продемонструвати поліпшення результатів при застосуванні більшої кількості білка (постійно надається)
Періодичне проти постійного годування
Жоден вид не їсть безперервно (вдень і вночі), і такий еволюційний дизайн здасться абсурдним. Шлунково-кишковий тракт і метаболічні шляхи людини, здається, призначені для періодичного прийому поживних речовин кілька разів на день. Люди еволюціонували, оскільки споживачі їжі з перервами не пристосовані до постійного надходження поживних речовин; нормальна фізіологія, як видається, змінюється, коли застосовується такий підхід. Однак постійне ентеральне годування важкохворих пацієнтів, як видається, є стандартом медичної допомоги у всьому світі [73]; такий підхід є явно нефізіологічним і, ймовірно, пов'язаний зі значними ускладненнями. Швидке шприцеве болюсне годування було нормою до введення безперервних інфузійних насосів. Швидке болюсне годування було пов’язане з раптовою розтяжкою шлунка та високою частотою нудоти та блювоти. Постійне годування інфузійним насосом було пов’язано з меншою непереносимістю і незабаром стало вважатися стандартом догляду. Однак, коли «болюс» ентерального корму дається протягом більш тривалого періоду часу (20–40 хв), частота нудоти та блювоти не збільшується [74]; цей спосіб годування найкраще називати періодичним годуванням.
На мою думку, постійне ентеральне харчування є нефізіологічним, обмежує збереження м’язової маси і пов’язане з несприятливим впливом на метаболізм глюкози та ліпідів, і від цього підходу до харчової підтримки слід відмовитись. Експериментальні та клінічні дослідження показали, що „механічне глушіння” скелетних м’язів відіграє важливу роль у CIM [56, 90]. Втрата м’язової маси та функції може бути послаблена шляхом раннього механічного навантаження [91, 92], що підтримує ранню фізичну терапію у іммобілізованих пацієнтів [93–95]. Тому я вважаю, що оптимальна харчова підтримка, що забезпечується періодичним годуванням ентеральної формули на основі сироватки у поєднанні з ранньою фізичною терапією, може послабити CIM.
Висновки
На закінчення я вважаю, що критично хворим пацієнтам слід періодично годувати сумішшю на основі сироватки, яка містить омега-3 жирні кислоти. Такий підхід, ймовірно, обмежить атрофію м’язів та сприятиме метаболічній стабільності. Постійне годування через зонд є нефізіологічним і, ймовірно, шкідливим, і від нього слід відмовитися. Для демонстрації клінічних переваг стратегії періодичного годування необхідні терміново великі рандомізовані контрольовані дослідження.
- Вибір правильного приводного рулону є ключовим для виготовлення гладких дротів та обробки металів
- Терапія годуванням відрізняється, коли діти намагаються їсти, знайдіть потрібну допомогу для своєї родини
- Рамадан натощак у хворих на хронічну хворобу нирок Клінічні та біохімічні ефекти Bernieh B, Al
- Правильно харчуйтеся цього літа; В доброму здоров’ї; Газета охорони здоров’я району Рочестера
- Правильно харчуйтеся - ваші експерти з питань харчування та харчування