Гепатопротекторний ефект перорального застосування екстракту силімарину в гепатотоксичності, викликаній тетрахлоридом вуглецю у щурів
Анотація
Передумови
Силімарин, отриманий з рослини розторопші «Silybum marianum», складається з чотирьох основних флавонолігнанів. Клінічні та експериментальні дослідження вказують на гепатопротекторну дію силімарину. Однак основні механізми зрозумілі лише до кінця.
Метою цього дослідження було оцінити ефект перорального прийому певного екстракту силімарину на моделі гострого ураження печінки тетрахлоридом вуглецю (CCl4).
Методи
Одноразову дозу екстракту силімарину (SE; 20 або 100 мг/кг маси тіла) давали щурам перорально. Згодом щурам вводили разову дозу CCl4 (2 мл/кг маси тіла).
Результати
Через 24 години аналіз співвідношення маси печінки до маси тіла, рівні трансаміназ у сироватці крові та гістологічний аналіз виявили помітне пошкодження печінки, яке інгібувалось SE в залежності від дози. Індуковані CCl4 експресії прозапальних та профіброгенних генів були значно знижені у щурів, які отримували SE. Молекулярний аналіз показав, що SE зменшує експресію прозапального хемокіну MCP-1, профіброгенного цитокіну TGF-бета, а також колагену I в ізольованих зоряних клітинах печінки людини (HSC), які є ключовими ефекторними клітинами фіброзу печінки.
Висновок
Пероральне введення випробуваного екстракту силімарину пригнічувало ураження печінки в моделі гострого ураження печінки. Більше того, ми нещодавно виявили, що екстракт силімарину має прямий вплив на прозапальну та профіброгенну експресію генів у HSC в пробірці. Це вказує на те, що прямий вплив на HSC також сприяє в природних умовах гепатопротекторні ефекти силімарину та надалі сприяють його потенціалу як антифіброгенного агента також при хронічних захворюваннях печінки.
Передумови
Силімарин (Silybum marianum) - це лікарський засіб рослинного походження, що складається із суміші чотирьох ізомерів флавонілігнану, а саме силибіну, ізозилібіну, силидіаніну та силихристину з емпіричною формулою C25H22O10. Силібін є основним і найактивнішим компонентом і становить близько 60-70% силімарину, далі йдуть силихристин (20%), силидіанін (10%) та ізозилібін (5%). Кілька досліджень показали, що силімарин є гепатопротекторним рослинним препаратом [5, 15, 18].
Однією з моделей, яку найчастіше вивчають у контексті гострого ураження печінки, є модель гепатотоксичності, спричиненої карбонтетрахлоридом (CCl4). Відомо, що гепатотоксичність, спричинена CCl4, походить від його високо летальних реактивних метаболітів, таких як трихлорметил (CCl3 •) та перокситрихлорметил (CCl3OO •), які генеруються мікросомальним цитохромом P450 (CYP) у печінці ссавців [19]. CCl3 • може реагувати з різними біологічно важливими клітинними молекулами, такими як білки, ліпіди та нуклеїнові кислоти. Це спричиняє порушення функції печінки, що може впливати на найважливіші клітинні процеси, що ведуть до пошкодження печінки [20, 27]. Було показано, що силімарин захищає від гепатотоксичності, спричиненої CCl4, шляхом знешкодження вільних радикалів та активних форм кисню [13, 22]. Крім того, були описані протизапальні та антифіброзні властивості (оглянуто в [1]). У той час як кілька досліджень досліджували ефективність силімарину в хронічній моделі CCl4 при пероральному застосуванні та щодо фіброгенної реакції [6, 16]. Ми вперше вивчили гострий вплив екстракту розторопші, який вводять перорально, на ранні події розвитку фіброзу.
Активація HSC є ключовою подією фіброзу печінки. Активація цих клітин відбувається у відповідь на пошкодження печінки при хронічних захворюваннях печінки. Після активації HSC HSC змінюють свій фенотип на міофібробластоподібні клітини з посиленою продукцією компонентів позаклітинного матриксу (ECM), таких як колаген типу I [8, 17]. Крім того, активований HSC сприяє запаленню печінки у відповідь на гостре, а також хронічне ураження печінки, синтезуючи різні цитокіни та хемокіни, такі як моноцитарний хемоаттрактантний білок-1 (MCP-1) [24].
Метою цього дослідження була оцінка ефекту визначеного екстракту силімарину (SE; Silimarit®) проти CCl4-індукованого гепатоцелюлярного пошкодження, а також на прозапальну та профіброгенну експресію генів. Далі ми виступали в пробірці аналіз, в якому ми досліджували вплив того самого екстракту на експресію генів активованого HSC людини. Ми продемонстрували, що застосування екстракту, захищеного від CCl4-індукованої печінкової травми, залежить від дози. Крім того, наші дані вказують, що прямий вплив на активований HSC сприяв гепатопротекторним ефектам екстракту силімарину.
Методи
Хімікати
Тетрахлорид вуглецю (CCl4) та кукурудзяна олія були отримані від Sigma Pharmaceuticals (Гамбург, Німеччина). Для лікування тварин використовували сухий екстракт Silimarit® (SE, екстракт розторопші, що відповідає Pharmacopoea Europaea, Bionorica SE, Neumarkt, Німеччина). Для розчинення екстрактів був підготовлений водний розчин метилгідроксипропілцелюлози (MHPC, 0,5%, метоцел ™ E4M прем).
Виділення та стимуляція активованих печінкових зірчастих клітин
Зірчасті клітини печінки (HSC) виділяли із зразків печінки із застосуванням модифікованої двоступеневої процедури перфузії EGTA/колагенази [28]. Згодом HSC очищали градієнтним ультрацентрифугуванням арабіногалактану [11]. HSC культивували в модифікованому Дульбекко середовищі Eagle (DMEM), доповненому 10% FCS, 100 МО/мл пеніциліну та 100 мкг/мл стрептоміцину в атмосфері зволоженого повітря 95%/5% CO2. Для індукції в пробірці активації, свіжоізольований HSC висівали на пластики без покриття протягом двох тижнів [11].
Тварини та модель гострого ураження печінки
Щурів Спраг-Доулі отримували в лабораторіях Charles River (Сульцфельд, Німеччина). Тварин розміщували в приміщеннях для тварин в Університеті Регенсбурга і годували за стандартною дієтою. Для в природних умовах застосування SE суспендували в 0,5% розчині MHPC і давали щурам-самцям шість тижнів у разовій дозі 20 або 100 мг/кг маси тіла (BW) пероральним введенням (n = 4-5/група). Контрольні щури (n = 5) отримували розчинник MHPC перорально. Через 3 год щурам вводили i.p одноразово дозу тетрахлориду вуглецю (CCl4) (1 мл/кг мас. Тел .; 1: 1, об./Об. У кукурудзяній олії) або рівний об’єм розчинника (кукурудзяна олія). Через 24 години після ін'єкції CCl4 щурів вбивали шляхом пункції серця під глибокою анестезією кетаміном/ксилазином (2: 1) та відбирали зразки тканин печінки та крові для подальшого аналізу. Контролем служили печінка та кров від тварин, оброблених HPMC/кукурудзяною олією.
Гістологія
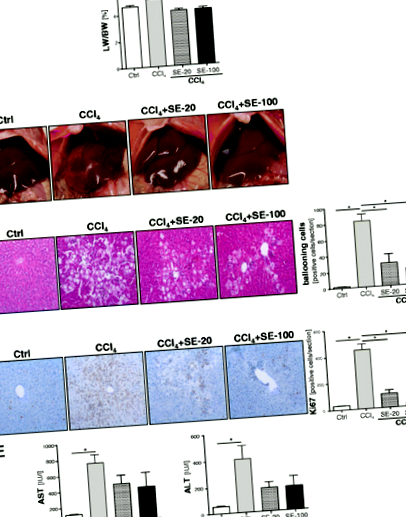
Для гістологічного аналізу зразки тканин печінки фіксували протягом 24 годин у 4% формаліні при кімнатній температурі, зневоднювали градуйованим етанолом і вносили у парафін. Зрізи тканин (товщина 5 мкм) депарафінізували ксилолом і фарбували гематоксиліном та еозином (H&E). Печінкове фарбування на Ki67 (маркер регенерації) досліджували за допомогою стандартної імуногістохімічної процедури, як описано [3]. Кількість балонуючих клітин або Ki67-позитивних гепатоцитів підраховували в 4 випадково вибраних областях на кожному зрізі.
Кількісний аналіз ПЛР у режимі реального часу
Виділення РНК із тканин печінки або культивованих клітин та зворотну транскрипцію проводили, як описано [10]. Кількісну ПЛР у реальному часі проводили із застосуванням технології LightCycler (Roche) [10], використовуючи конкретні набори аналізів грунтовки QuantiTect згідно з інструкціями виробника (Qiagen, Hilden, Німеччина). Ампліфікація кДНК, отриманої з 18s рРНК (для: 5'-TGATTAAGTCCCTGCCCTTTGT; rev: 5'-GATCCGAGGGCCTCACTAAAC), використовувалася для нормалізації.
Аналіз рівня печінкового колагену
Зразки печінки піддавали аналізу розчинного в кислоті-пепсину колагену за допомогою аналізу колаголу Sircol (Biocolor, Carrickfergus, UK) згідно з інструкціями виробника.
Кількісна оцінка рівнів білка MCP-1
Рівні білка MCP-1 у супернатанті клітинних клітин аналізували, використовуючи імуноаналіз Quantikine Human MCP-1 (системи R&D, Вісбаден, Німеччина) відповідно до інструкцій виробника.
Статистичний аналіз
Значення представлені як середнє значення ± SEM. Порівняння між групами проводилось за допомогою неспарених студентів т-тест. Значення р
Результати
Вплив екстракту силімарину (SE) на пошкодження печінки в моделі гострого ураження печінки, спричиненого CCl4
Вплив екстракту силімарину (SE) на прозапальну та профіброгенну експресію гена на моделі гострого ураження печінки, індукованого CCl4
Гемоксигеназа-1 (HMOX-1) є важливим ферментом в катаболізмі гему, який викликається окислювальним стресом. Кількісна ПЛР у реальному часі виявила значну індукцію експресії HMOX-1 у відповідь на лікування CCl4 (рис. 2а). Це збільшення HMOX-1 залежно від дози скасовано SE, що свідчить про зниження окисного стресу (рис. 2а).
Оксидативний стрес є добре відомим індуктором прозапальних реакцій, і відповідно до цього, ми спостерігали значну індукцію рівнів експресії мРНК печінки фактором некрозу пухлини (ФНО) та інтерлейкіну-1 бета (IL-1ß) у CCl4 -пошкоджені печінки (рис. 2б та в). Індукція TNF та IL-1ß була значно зменшена за допомогою SE в залежності від дози (рис. 2b та c).
Вплив екстракту силімарину (SE) на прозапальну та профіброгенну експресію гена в активованих клітинах печінкової зірки
в природних умовах дані вказують, що SE впливає на прозапальну та профіброгенну експресію генів у HSC. Однак вони не допустили диференціації, чи є це непрямим ефектом через зменшення пошкодження тканин та запалення, чи чи виявляє SE також прямий вплив на HSC. Для вирішення цього питання ми стимулювали первинно активований HSC людини за допомогою SE в пробірці. Цікаво, що ми виявили, що SE суттєво знижує експресію мРНК MCP-1 та TGF-бета в HSC залежно від дози (рис. 3a, b). Аналіз рівня білка MCP-1 у супернатантах клітинної культури підтвердив цей результат на рівні білка (рис. 3в). Більше того, експресія колагену-I, переважного білка позаклітинного матриксу у фіброзних тканинах людини, була суттєво погіршена стимуляцією SE активованими HSC в пробірці (Рис. 3d). Разом ці висновки показали, що SE безпосередньо впливає на прозапальну та профіброгенну експресію генів активованого HSC.
Обговорення
У людей, а також у гризунів біотрансформація CCl4 в основному опосередковується CYP2E1 і дуже незначно іншими CYP (CYP2B та CYP3A) (оглянуто в [27]). Відповідно, нокаутовані миші CYP2E1 стійкі до гепатотоксичності CCl4 [29]. Недавнє дослідження, проведене з морськими свинками (Cavia porcellus) показав підвищену експресію печінкового CYP2E1 у відповідь на хронічне введення алкоголю, тоді як добавки силімарину значно зменшили цю індукцію порівняно з групою, яка утримується від алкоголю [2]. Тут ми виявили, що лікування CCl4 спричинило значне зниження експресії печінкового CYP2E1, що відповідало попередньому дослідженню Wong et al. [29]. Цікаво, що інгібуючий ефект CCl4 на експресію CYP2E1 полегшив лікування SE. Ці висновки вказують на те, що силімарин має модулюючий ефект на експресію печінкового CYP2E1, який може змінюватися різними гепатотоксинами. Разом гепатопротекторні ефекти та антифібротичний ефект SE в поєднанні з відсутністю токсичності роблять його гарним кандидатом для подальших клінічних досліджень.
Що важливо, наш в пробірці Дослідження первинного HSC людини показали, що SE безпосередньо впливає на експресію профіброгенних факторів HSC. Ці дані вказують на те, що прямий вплив SE на HSC також сприяє гепатопротекторному ефекту SE в природних умовах. Що стосується впливу SE на HSC та експресію профіброгенних генів, відповідно, слід зазначити, що ми застосовували SE перорально у нашому дослідженні. Після перорального прийому пікові рівні сілібініну, головного компонента СЕ, досягаються в печінці, легенях та шлунку [31].
Висновки
На закінчення ми виявили, що досліджений екстракт силімарину виявляв глибокі гепатопротекторні ефекти на моделі гострого ураження печінки через різні механізми. Зокрема, інгібуюча дія на фіброгенні фактори в цій моделі, а також прямі антифіброгенні ефекти екстракту на HSC людини в пробірці далі вказують на потенціал цієї природної сполуки у профілактиці та лікуванні фіброзу печінки у пацієнтів із (хронічними) захворюваннями печінки.
- Вплив гідроалкогольного екстракту мембран мембран ядра волоського горіха на термін зберігання традиційного
- Вплив екстракту чорної смородини Нової Зеландії на фізіологічні реакції у спокої та під час швидкої реакції
- Насіння кропу (Anethum Graveolens), настоянка, органічний рідкий екстракт, Ши Ло, трав'яна добавка 64 унції
- Порівняння пероральних капсул октреотиду з ін’єкційними аналогами соматостатину при акромегалії - Повний текст
- Поширені та рідкісні побічні ефекти для полегшення менструального циклу перорально