Гепатопротекторний потенціал Acridocarpus orientalis у мишей
Анотація
Передумови
Передозування парацетамолу впливає на клітини печінки, що призводить до загибелі клітин. Це робиться через некроз печінки, який характеризується розривом плазматичної мембрани. Були проведені різноманітні дослідження з використанням рослинних екстрактів для оцінки токсичності печінки, викликаної парацетамолом. Тут ми розглянули рослинні види рослин, Acridocarpus orientalis (A. orientalis), етанольний екстракт для вивчення його потенціалу захисту від гепатотоксичності у мишей. Для всіх груп мишей були оцінені рівні аланінової трансамінази (ALT), аспартат-трансамінази (AST) та відновлених ферментів глутатіону (GSH). Також був проведений фітохімічний скринінг.
Результати
Фітохімічний скринінг показав це A. orientalis містить флавоноїди, дубильні речовини, вуглеводи та похідні фенолів. A. orientalis попередня обробка показала значне зниження печінкових маркерних ферментів ALT та AST майже у всіх концентраціях. Крім того, рівень GSH у сироватці крові значно підвищений у A. orientalis попередньо оброблені групи мишей. Крім того, зменшення ваги печінки у попередньо оброблених мишей з A. orientalis показали значну втрату ваги при дозі 250 мг/кг БТ (P
Передумови
Печінка є найважливішим органом в організмі, і її важлива роль у виведенні токсичних речовин [1]. Передозування деяких лікарських препаратів спричиняє незворотний вплив на печінку, що призводить до гепатотоксичності. Токсичність печінки, спричинена наркотиками (DILT), рідко трапляється через призначення цих препаратів для використання людиною з точною дозою, яка дозволяє уникнути випадків гепатотоксичності. Крім того, в контрольованих клінічних випробуваннях вживаються запобіжні заходи для зменшення серйозних травм шляхом мінімізації побічних реакцій та встановлення зупинок для вживання наркотиків [2]. Однак не можна повністю ігнорувати ймовірність появи DILT. Передозування ліків, коли пацієнт регулярно вживає наркотики через періодичні проблеми зі здоров'ям, може призвести до DILT. DILT в основному вражає клітини паренхіми печінки (гепатоцити); а іноді і ендотеліальні клітини, і епітеліальні клітини жовчної протоки (холангіоцити) і призводить до загибелі клітин [3]. Аланінтрасаміназа (АЛТ) та аспартаттрасаміназа (АСТ) - маркери печінкових ферментів, що використовуються для визначення ступеня ураження печінки [4]. Запропоновано два різні способи загибелі клітин печінки: апоптоз та некроз [3].
DILT сприяє більш ніж 50% гострої печінкової недостатності, а в загальній кількості випадків гострої печінкової недостатності, спричиненої лікарськими засобами, 80% індукується парацетамолом [5,6,7]. Парацетамол викликає гепатотоксичність при вищих дозах [8,9,10] і призводить до гострої печінкової недостатності [11]. Передозування парацетамолу діє на клітини печінки та спричиняє загибель клітин, індукуючи печінковий некроз, що характеризується розривом плазматичної мембрани клітин печінки та подальшою запальною реакцією [3, 10]. Дійсно, окислювальний стрес відіграє вирішальну роль у запальній реакції та пошкодженні печінки [12], особливо пошкодження, що зберігаються після індукції парацетамолу [13]. Утворюючи реактивний метаболіт NAPQI, надмірно дозований ацетамінофен модулює токсичність печінки, що, в свою чергу, знижує рівень глутатіону та призводить до окисного стресу. Після активації наступних шляхів, таких як JNK, призводить до посилення окисного стресу в мітохондріях та фрагментації ядерної ДНК, що призводить до регульованої клітинної смерті [13]. Можливо, ці ослаблені нормальні клітинні функції можна омолодити застосуванням антиоксидантних сполук, спрямованих на ключові запальні механізми.
Серед традиційних видів лікарських рослин в ОАЕ, A. orientalis мають великі лікувальні цінності [14];. A. orientalis це квітковий вид квіткової рослини з сімейства Malpighiaceae, корінне місцезнаходження якої є тропічна Африка, Азія та Середземноморський регіон, а також піщані рівнини країн Західної затоки [15]. Два флавоноїди з метанольного екстракту A. orientalis були відокремлені та ідентифіковані [16]. Як повідомляється, виділеними сполуками є морин та морин-3-О-β-D-глюкопіранозид. Повідомлялося, що ці сполуки мають антиліпідні властивості перекисного окислення. Однак жодних звітів для оцінки гепатопротекторних здібностей не опубліковано A. orientalis. У цьому контексті дане дослідження має на меті дослідити гепатопротекторний потенціал A. orientalis рослинні екстракти проти гепатотоксичності, спричиненої парацетамолом.
Методи
Підготовка рослинної сировини та екстракту
Свіже молоде листя A. orientalis були зібрані з долини Джабал Хафіт, Аль-Айн, Об'єднані Арабські Емірати (N24 ° 13 т E55 ° 80 т ) у жовтні 2016 р. Листя відокремлювали, нарізали на невеликі шматочки, промивали водою та сушили при 60 ° C протягом 3 днів і добре подрібнювали, щоб отримати дрібний порошок, використовуючи високошвидкісну млиноподрібнювачу трав (Greatwall, Китай). Зважували 100 г висушеного рослинного порошку і додавали 500 мл 70% етанолу і витримували в орбітальному шейкері протягом 72 годин зі швидкістю 100 об/хв при кімнатній температурі. Фільтрували з використанням фільтрувального паперу What-man No: 1 і фільтрат концентрували за допомогою роторного випарника при температурі близько 40 ° C (Стюарт, Великобританія).
Фітохімічний скринінг та кількісна оцінка
Екстракти рослин піддавали фітохімічному скринінгу із застосуванням стандартних методів [17]. Також аналізували загальний вміст фенольних (TPC) [18] та вміст флавоноїдів (TFC) [17] рослинних екстрактів. Кількісна оцінка фенолу A. orientalis вміст екстрактів у сухому екстракті вимірювали в еквіваленті галлової кислоти, а загальний флавоноїд - у еквіваленті квецетерину [19].
Використовувані хімічні речовини: камедь акації (Sigma, MO, США). Парацетамол (ацетамінофен) - добрий подарунок від Julphar Pharma, ОАЕ. Усі інші реагенти, що використовувались, були високочистими.
Тварини
Для цього дослідження використовували самців мишей-альбіносів, вагою близько 25–35 г, віком 8–10 тижнів. Комітет з етики тварин Університету ОАЕ затвердив дослідження на тваринах для цієї роботи. Мишей витримували при температурі 22 ± 2 ° C, придатному ступені вологості близько 50–60% в альтернативній темряві та світлі протягом 12 годин. Тваринам давали стандартний гранульований раціон (фабрика борошна та кормів для тварин Абу-Дабі) та воду ad libtium.
Вивчати дизайн
Мишей зважували, групували випадковим чином і обробляли перорально з допомогою сорту: Група 1: сольовий розчин та парацетамол (600 мг/кг мас. Т. Ч.) (5% камеді акації); 2 група: сольовий розчин; Група 3: А. Східні становить (125 мг/кг ТБ) і Парацетамол (600 мг/кг ТБ); Група 4: A. orientalis (250 мг/кг ТБ) та парацетамолу (600 мг/кг ТБ) та Група 5: A. orientalis (500 мг/кг ТБ) та парацетамолу (600 мг/кг ТБ). Лікування проводили щодня протягом 5 днів поспіль. В останній день лікування та через 30 хв після отримання останньої дози мишам усіх груп вводили парацетамол, суспендований у 5% мас./Об. Акації у дозі 600 мг/кг, за винятком того, що групі 2 давали носій 5%. камедь акації тільки в фізіологічному розчині.
Оцінка біохімічних показників
Через три години після введення парацетамолу або акації, оброблених мишей вбивали шляхом вивиху шийки матки та відсікання голови. Зразки крові збирали у стерильні пластикові пробірки без добавок і центрифугували при 900 g протягом 15 хв при 4 ° C для збору сироватки. Печінку з різних груп швидко виймали, оглядали, зважували та зберігали частину при температурі -20 ° C для спектрофотометричного вимірювання концентрації GSH у печінці [20]. Діяльність концентрацій AST, ALT, гамма-глутамілтрансферази (GGT) та концентрації холестерину в сироватці крові вимірювали за допомогою автоаналізатора COBAS (Рош, Швейцарія), використовуючи набори, що постачаються виробником.
Дослідження гістопатології печінки
Шматочки печінки з тієї ж частки вирізали і фіксували у 10% формаліні. Тканини печінки промивали послідовно спадаючою промивною серією спиртів, потім заливали у парафіновий віск. За допомогою мікротома нарізати на тонкі зрізи (товщина 5 мкм). Потім їх фарбували гематоксиліном та еозином (H&E) та досліджували під світловим мікроскопом (Олімп, Японія).
Статистичний аналіз
Наведені дані є середнім значенням ± SEM. Різницю між засобами оцінювали за допомогою t-критерію Стьюдента з P значення на 0,05 рівня значущості.
Результати
Фітохімічний скринінг та кількісна оцінка
Фітохімічний скринінг показав наявність важливих фітохімічних інгредієнтів, таких як флавоноїди, фенольні сполуки та дубильні речовини. Алкалоїдів та сапонінів не було (табл. 1). Кількісна оцінка A. orientalis екстрактів містить 154,2 мг/г загального вмісту фенолу в сухому екстракті та 79,9 мг/г загального вмісту флавоноїдів у сухому екстракті (таблиця 1).
Токсичність
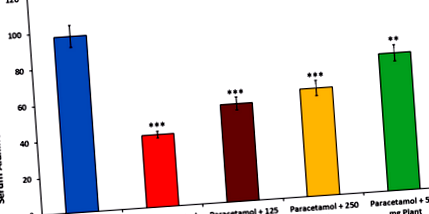
Парацетамол з концентрацією 600 мг/кг БВ, який вводили перорально, показав гепатотоксичність через 3 год, що видно з біохімічних та гістопатологічних показників дослідження, що вказує на помітне ураження печінки. Лікування парацетамолом суттєво збільшило рівень АЛАТ та АСТ у сироватці крові, 98 МО/л та 407 МО/л відповідно, як показано на рис. 1 та 2. Хоча у випадку сироваткового холестерину збільшення було незначним - 161 ммоль/л, як показано на (рис. 3).
Гістограми, що відображають ефект A. orientalis на вміст холестерину в сироватці крові в парацетамолі, який не отримували, контрольний контроль, парацетамол A. orientalis попередньо оброблених 125, 250, 500 мг/кг BW груп мишей. Зауважте, що у всіх дозах рівень холестерину був незначно знижений порівняно з групою мишей, які отримували парацетамол. Дані представлені у вигляді: середнє значення ± SEM, n = 6
Оцінка біохімічних показників
Попередня обробка с A. orientalis значно знизив значення АЛТ у сироватці крові порівняно з лікуванням лише парацетамолом у всіх групах лікування 54, 59, 76 МО/л відповідно. Зниження рівня АСТ у сироватці крові було значним на 177 та 254 МО/л при А. Східні (125 та 250 мг/кг), тоді як це мало незначний ефект при А. Східні (500 мг/кг), як показано на (рис. 1 і 2).
Значення холестерину в сироватці крові не показали помітних відмінностей між контрольною групою, яка отримувала парацетамол A. orientalis попередньо оброблені групи, як показано на (рис. 3).
Значення GGT у сироватці крові також не були значущими для парацетамолу, що отримував лікування, не отримував лікування та парацетамолу, попередньо обробленого A. orientalis групи, як показано на (рис. 4).
Гістограми, що відображають ефект A. orientalis на GGT у сироватці крові у парацетамолі, що лікується, контрольний, нелікований, парацетамол A. orientalis попередньо оброблених 125, 250, 500 мг/кг BW груп мишей. Зверніть увагу, що у всіх дозах рівні GGT були незначно підвищені порівняно з групою мишей, які отримували парацетамол. Дані представлені у вигляді: середнє значення ± SEM, n = 6
Крім того, рівні GSH у сироватці крові продемонстрували значне збільшення у необробленої контрольної групи та A. orientalis попередньо оброблені групи парацетамолу (245, 212, 174, 217 мкмоль/л) відповідно, порівняно з контрольною групою лише парацетамолу (161 мкмоль/л), як показано на (рис. 5).
Дослідження ваги печінки
Вага печінки була зменшена у всіх групах; необроблений, парацетамол попередньо оброблений A. orientalis. Зниження маси печінки було достовірним лише у нелікованої контрольної групи та 250 мг/кг маси тіла (4,4 та 4,7 г) відповідно порівняно з 5,2 г ваги печінки, обробленої парацетамолом, як показано на (рис. 6).
Дослідження гістопатології печінки
Крім того, гістопатологічний парацетамол, оброблений 600 мг/кг БВ, показав точковий геморагічний некроз тканини печінки, як видно на (рис. 7а). Нормальні клітини печінки та клітинні мембрани були помічені з прозорою цитоплазмою, що охоплювала характерні циркулярні інтактні ядра. Більш того, для парацетамолу, попередньо обробленого A. orientalis, загальна структура тканини печінки показала, що припинилось відновлення нормальної архітектури гістології печінки, як видно на (рис. 7c, d та e).
Гістологічні світлові мікрофотографії представляють фарбування тканин печінки гематоксиліном та еозином в обробленому парацетамолом, необробленому контролі, парацетамолі A. orientalis попередньо оброблені 125, 250, 500 мг/кг BW групи мишей (H&E X400). Лікований парацетамолом (a), необроблений контроль (b), парацетамол A. orientalis попередньо оброблений 125 (c), парацетамол A. orientalis попередньо оброблений 250 (d), парацетамол A. orientalis попередньо оброблений 500 (e). Зверніть увагу, що структура печінки майже нормалізована в Росії A. orientalis-попередньо оброблені групи мишей порівняно з групою, обробленою парацетамолом
Обговорення
Парацетамол вважається одним з найкорисніших жарознижуючих та знеболюючих препаратів у ліках. Однак вищі дози споживання парацетамолу не рекомендується, оскільки це негативно впливає на клітини печінки та сприяє центрилобулярному некрозу печінки при токсичних дозах у клітинах печінки [21]. Моделі токсичності печінки, спричиненої парацетамолом та CCl4, зазвичай використовують для перевірки здатності печінки захищати препарат [22], а ступінь токсичності печінки оцінюють за рівнем вивільнених печінкових цитоплазматичних ферментів, таких як АЛАТ та АСТ [23].
Механізм дії парацетамолу включає його біоактивацію та подальше утворення реактивного метаболіту. Біоактивований парацетамол перетворюється в токсичний N-ацетил-р-бензохінонімін (NAPQI) за допомогою цитохрому P450 і спричинює окислювальний стрес, що призводить до зменшення виснаження глутатіону (GSH) [24, 25]. Поряд із ініціюванням окисного стресу парацетамол викликає дисфункцію мітохондрій та нерегулярний гомеостаз кальцію, що призводить до загибелі клітин [3, 6]. Крім того, чутливий до активного кисню ядерний фактор NF-KappaB також сприяє гепатотоксичності, спричиненій парацетамолом [26]. Оскільки парацетамол є широко використовуваним знеболюючим та жарознижуючим засобом, дослідники зацікавлені шукати шляхи захисту печінки від токсичності печінки, спричиненої парацетамолом. Традиційні лікарські рослини є одним із таких варіантів гепатоптотекції, які вже використовувались для вирішення різних проблем, пов’язаних зі здоров’ям.
У поточному дослідженні рівні АЛТ та АСТ були знижені у різних попередньо оброблених групах мишей порівняно з контролем, обробленим парацетамолом, який показав значно вищі значення майже у всіх A. orientalis попередньо оброблені групи. Зниження концентрацій AST та ALT після попередньої обробки було хорошим показником інтактної мембрани печінкової клітини та відновлення нормальної структури тканини печінки після шкідливого токсичного впливу парацетамолу на клітини печінки. Це досягається зниженням та нормалізацією рівнів трансаміназ шляхом виліковування печінкової паренхіми та регенерації нових гепатоцитів [35].
Ацетамінофен пов'язується з білком, слідом за дисфункцією мітохондрій, окислювальним стресом, утворенням пероксинітрилу є послідовними руйнівними діями токсичності гепатоцитів [36]. Парацетмол при передозуванні реагує з CYP2E1, який входить до системи змішаних функцій оксидази цитохрому P450, і утворює токсичний N-ацетил-п-бензохінонеімін (NAPBQI) [37], який, у свою чергу, викликає небезпеку ксенобіотичних сполук в організмі. Ураження печінки, спричинене парацетамолом, залежить від ферментативної активності CYP2E1, а також від наявності антиоксидантного ферменту глутатіону як гепатопротекторної системи [38].
Гістопатологічна оцінка за допомогою фарбування гематоксиліном та еозином виявила клітинну морфологію, показала захисний ефект A. orientalis при відновленні нормальної архітектури тканин печінки. Ці результати досягаються за допомогою біохімічних показників. У традиційній медицині для лікування збоїв у роботі печінки використовуються різні рослинні склади [48], які можуть бути пов’язані з наявністю деяких інгредієнтів гематоксиліну та еозину в рослинних екстрактах. Оскільки попередній фітохімічний скринінг екстрактів виявив наявність високих рівнів флавоноїдів та фенольних сполук, про які повідомлялося про їх антиоксидантну та гепатопротекторну активність [49]. Тому ми можемо посилатися на корисну дію A. orientalis до цих інгредієнтів.
Висновок
Це дослідження дає потенціал, який A. orientalis, спільно з парацетамолом, може використовуватися для захисту тканини печінки. Подальші дослідження рекомендуються для вивчення точного механізму дії цього виду як гепатопротекторного здатного агента.
- Періодична дієта з низьким енергоспоживанням у техніко-економічному обґрунтуванні CKD MIX UP - Повний текст
- Лапароскопічна ревізія шлункового шунтування для неадекватної початкової втрати ваги - Повний текст
- Лікування відмови від куріння, яке контролюється Інтернетом для курців із зайвою вагою та ожирінням - Повний текст
- Вплив групи психотерапевтичного терапевтичного терапії на післяопераційних баріатричних хворих SpringerPlus Повний текст
- Jacks Bar And Steakhouse Вишукані страви в самому центрі Нью-Хейвена з повним меню