Гепатопротекторні ефекти Orthosiphon stamineus Екстракт індукованого тіоацетамідом цирозу печінки у щурів
1 кафедра молекулярної медицини медичного факультету Малайського університету, Куала-Лумпур 50603, Малайзія
Анотація
1. Вступ
2. Матеріали та методи
2.1. Рослинні матеріали та хімікати
О. stamineus листя рослин було отримано від Ethno Resource Sdn Bhd. Завод було ідентифіковано, а зразок ваучера зберігався в нашій лабораторії для подальшого використання. Висушені та подрібнені в порошок листя (100 г) екстрагували 900 мл 95% -ного етанолу протягом 48 годин, а етаноловий екстракт фільтрували і випаровували під низьким тиском за допомогою роторного випарника типу Бучі з отриманням неочищеного висушеного екстракту. Встановлено, що процентний вихід етанолових екстрактів становить 8,1% (мас./Мас.). Потім сухий екстракт розчиняли в Твін 20 (10% мас./Об.) І вводили перорально щурам у концентраціях 100 і 200 мг/кг маси тіла.
Тіоацетамід фірми (Sigma-Aldrich, Швейцарія) та всі інші використовувані хімічні речовини були аналітичного класу та купувались переважно у Sigma-Aldrich та Fisher. Хімічну речовину розчиняли у стерильній дистильованій воді та вводили щурам внутрішньочеревно в концентрації 200 мг/кг маси тіла [18]. Силімарин (Міжнародна лабораторія, США) як стандартний препарат і розчинявся в Твін 20 (10% мас./Об.) І перорально вводився щурам у концентрації 50 мг/кг маси тіла [19].
2.2. Визначення загальної кількості фенольних та флавоноїдів
O. stamineus екстракту оцінювали їх загальний вміст фенолу за допомогою реагенту Фолін-Ціокальтеу та розраховували як еквіваленти галової кислоти в мг (GAE)/г екстракту згідно з колориметричним методом Фоліна-Дениса [20]. Однак загальні флавоноїди визначали за допомогою колориметричного методу хлориду алюмінію і виражали як еквіваленти кверцетину в мг (QE)/г екстракту, як описано Dowd [21]. Обидва аналізи проводили у трьох примірниках.
2.3. Тварини
Дорослий чоловік здоровий Спрег Долі (SD) щури вагою 200–250 г були отримані з підрозділу Animal House, Медичний факультет, Малайський університет, Малайзія. Їх утримували в клітках із дротовим дном при температурі 25 ± 3 ° C, вологості 50–60% та циклі 12 годин світло-темно принаймні тиждень до експерименту. Під час експерименту вони підтримувались у стандартних умовах утримання та вільному доступі до стандартної дієти та води ad libitum. Експериментальний протокол був затверджений Комітетом з етики тварин; з етичним № (PM 28/08/2009/MAA (R). Протягом експериментів застосовувались усі критерії догляду за тваринами, підготовлені Національною академією наук і викладені в «Посібнику з догляду та використання лабораторних тварин».
2.4. Експериментальний дизайн
Тварин випадковим чином розподіляли на п’ять груп по вісім щурів у кожній і обробляли наступним чином.
Група 1
10% Твін 20 (5 мл/кг, перорально) щодня протягом 2 місяців + стерильна дистильована вода (1 мл/кг, в/в) тричі на тиждень протягом 2 місяців (нормальна контрольна група).
Група 2
10% Твін 20 (5 мл/кг, перорально) щодня протягом 2 місяців + TAA (200 мг/кг, в/в) тричі на тиждень протягом 2 місяців (гепатотоксична група позитивного контролю).
3 група
Силімарин (50 мг/кг, перорально) щодня протягом 2 місяців + TAA (200 мг/кг, в/в) тричі на тиждень протягом 2 місяців (добре відомий стандартний препарат гепатопротекторної групи).
4 група
O. stamineus (200 мг/кг, перорально) щодня протягом 2 місяців + TAA (200 мг/кг, в/в) тричі на тиждень протягом 2 місяців (група лікування, висока доза).
5 група
O. stamineus (100 мг/кг, перорально) щодня протягом 2 місяців + TAA (200 мг/кг, в/в) тричі на тиждень протягом 2 місяців (група лікування, низька доза).
Ваги тіла всіх тварин вимірювали щотижня. Всіх щурів забивали через 24 години після останньої обробки та на ніч голодування під наркозом діетилового ефіру. Зібрані зразки крові; сироватку відокремлювали для аналізу біомаркеру печінки. Печінку та селезінку збирали, промивали фізіологічним розчином, промокали фільтрувальним папером і зважували. Грубе обстеження проводилось для вивчення будь-яких відхилень, що розвиваються в органах. Згодом печінку всіх тварин піддавали гістопатологічному дослідженню сліпо.
2.5. Біохімічна та гістопатологічна експертиза
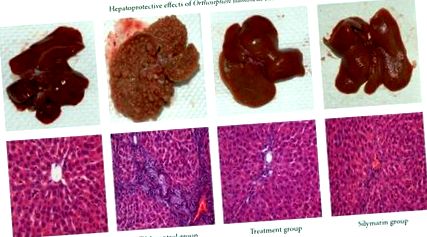
Зібрані зразки крові відокремлювали при 2500 об/хв протягом 15 хвилин після повного згортання. Сироватка для аналізу біомаркерів печінки, таких як аспартатамінотрансфераза (AST), аланінамінотрансфераза (ALT), лужна фосфатаза (ALP), білірубін, загальний білок (TP) та альбумін, аналізували спектрофотометрично стандартними автоматизованими методиками згідно з процедурами, описаними виробники в Центральній діагностичній лабораторії Медичного центру Університету Малайї. Печінку розрізали на шматочки і шматочки фіксували у 10% забуференному розчині формальдегіду для гістологічного дослідження. Фіксовані тканини обробляли автоматизованою машиною для обробки тканин. Тканини вкладали у парафіновий віск звичайними методами. Розділи 5 μм товщиною готували, а потім фарбували гематоксилін-еозином (ВІН). Після цього зрізи спостерігали під мікроскопом на предмет гістопатологічних змін, і їх мікрофотографії знімали.
2.6. Оцінка малондіальдегіду (MDA) у тканинах печінки
Зразки печінки негайно промивали крижаним сольовим розчином, щоб видалити якомога більше крові. Гомогенати печінки (10% мас./Об.) Готували в холодному 50 мМ фосфатному буфері калію (рН 7,4) за допомогою гомогенізатора в льоду. Клітинний сміття видаляли центрифугуванням при 4500 об/хв протягом 15 при 4 ° C за допомогою холодильної центрифуги. Супернатант використовували для оцінки рівня малондіальдегіду (MDA) за допомогою набору (Cayman Chemical Company, США).
2.7. Статистичний аналіз
Статистичну значимість оцінювали за допомогою одностороннього дисперсійного аналізу (ANOVA) з подальшим тестом багаторазового порівняння Бонферроні. Всі значення були виражені як середнє значення ± S.E.M. та значення
було визнано значущим порівняно з відповідною контрольною групою, що використовує програму SPSS для Windows версії 18 (SPSS Inc. Чикаго, Іллінойс, США).
3. Результати
3.1. Вага тіла, печінки та селезінки
До початку лікування щури важили 200–250 г, а через два місяці тварини з нормальними групами HD, LD та силімарину досягали середньої маси тіла відповідно 254,9, 232,7, 263,3 та 257,0 г. Однак у позитивної контрольної групи TAA середня маса тіла зменшилась до 202,0 г, але без істотної різниці порівняно з нормальною контрольною групою. Не було значної різниці між групами, але тривалий прийом ТАА привів до значного збільшення маси печінки порівняно із звичайними щурами. Значення середньої відносної маси печінки (LW/BW) відсотка показали значну різницю між оброблюваними групами порівняно з групою TAA (Таблиця 1).
проти нормальної контрольної групи, b
проти контрольної групи TAA, і c
3.2. Біохімічні та антиоксидантні параметри
). У той же час флавоноїди становили 171,4 ± 0,006 мг (еквіваленти кверцетину) на г екстрактів (стандартне рівняння кривої:
, ) і співвідношення флавоноїдів/фенолів 0,58. Таким чином, фенольні сполуки були переважними антиоксидантними компонентами в Росії O. stamineus екстракти, які призводять до більш потужного ефекту очищення радикалів.
3.3. Гістопатологічна експертиза
4. Обговорення
На закінчення це дослідження показало, що O. stamineus етанолові екстракти мають гепатопротекторну дію, що було доведено біохімічним та гістопатологічним аналізом. Відповідно, рослинні екстракти можуть бути ефективною рослинною рослиною для хімічно-індукованого ураження печінки, хоча ця знахідка потребує подальших досліджень, щоб знати активні компоненти, що з’являються для захисту печінки щурів від цирозу.
Подяка
Ця робота була підтримана дослідженням Грант з Університету Малайї, Малайзія №. (PS182/2009C).
Список літератури
- Екстракт зеленого кавового зерна Побічні ефекти Мій день з кавою
- КАПСУЛИ ЗЕЛЕНОГО ЧАЮ JeaKen - капсули екстракту зеленого чаю, що спалюють жир, 120 х 850 мг - втрата жиру
- Капсули зеленого чаю 850мг екстракт для схуднення Дієта Легке ковтання Етсі
- Екстракт зеленого чаю для схуднення та схуднення Nature s Best
- Використання фолієвої кислоти, переваги; Побічні ефекти